美极梅奇酵母对迟采赤霞珠葡萄酒品质的影响
2021-09-03林雪青秦绍智王世平孙玉霞
林雪青,张 翔,张 将,秦绍智,王世平,孙玉霞*
(1.山东省葡萄研究院 山东省葡萄栽培与精深加工工程技术研究中心,山东 济南 250100;2.齐鲁工业大学(山东省科学院),山东 济南 250353;3.云南香格里拉太阳魂酒庄产业有限公司,云南 迪庆藏族自治州 674400;4.山东省农业科学院农产品研究所 山东省农产品精深加工技术重点实验室 农业部新食品资源加工重点实验室,山东 济南 250100)
迟采葡萄酒是一种将延迟采收的葡萄,经过破碎压榨发酵后而酿成的酒。迟采葡萄酒使用的葡萄因延迟采收过分成熟使含糖量很高,而这也导致迟采葡萄酒的挥发酸含量比正常葡萄酒含量高。非酿酒酵母是一类存在于葡萄园和葡萄表皮且参与葡萄酒酿造并对葡萄酒风味产生影响,除酿酒酵母外的其他酵母的总称[1]。近年来研究发现,有些非酿酒酵母在与酿酒酵母混合发酵时能够对葡萄酒产生积极影响,非酿酒酵母拥有比酿酒酵母更好的产酯能力[2],可降低葡萄酒的乙醇含量[3],在发酵过程中产生的糖苷酶[4]、果胶酶[5-6]和蛋白酶[7]等均多于酿酒酵母所产生的含量,这些发酵产物都对葡萄酒的香气产生显著影响。此外,TOFALO R等[8]研究发现,美极梅奇酵母在混合发酵时可以降低葡萄酒中挥发酸含量,增加其高级醇、酯和萜烯类物质的含量,同时会提升花香等香气;VARELA C等[9]报道美极梅奇酵母属酵母与酿酒酵母混合发酵可以降低成品酒中的挥发酸含量,并降低葡萄酒中的乙醇含量。虽然非酿酒酵母具有上述比酿酒酵母优良的性能,但是因其酒精和二氧化硫的耐受性较差,往往只在发酵前期发挥作用,葡萄酒的发酵主要依靠酿酒酵母对葡萄汁中糖类物质的转化,在转化过程中产生的众多物质对葡萄酒的风味具有重要的影响。
香气是葡萄酒品质的一个重要衡量指标,同时也是评价葡萄酒风味和典型性的重要因素[10],酵母对葡萄酒挥发性香气成分有着重要的影响。葡萄酒的香气来源包括三类:品种香气、发酵香气及陈酿香气[11]。品种香气是葡萄品种独特的香气,不同的品种有着其独特的品种香气。有研究表明葡萄酒中的品种香气受葡萄果实中降异戊二烯[12]以及萜烯类和芳香族类化合物的影响,而酿酒酵母细胞中β-葡萄糖苷酶的活性又与萜烯类化合物结合葡萄酒中的释放有关,从而有助于增加葡萄酒的品种香气[13]。酿酒酵母对葡萄酒发酵香气也有着重要的作用,有研究表明酵母细胞会通过代谢氨基酸用于合成香气物质[14],此类香气物质占葡萄酒香气的比例最大。陈酿会增加葡萄酒的层次感,赋予葡萄酒更多的复杂风味,酵母自溶是产生葡萄酒陈酿香气的重要过程[15],在这一过程中细胞中的酯类、酮类、醛类物质得到释放,增加了葡萄酒的香气[16]。
本研究使用商业酿酒酵母(Saccharomyces cerevisiae)CY3079与实验室筛选的美极梅奇酵母(Metschnikowia pulcherrima)MP3007,以迟采赤霞珠葡萄为原料,通过分析浸渍发酵与清汁发酵后迟采葡萄酒中理化指标、挥发性香气物质和感官品评风味品质的变化,探究美极梅奇酵母MP3007对迟采葡萄酒品质的影响,为美极梅奇酵母MP3007在迟采葡萄酒实际生产中的应用提供参考。
1 材料与方法
1.1 材料与试剂
赤霞珠葡萄:云南省德钦县梅里酒庄葡萄园,单干双臂,常规管理,2019年11月20日采收(通常本产区赤霞珠葡萄9月下旬采收)。可溶性固形物为33.9°Bx,pH为4.16,可滴定酸为4.77 g/L。
美极梅奇酵母(M.pulcherrima)MP3007:保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号CGMCC No.16078;酿酒酵母(S.cerevisiae)CY3079:上海杰兔工贸有限公司。
氢氧化钠(分析纯):天津市风船化学试剂科技有限公司;氯化钠(分析纯):国药集团化学试剂有限公司;4-甲基-2-戊醇(色谱纯):美国Aldrich公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)固体培养基:葡萄糖2%,酵母浸粉1%,蛋白胨2%,琼脂2%,氯霉素0.01%。121 ℃灭菌15 min。
1.2 仪器与设备
JA2003N电子天平:上海佑科仪器仪表有限公司;BX-1手持糖度计:日本京都电子公司;STAR A211pH计:赛默飞世尔科技公司;GC-7890B/MS-5977A气相色谱-质谱联用仪、DB-WAX 色谱柱:美国Agilent公司。
1.3 方法
1.3.1 样品处理
将美极梅奇酵母MP3007从YEPD固体培养基用接种环接种至YPD液体培养基中,于30 ℃、150 r/min扩培24 h,24 h后通过血球计数板计数方法[17]进行浓度确定。
处理一(清汁发酵):将赤霞珠迟采葡萄手工破碎后,用8层纱布过滤处理,将得到的葡萄汁添加20 mg/L的偏重焦亚硫酸钾,后将葡萄汁分装于6个250 mL的锥形瓶,每瓶装入200mL,编号CK-1,CK-2,CK-3,CF-1,CF-2和CF-3。其中CK的三组为对照组平均值,CF三组为实验组平均值。
处理二(浸渍发酵):将赤霞珠迟采葡萄手工破碎后的皮汁混合物添加20 mg/L的偏重焦亚硫酸钾后分装至6个250 mL的锥形瓶内,皮汁混合物质量与200 mL葡萄汁的质量相同,分别编号CK-1',CK-2',CK-3',CF-1',CF-2'和CF-3'。其中CK'的三组为对照组平均值,CF'三组为实验组平均值。
处理一和处理二中的对照组接种菌株CY3079,接种量为1×106CFU/mL;处理一和处理二中的实验组首先接种菌株MP3007,接种量为1×107CFU/mL,于48h后接种菌株CY3079,接种量为1×106CFU/mL。接种完成后使用单向排气阀密封,于25 ℃培养箱中恒温静置发酵,直至发酵自然结束。
发酵过程中监测含糖量的变化,待含糖量稳定后取酒样,于5 000×g,4 ℃离心2 min,取上清液于-20 ℃储存待测。
1.3.2 分析检测
(1)理化指标测定
迟采葡萄汁中的可滴定酸以及迟采葡萄酒酒样中的残糖、总酸、挥发酸、酒精含量按照葡萄酒国家标准GB/T 15038—2005《葡萄酒、果酒通用分析方法》中的相关检测方法对进行检测;迟采葡萄汁的初始含糖量使用手持折光计进行检测;迟采葡萄汁和迟采葡萄酒酒样的pH使用pH计检测。
(2)挥发性物质测定
挥发性物质的检测采用顶空固相微萃取-气质联用(headspace solid-phase micro extraction-gas chromatographymass spectrometry,HS-SPME-GC-MS)的方法[18]。运用美国国家标准技术研究所(national institute of standards and technology,NIST)11谱库对检测结果进行初步检索分析,结合人工谱图解析对化学成分定性;使用内标法对挥发性物质的含量定量。
(3)感官评定
对迟采葡萄酒的感官品评时,会将各葡萄酒样品放于通风良好无任何气味和噪音的房间,由经过专业培训的品评人员采用定量分析描述法对各酒样进行感官评价。品评小组成员先要各自对酒样进行品评,记录下可以反应当前酒样特点的描述性词汇,后经由品评组长总汇全部成员的全部描述性词汇,经讨论确定最终的描述性词汇包括:花香味、果酱味、焦糖味、浆果味、生青味、香料味和典型性。
品评采用的标度一般为一条10 cm的直线,从左向右表示某种特征的强渡逐渐增强,由品评组成员在直线上标记特征的强烈程度,最后统计各成员对确定的7种描述性特征的标记,转化为数值输入电脑进行统计分析。
1.3.3 数据处理
采用SPSS 21软件进行数据分析,采用方差分析One-Way(P<0.05)法进行多组间比较。采用SPSS 21.0软件进行主成分分析绘制得分图和载荷图。
2 结果与分析
2.1 美极梅奇酵母对迟采葡萄酒理化指标的影响
采用美极梅奇酵母与酿酒酵母混合发酵的迟采葡萄酒和酿酒酵母纯种接种发酵的迟采葡萄酒的主要理化指标检测结果如表1所示。
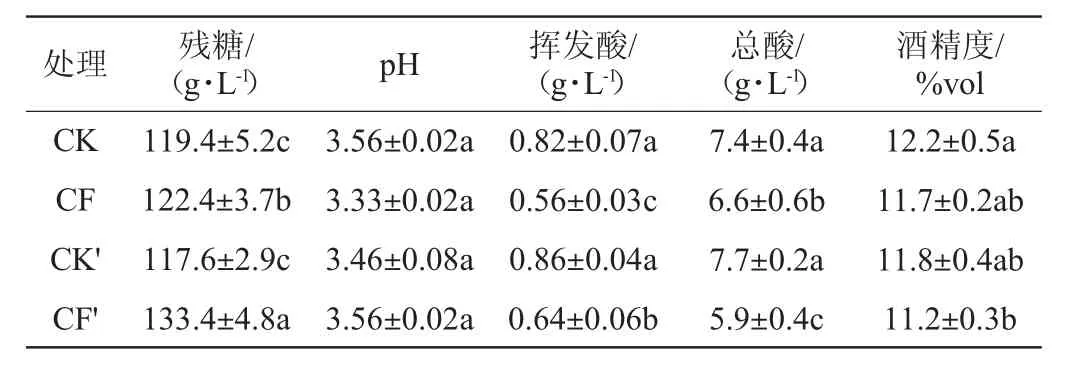
表1 迟采葡萄酒对照组和实验组的理化指标Table1 Physical and chemical indexes of control group and experimental group of late-harvested grape wine
从表1可以看出,无论是浸渍发酵还是清汁发酵,菌株MP3007参与的实验组挥发酸、总酸和最终的酒精含量均显著低于对照组(P<0.05)。其中菌株MP3007参与的实验组在清汁发酵时挥发酸比对照组降低了31.7%,总酸含量降低了10.8%,酒精度降低了4.1%;在浸渍发酵时挥发酸比对照组降低了25.6%,总酸含量降低了23.4%,酒精度降低了5.1%。菌株MP3007与菌株CY3079混合发酵降低挥发酸含量效果明显。由于两种酵母的酒精产率不同,菌株MP3007比菌株CY3079的酒精产率低,混合发酵时优先接入菌株MP3007,菌株MP3007会将葡萄糖转化为酒精和其他副产物,而菌株CY3079纯发酵的对照组则会产生更多的酒精。另有研究表明,皮渣加入发酵体系中会降低发酵体系中总糖的含量[19],总糖含量的降低导致了酒精度的降低,因此相比于清汁发酵,浸渍发酵组的酒精含量展现出较低的水平。
2.2 美极梅奇酵母对迟采葡萄酒香气成分的影响
2.2.1 酯类物质
迟采葡萄酒对照组和实验组酒样GC-MS检测结果中酯类物质的含量见表2。

表2 迟采葡萄酒中酯类物质含量Table2 Contents of esters in late-harvested grape wine
从表2可知,混合发酵显著提高了乙酸异戊酯、己酸乙酯、辛酸乙酯、癸酸乙酯的含量,其中增加比例最明显的为乙酸异戊酯,其次是己酸乙酯、癸酸乙酯。与对照组相比,混合发酵清汁时乙酸异戊酯的含量增加了54.7%,浸渍发酵时增加了32.3%,正己酸乙酯的含量在混合发酵清汁时增加了40.4%,浸渍发酵时增加了18.9%,癸酸乙酯的含量在混合发酵清汁时则增加了32.8%,浸渍发酵时增加了21.1%。此外表2揭示了浸渍发酵和混合发酵均可提高表中酯类物质的总含量。表2中丁酸乙酯、己酸乙酯、辛酸乙酯和癸酸乙酯的气味活度值(odor activity value,OAV)均>10,此4种物质对迟采葡萄酒果香的贡献度突出;乙酸苯乙酯和月桂酸乙酯的OAV>1,二者对迟采葡萄酒花香有较大贡献度。以上物质是赋予葡萄酒花香味和果香味的重要物质,对改善葡萄酒香气具有积极作用。
由图1可知,共有5种OAV>1的酯类物质分布在第一象限和第四象限,占酯类物质种类的62.5%,这表明与清汁发酵相比,浸渍发酵能够产生更多种类的酯类物质,增加迟采葡萄酒香气的复杂程度。

图1 酒样中OAV>1的化合物在PC1和PC2上的载荷图(a)和主成分分析得分图(b)Fig.1 Loading plot (a) and principal component analysis score graph(b) of aroma compounds (OAV>1) on PC1 and PC2 of wine samples
在浸渍发酵情况下,混合发酵会进一步提高酯类物质的总含量。暗示菌株MP3007可以利用葡萄皮浸渍出的物质合成酯类物质。发酵体系中的可同化氮源是酵母合成香气类物质的前体物质[20],浸渍可能使发酵体系中含有较多的可同化氮,在发酵过程中被MP3007酵母细胞转化为酯类物质,VARELA C等[21]研究表明,美极梅奇酵母与酿酒酵母混合发酵能够提高酯类物质的含量,此实验结果证明美极梅奇酵母MP3007同样具有在混合发酵时增加酯类物质含量的能力。
2.2.2 醇类物质
迟采葡萄酒对照组和实验组酒样GC-MS检测结果中醇类物质的含量见表3。葡萄酒中的高级醇是葡萄酒香气的重要组成成分,有研究发现当葡萄酒中的高级醇含量低于300 mg/L时,可以提高葡萄酒风味的复杂性[22]。从表3可以看出,各实验组醇类物质总含量均低于300 mg/L,其中CK组的醇类物质总量最高,为126.26 mg/L,CK'组的醇类物质总量最低,为87.30 mg/L。混合发酵对某些醇类物质的含量有明显影响,如显著降低异丁醇、正己醇、苯乙醇含量,显著提高异戊醇的含量(P<0.05)。与对照组相比,清汁发酵时1-己醇含量降低了5.4%,苯乙醇含量降低了39.1%,异丁醇含量降低了16.7%,异戊醇含量升高了9.2%;浸渍发酵时正己醇含量降低了45.7%,苯乙醇含量降低了14.2%,异丁醇含量降低了20.8%,异戊醇含量提高了50.6%。除上述醇类物质外,2,3-丁二醇在浸渍发酵与清汁发酵组合中的含量变化不同。在清汁发酵时混合发酵组合比对照组2,3-丁二醇含量升高了63.0%,但是在浸渍发酵时混合发酵组与对照组的2,3-丁二醇含量没有明显差异(P>0.05)。表3中显示OAV>1的醇类物质为异戊醇、1-辛醇和苯乙醇,表明此3种醇类物质对迟采葡萄酒的香气贡献度较大。

表3 迟采葡萄酒中醇类物质含量Table3 Content of alcohols in late-harvested grape wine
有研究表明,葡萄酒中的醇类物质来源于发酵以及酵母对氨基酸的转化[23]。清汁发酵时,混合发酵组的醇类物质总含量比对照组降低了17.7%;但是浸渍发酵时,混合发酵组的醇类物质总含量比对照组升高了22.9%。试验中,异戊醇含量在检测出的醇类物质中占据主要地位,其含量占醇类物质总含量的43.3%~69.1%,混合发酵显著降低了其他醇类物质的含量,却显著提高了异戊醇的含量,尤其是在浸渍发酵时,提升幅度很大。发酵过程中异戊醇的合成前体氨基酸为亮氨酸[24],实验结果表明菌株MP3007可能具有较强的亮氨酸转化能力。
2.2.3 醛酸类、酮类和萜烯类物质
迟采葡萄酒对照组和实验组酒样GC-MS检测结果中醛酸类、酮类和萜烯类物质的含量见表4。从表4可以看出,清汁发酵时与对照组相比,混合发酵能够降低33.6%的辛酸含量,在浸渍发酵时辛酸含量降低了28.8%,并且浸渍发酵时无论对照组还是混合发酵组,辛酸含量均明显低于清汁发酵的对照组和混合发酵组。辛酸是一种具有腐臭味的物质,对葡萄酒风味具有不利的影响,表4中显示辛酸的OAV在CK组中最高(2.14),而在CF'组中最低(0.94),暗示了浸渍发酵和混合发酵可削弱辛酸给葡萄酒带来的不良风味。己酸是一种具有奶酪味的物质,混合发酵能够显著提高己酸的含量(P<0.05),在清汁发酵时其含量提高了34.6%,浸渍发酵时其含量提高了1.75倍。
萜烯类化合物的阈值较低,是葡萄酒中花香味和果香味的重要组成部分[25],萜烯类物质的含量与酵母菌株种类以及接种方式有很大关系[26]。从表4可知,浸渍发酵时混合发酵比对照降低了17.8%苯乙烯含量,但清汁发酵时二者无明显差异。香茅醇能够赋予葡萄酒玫瑰花香风味,混合发酵显著提高了香茅醇的含量,清汁发酵时含量提高了33.3%,浸渍发酵时含量提高了77.8%。大马士酮具有蜂蜜味、甜果香[27],但仅在清汁发酵时检测出,浸渍发酵时并未检测到,其含量在混合发酵组中显著提高,比CK组提高了2倍,其OAV在CF组中较大(5400),表明混合发酵可赋予迟采葡萄酒更明显的花香风味。
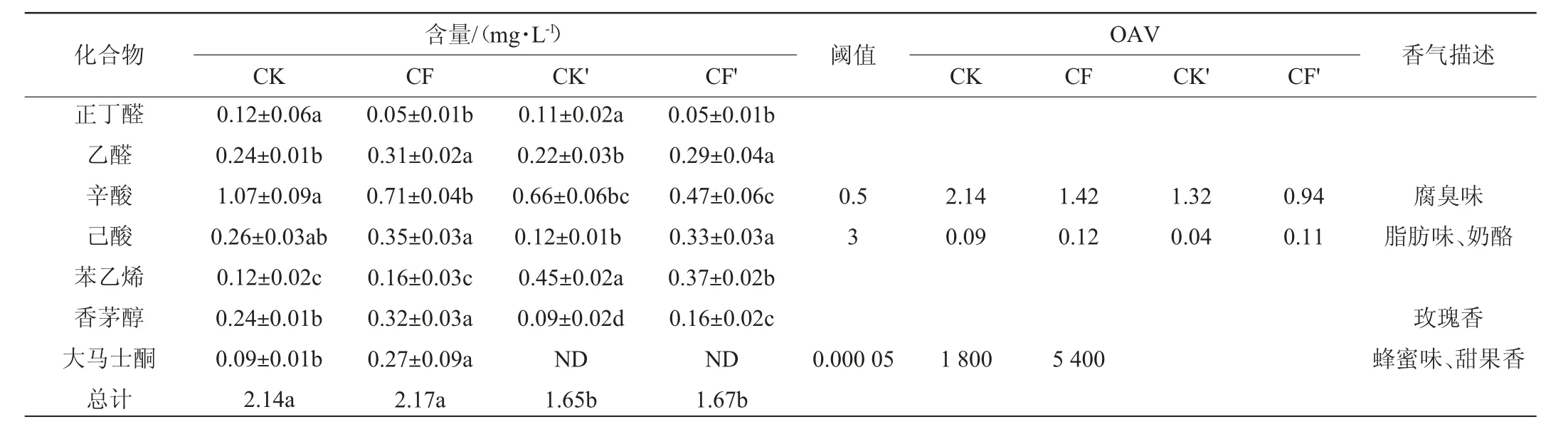
表4 迟采葡萄酒中醛酸类和萜烯类物质含量Table4 Content of aldehydic acids and terpenes in late-harvested grape wine
2.3 美极梅奇酵母对迟采葡萄酒感官品质的影响
从图2可以看出,与对照组相比,混合发酵组的迟采葡萄酒感官品质更突出,表现为明显的花香味和果香味,其生青味比对照组弱,这一现象与酯类物质含量以及OAV的结果一致。丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、乙酸苯乙酯和月桂酸乙酯对葡萄酒的花香和果香贡献程度很大,表2中显示上述酯类物质在混合发酵组中均得到了提高,尤其是在浸渍发酵时,上述酯类物质的含量提升更加显著,且OAV均>1;异丁醇是赋予葡萄酒生青味的重要物质,表3显示混合发酵使异丁醇含量显著降低。另外,图2显示浸渍发酵时混合发酵组在花香味、浆果味、典型性方面比清汁发酵时混合发酵组表现突出,而后者则在香料味、焦糖味、果酱味方面表现突出。综上所述,菌株MP3007在降低迟采葡萄酒生青味,增加花香味和果香味,提高复杂性方面展现了优点,在迟采葡萄酒酿造领域具有应用潜力。

图2 迟采葡萄酒对照组和实验组感官评价结果Fig.2 Sensory evaluation results of control group and experimental group of late-harvested grape wine
3 结论
赤霞珠迟采葡萄经不同处理发酵后的葡萄酒差异明显。与对照组相比,混合发酵清汁时可以降低葡萄酒中31.7%的挥发酸含量,14.5%的总酸含量以及4.1%的酒精含量;混合浸渍发酵时可以降低葡萄酒中25.6%的挥发酸含量,8.4%的总酸含量以及5.1%的酒精含量。同时,混合发酵还会增加葡萄酒中乙酸异戊酯、辛酸乙酯、癸酸乙酯等酯类物质的含量;混合发酵对某些醇类物质的含量也存在影响,可以增加异戊醇、2,3-丁二醇和异丁醇的含量而降低1-己醇、1-辛醇和苯乙醇的含量;另外,与对照组相比混合发酵可以赋予葡萄酒更多的花香味、果酱味和焦糖味,降低葡萄酒的生青味。浸渍发酵比清汁发酵会产生更多种类的酯类物质,并且显著提高了酯类物质的总含量,赋予葡萄酒更明显的花香味和浆果味。初步认为美极梅奇酵母菌株MP3007在迟采葡萄酒酿造领域具有应用潜力。
