国产PD-1抑制剂治疗63例晚期肺癌患者的回顾性分析
2021-09-03曹云亮王雨楠吴梦嘉陆彦伊周国旗柏玉举
何 波,曹云亮,王雨楠,吴梦嘉,陆彦伊,周国旗,柏玉举,马 虎,胡 威
(1.遵义医科大学附属肿瘤医院 胸部肿瘤科,贵州 遵义 563099;2.遵义医科大学第二附属医院 胸部肿瘤科,贵州 遵义 563099;3.遵义市红花岗区人民医院 呼吸与危重症医学科,贵州 遵义 563000)
肺癌是全球最常见的恶性肿瘤之一,也是我国常见的呼吸系统恶性肿瘤,死亡率居全球恶性肿瘤首位[1]。其主要包括非小细胞肺癌( Non-small cell lung cancer,NSCLC)和小细胞肺癌(Small cell lung cancer,SCLC)两类。过去,晚期NSCLC患者的5年生存率不足5%[2],近年来随着分子靶向及抗血管生成药物的兴起,晚期NSCLC患者生存率不断攀升,但仍有部分患者面临着缺乏分子靶点或靶向药物耐药等问题;而相比之下SCLC患者预后更差,且缺乏强有效的治疗手段,5年生存率微乎其微。免疫治疗是继手术、放化疗、靶向治疗后又一种新兴,且极具前景的抗肿瘤治疗手段之一。其中,以程序性死亡蛋白-1(Programmedcell death protein1,PD-1)/程序性死亡蛋白配体-1(Programmed death ligand 1,PD-L1)抑制剂为主的免疫治疗是当前临床研究的热点,Checkmate、Keynote、IMpower系列临床研究[3-9]已证实进口PD-1/PD-L1抑制剂在晚期肺癌适应人群中的有效性及安全性,此外,多款国内自主研发的PD-1抑制剂在晚期肺癌领域亦暂露头角[10-11],正在逐渐改变着晚期肺癌的治疗格局,但上述药物研发应用周期短,上市时间不长,且可能潜在多器官、多系统免疫相关不良反应(Immune-related adverse events,irAEs)的可能,有待临床实践验证。
本研究旨在回顾性分析我院单中心晚期肺癌患者使用国产PD-1抑制剂治疗的疗效及安全性,为更多接受免疫治疗晚期肺癌患者提供“真实世界”的治疗经验,现报道如下。
1 资料与方法
1.1 对象 回顾性收集2018年4月至2020年9月于遵义医科大学附属肿瘤医院接受国产PD-1抑制剂治疗的晚期肺癌患者的临床资料。本研究已通过我院伦理委员会批准。
1.2 纳入及排除标准
1.2.1 纳入标准 ①经细胞学或病理学确诊为肺癌;②年龄>18周岁;③根据临床分期为IV期的患者(参考2017年AJCC第8版分期标准);④美国东部肿瘤协作组(Eastern cooperative oncology group,ECOG) PS评分≤2分;⑤至少接受2~3个周期免疫治疗;⑥具有至少1个可测量病灶;⑦接受PD-1抑制剂治疗前完善常规的基线检查(血常规、血液生化、心电图、心肌酶学、甲功及胸腹部CT等)。
1.2.2 排除标准 ①无明确病理诊断信息;②合并其他恶性肿瘤;③合并重要脏器功能不全;④患有严重精神障碍疾病;⑤需要长期口服皮质类激素;⑥随访截止时未完成2个周期的免疫治疗。
1.3 治疗方案 纳入分析的晚期肺癌患者均接受国产PD-1抑制剂(包括信迪利单抗注射液(Sintilimab)(生产厂家:信达生物制药有限公司) 200 mg ivgtt q3w 、特瑞普利单抗注射液(Toripalimab)(生产厂家:苏州众合生物医药科技有限公司)3 mg/kgivgtt q2w、卡瑞利珠单抗注射液(Camrelizumab)(生产厂家:苏州盛迪亚生物医药有限公司)200 mg ivgtt q3w、替雷利珠单抗注射液(Tislelizumab)(生产厂家:勃林格殷格翰生物药业(中国)有限公司)200 mg ivgtt q3w)单药或联合化疗等治疗,治疗期间每6~8周行血液生化、甲状腺功能、心电图、心肌酶学、甲功及影像学等检查评估临床疗效及副反应。
1.4 疗效和不良反应评价及标准 根据实体瘤疗效评价标准(Response evaluation criteria in solid tumors,RECIST)1.1版进行疗效评价为:完全缓解(Complete response,CR)、部分缓解(Partial response,PR)、疾病稳定(Stable disease,SD)和疾病进展(Progressive disease,PD);客观缓解率(Objective response rate,ORR)定义为(CR+PR)/(CR+PR+SD+ PD)×100%;疾病控制率(Disease control rate,DCR) 定义为(CR+PR+SD)/(CR+PR+SD+PD)×100%;总生存期(Overall survival,OS)是指患者从免疫治疗开始至因任何原因引起死亡的时间,无进展生存期 (Progression free survival,PFS) 定义为患者免疫治疗开始至疾病进展或死亡的时间;失访或随访截止仍未发生事件定义为删失。根据中国临床肿瘤学会(CSCO)肺癌诊疗指南(2019)[12],免疫治疗不良反应类型包括皮肤毒性、内分泌毒性、心脏毒性等14种类型,并根据毒性分为5个级别:G1:轻度毒性;G2:中度毒性;G3:重度毒性;G4:危及生命的毒性;G5:与毒性相关的死亡。不良事件的评价采用不良反应术语标准 (Common terminology criteria adverse events,CTCAE) 4.0 3版。
1.5 随访 采用查阅医院住院系统电子病例和电话等方式进行随访,随访截至日期为2021年1月15日,中位随访时间为13.5月。
1.6 统计学分析 采用Excel录入数据,使用SPSS 22.0统计软件,计数资料以率或构成比表示,采用描述性统计分析。使用GrphPad Prism 8.0软件绘制生存曲线。以P<0.05为差异具有统计学意义。
2 结果
2.1 患者基本资料 根据纳入及排除标准,共纳入63例晚期肺癌患者。患者的基线临床特征如性别、年龄、病理类型等(见表1)。

表1 63例晚期肺癌患者的临床特征
2.2 近期疗效评价 63例患者中可行近期疗效评价的55例,其ORR和DCR为32.73%(18/55)、72.73%(41/55)。其中,NSCLC患者的ORR及DCR分别为39.02%(16/41)、75.61%(31/41),单药治疗的ORR及DCR为55.55%(5/9)、88.89%(8/9),联合治疗的ORR及DCR为34.37%(11/32)、71.87%(23/32);SCLC患者的ORR及DCR为14.29%(2/14)、64.29%(9/14),单药治疗的2例患者疗效均SD,联合治疗的ORR及DCR为16.67%(2/12)、58.33%(7/12)。以PD-1/PD-L1抑制剂用于一线治疗的ORR及DCR为34.62%(9/26)、76.92%(20/26),单药治疗的ORR及DCR为33.33%(2/6)、83.33%(5/6),联合化疗的ORR及DCR分别为33.33%(5/15)、73.33%(11/15),联合化疗和抗血管生成治疗的ORR及DCR分别为40.00%(2/5)、80.00%(4/5);用于后线治疗的总ORR及DCR分别为32.14%(9/28)、75.00%(21/28),单药治疗的ORR及DCR为60.00%(3/5)、100.00%(5/5),联合化疗的ORR及DCR为25.00%(3/12)、75.00%(9/12),联合抗血管生成治疗5例的ORR及DCR为25.00%(1/5)、40.00%(2/5),联合化疗和抗血管生成治疗的ORR及DCR 40.00%(2/5)、60.00%(3/5)。
本研究共14例患者行PD-L1检测(一线和后线用药分别检测8例及6例),其中,一线单药治疗1例PD-L1 TPS<1%的患者疗效达SD,后线单药治疗1例PD-L1TPS≥5%的患者疗效达SD。另外, 31例行驱动基因检测的患者中15例存在基因突变(包括4例EGFR(+),2例ALK(+),3例KRAS(+),1例ERBB2(+),2例BRAF(+),2例HER-2(+),1例EGFR(+)合并TP53(+)及KRAS(+),其中5例EGFR(+)患者3例达PR,1例达SD,另外1例暂不可评价,2例ALK(+)患者均无效;4例KRAS(+)患者1例达CR,1例达PR,2例达SD(见表2)。

表2 55例晚期肺癌患者近期疗效评价
2.3 生存分析 随访截止至2021年1月15日,共有15例患者死亡,中位随访时间为13.5月。纳入分析的晚期肺癌患者的中位PFS为8.10月;其中,NSCLC患者中位PFS为8.10月,SCLC患者的中位PFS为5.97月;中位OS数据均未成熟(见图1)。NSCLC患者中PD-1抑制剂单药治疗患者的中位PFS为6.57月,联合治疗患者的中位PFS为9.63月(见图2)。
2.4 不良反应 63例患者总体irAEs发生率为60.32%(38/63),其中发生率>10%的irAEs依次为胃肠毒性、血液毒性、肺毒性、甲状腺功能异常及肝毒性;≥G3级的irAEs发生率为7.94%;年龄>70岁患者irAEs发生率为62.5%(5/8),年龄<70岁患者irAEs发生率为58.18%(32/55);此外, 1例患者因免疫治疗后出现肝功能异常及肺炎死亡(见表3)。PD-1抑制剂联合化疗患者发生≥G3级不良反应率为12.12%(4/33)。免疫治疗联合化疗及抗血管生成治疗发生≥G3级不良反应率为8.33%(1/12)。1例V600E突变的患者免疫治疗联合维莫非尼或达拉菲尼+曲美替尼过程中均未见严重不良事件的发生。本研究大部分发生irAEs的患者经激素和对症处理后缓解,未出现不良反应导致的停药。不同治疗方案具体免疫相关不良反应情况如下(见表4)。
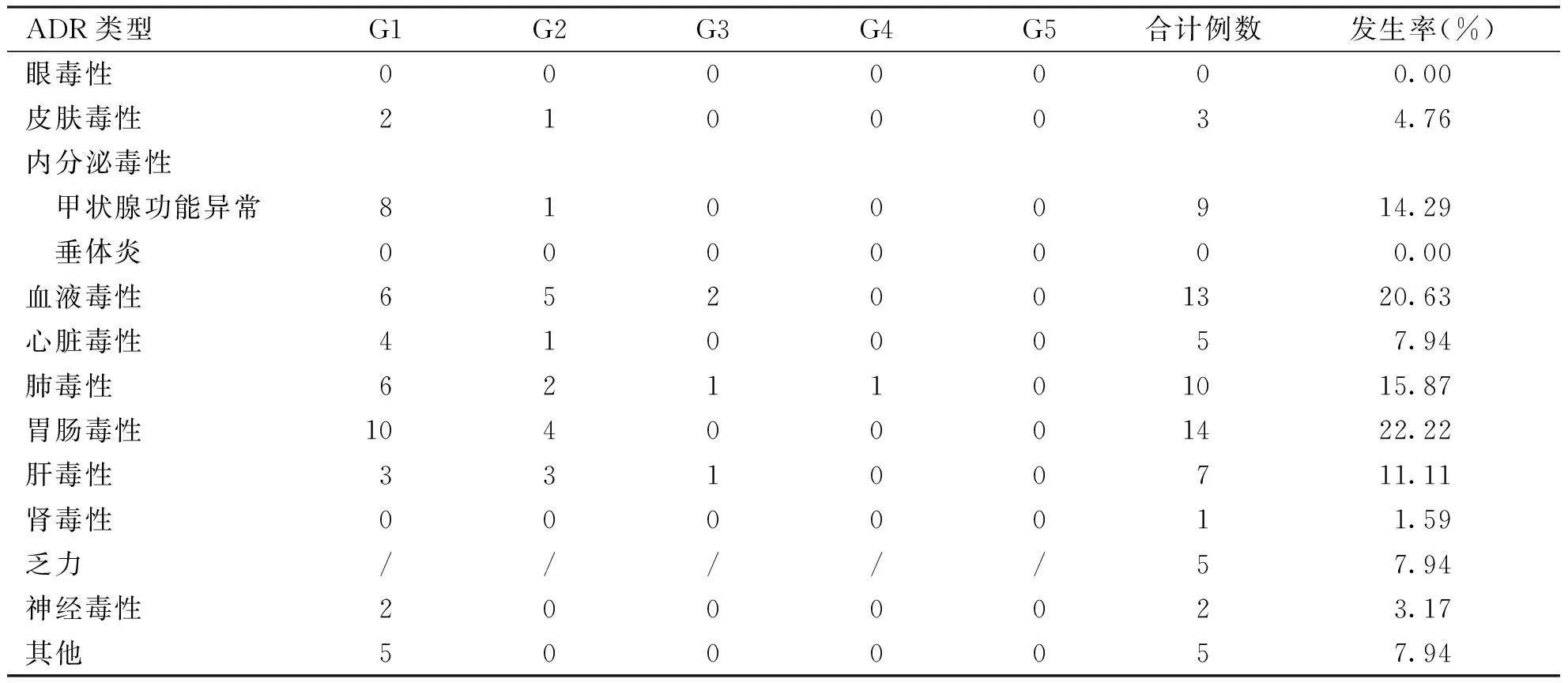
表3 免疫相关不良反应的类型分布和发生率

表4 不同治疗方案发生免疫相关不良反应的类型分布和发生率
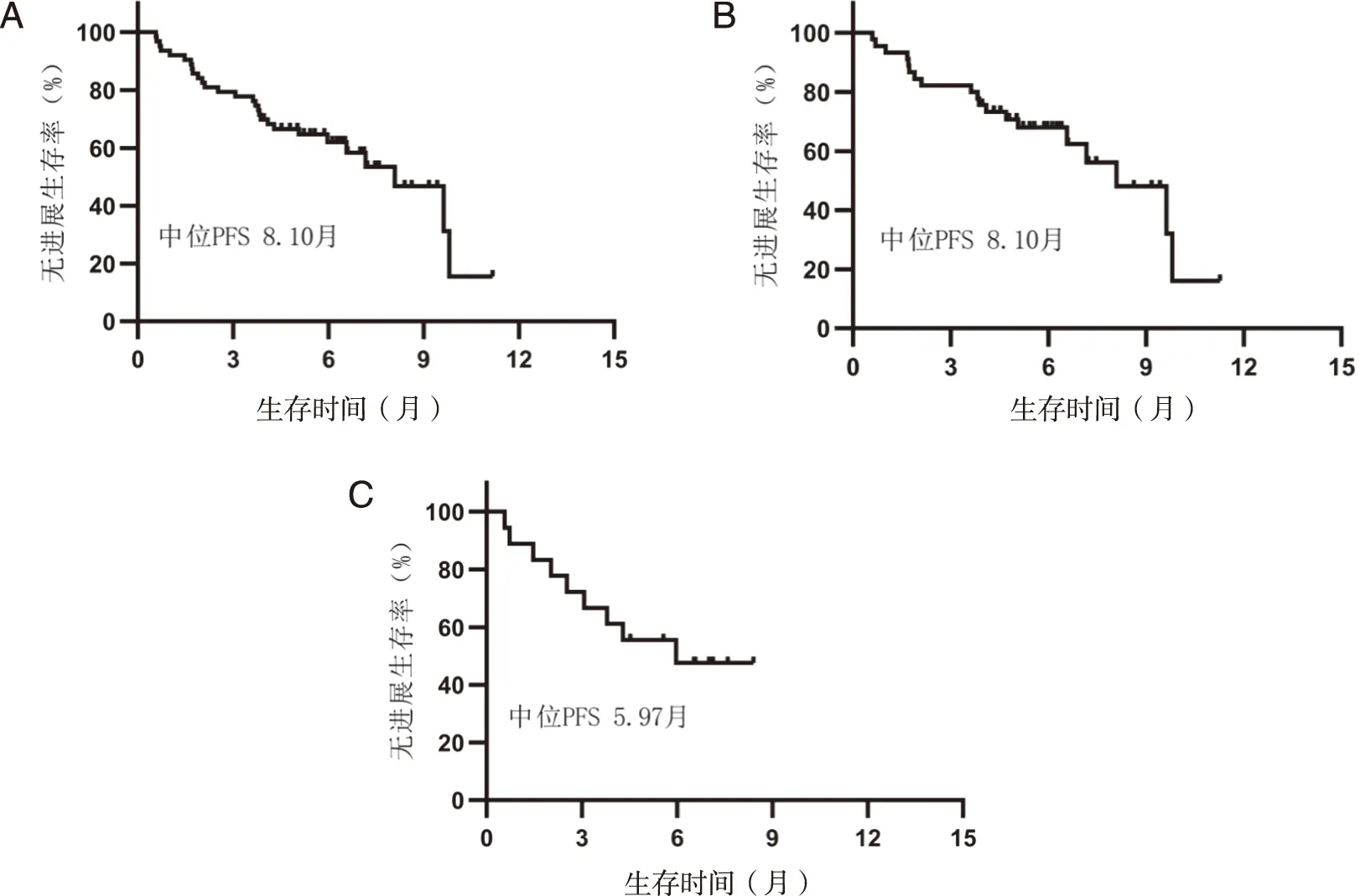
A:63例晚期肺癌患者PFS曲线;B:45例晚期NSCLC患者PFS曲线;C:18例晚期SCLC患者PFS曲线。图1 63例晚期肺癌患者PFS曲线

A:PD-1抑制剂单药治疗PFS曲线;B:PD-1抑制剂联合治疗PFS曲线。图2 NSCLC患者接受PD-1抑制剂单药和联合治疗PFS曲线
3 讨论
当前,以PD-1/PD-L1抑制剂为主导的免疫治疗持续更新着晚期肺癌的治疗策略及理念,与化疗和小分子酪氨酸激酶抑制剂(Tyrosine kinase inhibitor,TKI)不同,化疗和TKI主要是通过作用于肿瘤细胞,发挥“直接”抗肿瘤作用;而PD-1/PD-L1抑制剂通过激活肿瘤免疫细胞,改善免疫微环境,发挥“间接”抗肿瘤效应,因此,其作用效能及毒副反应可能与“传统”治疗截然不同。
对于经治驱动基因阴性的NSCLC患者,早期CheckMate017/057、Keynote-010、OAK等研究[7,13-14]表明:相较“标准”化疗方案,PD-1/PD-L1抑制剂明显提高患者的近期疗效,ORR维持在20% 左右,高于“标准”方案”约10%,且一定程度改善患者的PFS,而对其可能的“疗效”预测标记PD-L1的表达依耐性不强。以上研究结果初步奠定了PD-1/PD-L1抑制剂在晚期NSCLC“后线”治疗中的地位,同时也将有关探讨迅速推向晚期“一线”治疗领域,基于Keynote 024及后续Keynote 042研究[14]表明:无论PD-L 1(TPS)>50%还是>1%的驱动基因阴性NSCLC均能从派姆单抗单药“一线”治疗中获益,优选人群(TPS>50%)ORR甚至接近45%,明显高于经典“含铂”化疗方案约30%的有效率,且部分亚组可取得PFS和(或)OS获益,这为将“派姆单抗”作为PD-L 1(TPS)>1%驱动基因阴性晚期NSCLC“一线”治疗策略提供了依据。本研究驱动基因阴性的NSCLC患者单药治疗的ORR为55.56%,中位PFS为6.57月,提示:国产PD-1抑制剂单药亦可为驱动基因阴性晚期NSCLC患者带来获益。
尽管如此,PD-1/PD-L1抑制剂单药一线用于晚期NSCLC的治疗仍存在诸多问题,譬如:可选择人群范围窄、ORR不高及对PD-L 1(TPS)<1% 的患者疗效不确切等。基于进口药物的Keynote 189/407、IMpower 130等研究[15-17]对于驱动基因阴性而PD-L 1表达状态不经选择的患者采取免疫联合化疗的“强-强”联合方式,结果表明:联合治疗患者的ORR最高可达60%~70%,中位PFS延长约3月;而源于国产药物的RATIONALE 304/307及CameL研究[18-19]结果表明PD-1抑制剂联合化疗治疗驱动基因阴性的NSCLC患者较单纯化疗明显获益,ORR最高达74.8%,中位PFS延长约2月,与进口药物相比毫不逊色。本研究对于驱动基因阴性、PD-L1表达不经选择的NSCLC患者,免疫联合化疗的ORR为37.93%,中位PFS为9.63月,支持前瞻性研究的结论。此外,抗血管生成治疗被认为可促进血管正常化,改善肿瘤免疫微环境,提高免疫治疗和(或)化疗疗效,IMpower 150研究[20]中对于NSCLC患者,阿替利珠单抗+Bev+卡铂+紫杉醇组较Bev+卡铂+紫杉醇组ORR提升约15%,PFS显著延长1.5月。一项卡瑞利珠联合阿帕替尼用于经治晚期非鳞NSCLC的II期研究结果表明,卡瑞利珠联合阿帕替尼在晚期NSCLC患者中表现出良好的抗肿瘤疗效,ORR为30.8%。另外一项信迪利单抗联合安罗替尼一线治疗晚期NSCLC的结果,ORR(72.7%)已达主要终点,DCR为100%[21]。本研究免疫联合抗血管生成治疗和(或)联合化疗治疗的ORR为36.36%。提示:国产PD-1抑制剂联合抗血管生成治疗具有较好的应用前景。
此外,有研究表明PD-1/PD-L1抑制剂单药治疗在EGFR/ALK突变患者中疗效有限,且部分患者易出现“超进展”现象[22],而K-RAS突变与免疫治疗疗效正相关[23]。IMpower 150研究[20]发现接受阿替利珠单抗联合贝伐珠单抗及化疗的EGFR/ALK突变晚期非鳞NSCLC患者的中位PFS优于接受贝伐珠单抗联合化疗的患者(9.7月VS6.1月,P=0.0253)。另外一项关于特瑞普利单抗联合化疗治疗EGFR突变TKI耐药T790M阳性NSCLCII期研究表明:在ITT人群中ORR为50.0%,DCR为87.5%,中位PFS为7.0月。本研究5例EGFR(+)患者3例达PR,其中1例为后线单药治疗,2例ALK(+)无效,4例K-RAS(+)患者ORR达50%,这支持对于驱动基因阳性的NSCLC患者在选择免疫治疗时需区别对待,同时,我们也期待PD-1/PD-L1抑制剂用于驱动基因阳性患者正在进行的Ⅲ期Keynote789、ORIENT-31等相关研究结果,并给出更多的临床参考。
SCLC肿瘤突变负荷高,且具有潜在免疫源性,因此,理论上SCLC患者更可能从免疫治疗中获益。IMpower133研究[24]显示阿替利珠单抗联合化疗用于初治的EC-SCLC患者较标准化疗其ORR无显著差异(60.2% VS 64.4%),中位PFS延长约1月。另一项CASPIAN研究[25]也显示免疫联合化疗较单纯化疗ORR提升约10%。本研究SCLC的ORR为14.29%,中位PFS为5.97月,其中2例后线单药治疗患者疗效均达SD,同样提示SCLC能从免疫治疗中获益。
PD-1/PD-L1抑制剂通过作用于机体免疫系统发挥抗肿瘤效应,其可能导致自身免疫耐受失衡,引起irAEs。irAEs可发生在全身任何器官系统,以皮肤、肺、消化系统、内分泌系统较为常见,眼、神经系统及心血管系统等相对罕见,其中以免疫相关性心肌炎致死率最高[26- 27]。既往研究显示中晚期NSCLC使用PD-1/PD-L1抑制剂后任何级别不良反应的发生率较使用化疗及靶向治疗低[28]。本研究irAEs发生率较高的类型为胃肠毒性、血液毒性及肺毒性等,≥G3级irAEs发生率为7.94%; PD-1抑制剂联合化疗和(或)抗血管生成治疗患者发生≥G3级irAEs率为11.11%,大部分经早期激素等对症处理后缓解。另有研究表明高龄(>70岁)肿瘤患者接受PD-1/PD-L1抑制剂治疗后irAEs发生率与总人群无统计学差异,免疫治疗相关的毒性谱相当[29-30]。本研究年龄>70岁及<70岁患者irAEs发生率分别为62.5%、58.18%。以上结果提示:国产PD-1抑制剂治疗晚期肺癌安全性较好。
综上,国产PD-1抑制剂治疗晚期肺癌疗效可,安全性较好。但由于本研究为单中心研究,且组织学分类多样,治疗方案不统一及样本量小,因此需纳入更多患者来进一步验证我们的结论。
