HPV阳性头颈鳞癌中SMG-1和DNMT1的表达及临床意义
2021-09-03郭丹丹张阳春张春林
龙 丹,王 凯,郭丹丹,杨 梅,徐 丽,张阳春,张春林
(1.遵义医科大学附属医院 耳鼻咽喉头颈外科,贵州 遵义 563099;2.遵义医科大学附属医院 病理科,贵州 遵义 563099)
全球范围内,头颈鳞癌发病率在恶性肿瘤中居第6位[1],吸烟饮酒是已被证实的致癌因素之一。近年研究证实感染高危型人乳头瘤病毒(Human papillomavirus,HPV)与头颈鳞癌的发生密切相关,且头颈鳞癌中HPV的感染率有逐年上升的趋势[2-3]。因此,开展HPV阳性头颈鳞癌的基础研究,对于头颈鳞癌的防治十分必要。HPV阳性头颈鳞癌是一个独特的肿瘤亚组,与HPV阴性头颈鳞癌相比,具有明显的临床特征,如对放化疗反应敏感,预后较好等[4]。HPV阳性头颈鳞癌的生物学特性与HPV病毒直接或间接相关,众多的癌基因及抑癌基因可能参与其中[5],但是具体的调控机制并不明确。
生殖器形成抑制基因-1(Suppressor of morphogenesis in genitalia-1,SMG-1)是新近发现的一个重要的抑癌基因,属于PIKKs家族,主要调控p53在G1期信号传导通路,阻滞细胞周期,在DNA损伤修复中发挥作用,其异常表达与肿瘤的发生密切相关[6]。有研究证实在喉鳞癌组织内SMG-1的表达与肿瘤的发生密切相关,SMG-1是预测喉癌预后的重要生物学指标。抑癌基因启动子的异常甲基化可引起目的基因转录失活,参与调控肿瘤的发生发展[7]。DNA甲基转移酶1(DNA methyltransferase1,DNMT1)可催化肿瘤的启动子甲基化反应,DNMT1已发现在多种恶性肿瘤中均有异常表达[8],但在HPV阳性头颈鳞癌中的意义仍未明确。不同于HPV阴性头颈鳞癌,HPV阳性头颈鳞癌中抑癌基因的甲基化水平高于HPV阴性头颈鳞癌[9-11],HPV感染可能与肿瘤的甲基化相关。我们的前期研究也发现,HPV病毒可通过影响甲基化水平调节HPV阳性头颈鳞癌的生物学特性[12]。本研究通过对比HPV阳性头颈鳞癌及HPV阴性头颈鳞癌中SMG-1和DNMT1的表达差异,探讨HPV阳性头颈鳞癌中SMG-1和DNMT1的表达及临床意义,筛选头颈鳞癌预后的标记物,并为进一步的机制研究提供依据。
1 资料与方法
1.1 标本来源收集 2014年6月至2017年12月就诊于我院的头颈鳞癌患者的石蜡组织标本105例。所有石蜡标本均经10%的中性福尔马林液固定,后由专业病理医师以2014年WHO诊断标准进行HE染色切片诊断[13]。纳入标准:原发灶病理确诊为头颈鳞癌;有完整的临床资料及标本;标本质量达到HPV-DNA的PCR检测和免疫组化的检测要求。排除标准:原发灶非头颈部肿瘤;合并其他肿瘤;临床资料缺失。
1.2 研究方法
1.2.1 HPV阳性头颈鳞癌的检测 首先提取石蜡组织标本切片5~10片,厚5 μm,面积100~250 mm2,将处理好的样品装于1.5 mL无菌离心管中,使用TaKaRa MiniBEST FFPE DNA Extraction Kit试剂盒提取样本DNA,使用微量核酸测定仪进行DNA浓度测定和DNA质量评估,使用AmpliTaq GoldTMDNA Polymerase Kit试剂盒,PCR扩增管家基因β-globin进行DNA质控检验,检验合格者则进行HPV-DNA的检测,使用GP5+/GP6+引物巢式PCR扩增HPV-DNA(见表1),再取10 μL PCR产物进行琼脂糖凝胶电泳,在紫外灯下对条带拍照分析结果。所有石蜡组织标本进行免疫组化法p16蛋白检测。HPV-DNA和p16均阳性的头颈鳞癌标本确定为HPV阳性头颈鳞癌[14]。
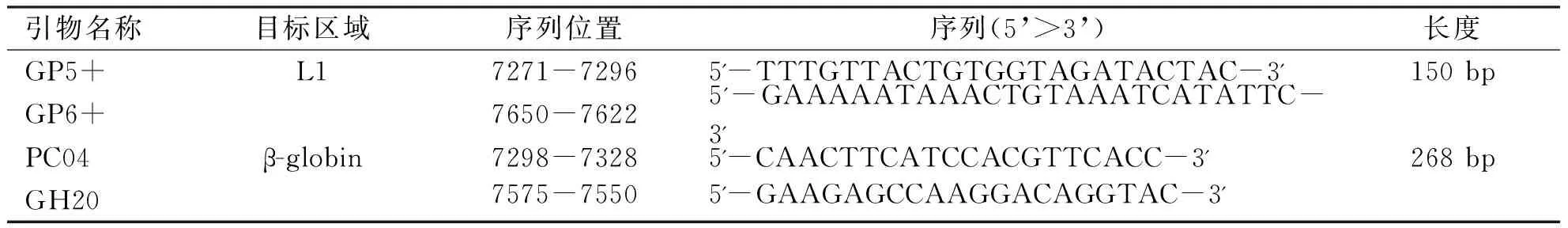
表1 PCR扩增β-globin 和 HPV-DNA所用的引物
1.2.2 SMG-1,DNMT1蛋白检测 按照免疫组化Envision法将石蜡组织标本烤片30 min,二甲苯10 min(2次),按照酒精浓度梯度(100%,95%,80%,70%)进行脱蜡水化,3%双氧水室温封闭8 min,纯水冲洗干净,采用0.01 mol/L柠檬酸高温高压法抗原修复2~3 min,冷却至室温,一抗(兔抗-p16,1∶400稀释,Proteintech公司;兔抗-SMG-1,1∶1 000稀释,Abcam公司;兔抗-DNMT1,1∶2 000稀释,Abcam公司)4 ℃过夜孵育14~18 h,二抗(通用型羊抗兔鼠,福州迈新生物公司)室温孵育15 min,DAB显色,苏木素复染,脱水,干燥,封片,显微镜下观察。
1.2.3 SMG-1,DNMT1蛋白表达结果判定 显微镜400倍光镜下随机选取5个视野,每个视野至少含100个肿瘤细胞,计算阳性率:即5个视野中阳性肿瘤细胞数的均值。SMG-1蛋白表达主要在细胞核及细胞质,DNMT1蛋白表达主要在细胞核,以细胞核/细胞质染成黄棕色或黄褐色为阳性细胞。DNMT1[15]和SMG-1[16]的表达均以半定量法将蛋白表达分为4个水平。DNMT1:阴性(-),无染色或染色细胞低于5%,计0分;弱阳性(+),染色细胞为6%~25%,计1分;中强阳性(++),染色细胞为26%~75%,计2分;强阳性(+++),染色细胞大于75%,计3分。SMG-1:阴性(-),细胞核/细胞质无染色,计0分;弱阳性(+),细胞核/细胞质淡黄色,染色细胞小于50%,计1分;中强性(++),细胞核/细胞质呈黄色/棕黄色,染色细胞小于40%,计2分;强阳性(+++),细胞核/细胞质呈褐色/棕褐色,染色细胞大于40%,计3分。
1.3 统计学分析 本实验采用SPSS 23.0软件进行数据分析,两组间二分类资料比较使用χ2检验,有序多分类资料比较使用R×C列联表χ2检验,对T<5超过1/5的分类资料比较使用Fisher精确概率法。两组有序多分类资料的相关性分析使用Spearman秩相关系数。使用Kaplan-Meier法进行生存分析,取α= 0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 头颈鳞癌中HPV的感染率 在头颈鳞癌中HPV的总感染率为21.9%(23/105),下咽癌中HPV的感染率为27.3%(3/11),喉癌中HPV的感染率为21.0%(17/81),口咽癌中HPV的感染率为33.3%(2/6)(见表2)。

表2 HPV在头颈鳞癌中的感染情况
2.2 头颈鳞癌中SMG-1和DNMT1的表达 与HPV感染的相关性头颈鳞癌中SMG-1和DNMT1中的总阳性率为(40.00%,67.62%), HPV阳性头颈鳞癌中SMG-1阳性率(21.74%)低于HPV阴性组(45.12%),DNMT1阳性率(86.96%)高于HPV阴性组(62.20%),差异均具有统计学意义(P<0.05,见图1,表3)。
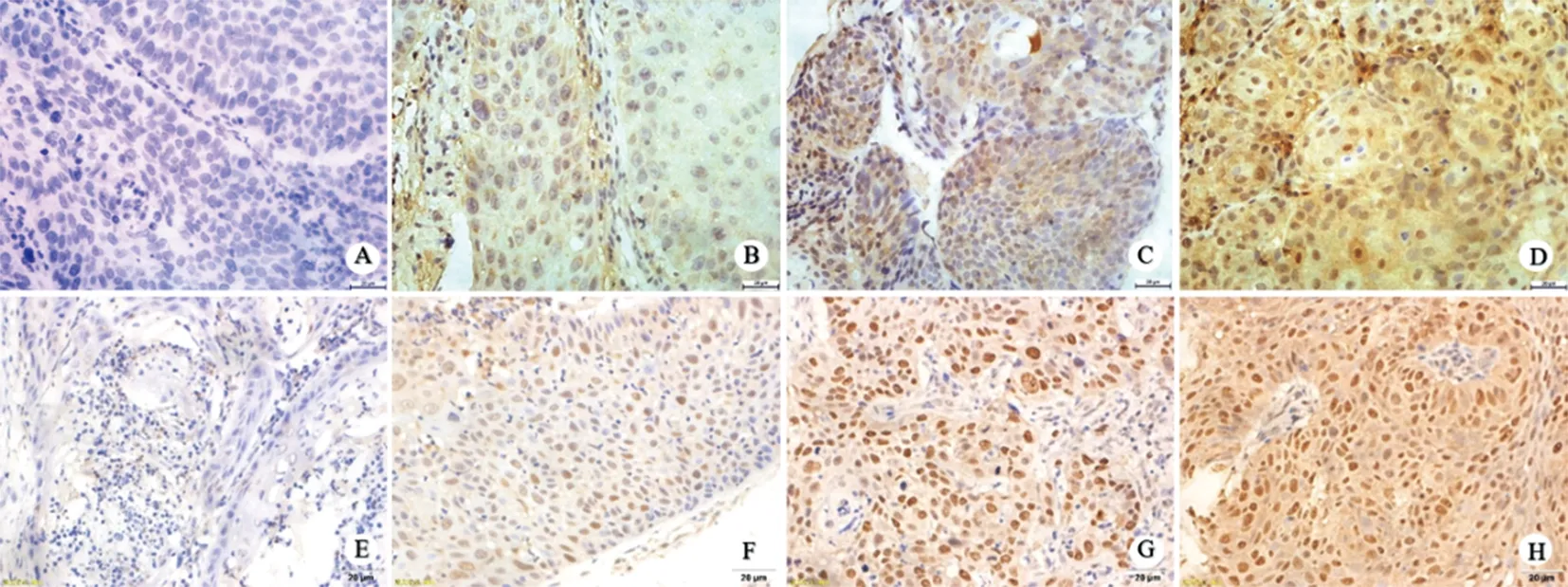
A: SMG-1,阴性;B: SMG-1,弱阳性; C: SMG-1,中强阳性;D:SMG-1,强阳性;E:DNMT1,阴性;F: DNMT1,弱阳性;G: DNMT1,中强阳性;H: DNMT1,强阳性。图1 SMG-1,DNMT1在头颈鳞癌中的表达(×400)

表3 SMG-1和DNMT1在头颈鳞癌中的表达
2.3 SMG-1、DNMT1与头颈鳞癌临床特征的关系 所有纳入的头颈鳞癌患者均无远处转移,经R×2列联表χ2检验,SMG-1和DNMT1在N分期和肿瘤分期的差异性表达均有统计学意义(P<0.05),在性别,年龄,T分期和治疗方式上表达差异均无统计学意义(P>0.05,见表4)。SMG-1与DNMT1表达呈负相关(rs=-0.486,P<0.001,见表5)。
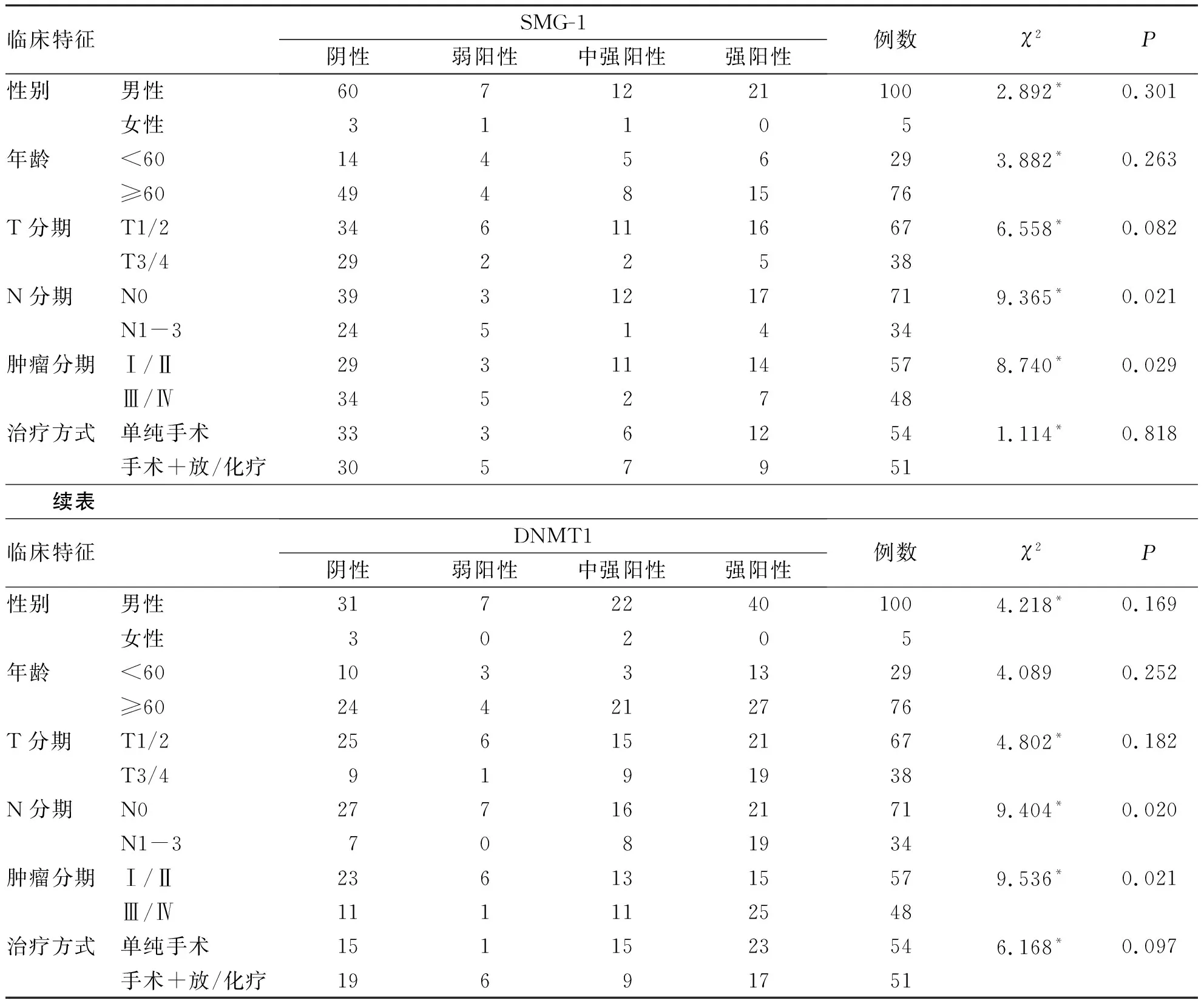
表4 纳入的头颈鳞癌患者临床特征与SMG-1、DNMT1表达情况
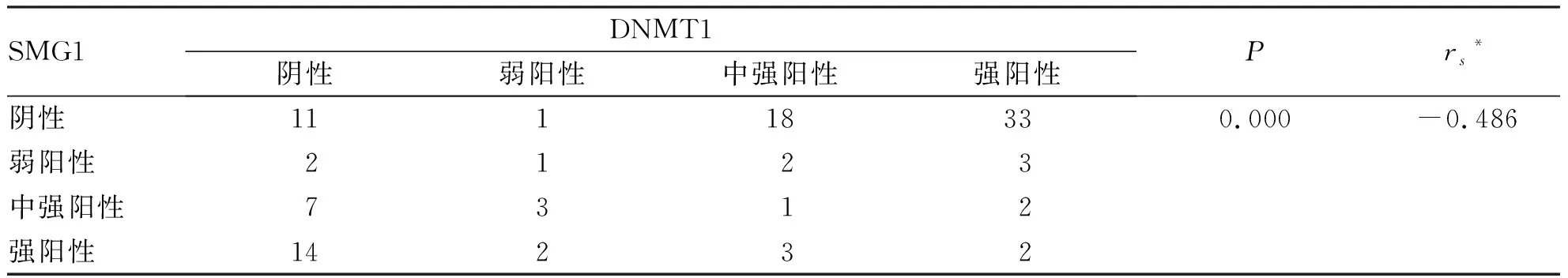
表5 SMG-1与DNMT1表达的相关性
2.4 头颈鳞癌中HPV感染、SMG-1和DNMT1表达水平与患者预后的关系 Kaplan-Meier法进行生存分析的结果显示,HPV阳性头颈鳞癌的5年生存率(87.0%)明显优于HPV阴性组的5年生存率(54.9%),差异有统计学意义(P=0.028)。头颈鳞癌中SMG-1阴性组5年生存率(77.8%)明显优于SMG-1阳性组的5年生存率(38.1%),差异有统计学意义(P=0.002),且SMG-1阴/弱阳性组的5年生存率(73.2%)优于SMG-1中强阳/强阳性组的5年生存率(38.2%),差异有统计学意义(P=0.013)。头颈鳞癌中DNMT1阳性组5年生存率(71.8%)优于阴性组5年生存率(41.2%),差异有统计学意义(P=0.030),且DNMT1强阳性组5年生存率(82.5%)明显优于阴/弱阳/中强阳性组5年生存率(49.2%),差异有统计学意义(P=0.007,见图2)。

图2 头颈鳞癌中HPV感染、SMG-1和DNMT1表达与生存率关系
3 讨论
头颈鳞癌是常见的恶性肿瘤之一,占所有癌症的3%~5%[1],感染高危型HPV是其主要危险因素之一[2]。HPV病毒通过感染人类黏膜上皮细胞,其癌蛋白E6和E7可分别导致p53和视网膜母细胞瘤(Rb)肿瘤抑制蛋白失活,从而激发HPV相关肿瘤的发生发展[17]。近年来,头颈鳞癌中HPV感染率有升高的趋势,进行头颈鳞癌中HPV感染的检测也越来越被重视。目前,头颈鳞癌中HPV的检测方法尚未统一,不同的研究目的采用不同检测方法,其中包括定量逆转录PCR,免疫组化,原位杂交,免疫印迹等,可分别用于检测HPV的DNA,RNA及相关蛋白,联合多种检测方法可提高检测效率。不同于宫颈癌,HPV相关头颈鳞癌中HPV DNA病毒载量及mRNA转录表达量均较低,往往需要辅以组织标本才能完成HPV检测。本研究使用PCR检测HPV-DNA联合p16免疫组化法检测头颈鳞癌患者的HPV感染情况,与HPV金标准E6/E7 mRNA的分析结果有一致性[14],在头颈鳞癌中测得HPV的总感染率为21.9%(23/105),在口咽癌中HPV的感染率为33.3%(2/6),在下咽癌中HPV的感染率为27.3%(3/11),在喉癌中HPV的感染率为21.0%(17/81),与Ni[14]和Gama[18]研究结果类似,其中口咽癌中HPV的感染率略低于我们前期研究[3]的结果,可能原因为本研究组使用PCR检测HPV-DNA联合免疫组化检测p16的方法,剔除了单纯检测HPV-DNA阳性而p16阴性的假阳性标本及HPV一过性感染的样本,增加了检查特异性。HPV阳性头颈鳞癌相较于HPV阴性头颈鳞癌具有对放化疗反应敏感,预后较好等的独特的临床特征[4]。我们的前期研究发现[19],HPV阳性头颈细胞株(UPCI-SCC-090,UM-SCC-47)相较于HPV阴性头颈细胞株(FaDu,UM-SCC-4)对放化疗更敏感。本研究组HPV的生存分析显示HPV阳性头颈鳞癌的5年生存率(87.0%)明显优于HPV阴性组(54.9%)。因此,对HPV阳性头颈鳞癌的生物学机制研究是十分必要的。介于HPV的存在是头颈鳞癌患者最重要的预后因素之一,众多的癌基因及抑癌基因可能参与其中[5],本研究组对SMG-1和DNMT1在HPV阳性头颈鳞癌中的表达进行研究。
SMG-1是人体中重要的抑癌基因之一,属于PIKKs家族的成员,参与生物学中多种机制调控,包括参与缺氧反应,参与肿瘤坏死因子-α诱导的细胞凋亡,修复DNA损伤反应等,其异常表达与多种恶性肿瘤的发生密切相关[6,16]。Zhang等[20]报道在胃癌中miR-192和miR-215可下调SMG-1的表达而提高癌细胞的增殖和侵袭特性。周学军等[21]报道在喉鳞癌中SMG-1发挥抑癌基因作用且SMG-1表达缺失的喉鳞癌患者预后良好。HPV阳性头颈鳞癌中SMG-1的报道较少,HPV病毒的癌蛋白E6可导致p53突变,造成DNA损伤及基因组不稳定[17],而p53受到其上游基因SMG-1的调控,提示SMG-1可能参与HPV相关头颈鳞癌的发生发展。本研究中HPV阳性头颈鳞癌SMG-1阳性率(21.74%)低于HPV阴性组(45.12%),提示在HPV阳性头颈鳞癌中SMG-1表达下调。本研究纳入的头颈鳞癌患者中SMG-1表达随着肿瘤N分期及肿瘤分期的等级提高呈下降趋势,与周学军[21]和Gubanova等[16]中头颈鳞癌的研究结果相似,提示在HPV阳性头颈鳞癌中SMG-1表达可能与淋巴结浸润及肿瘤分期相关。SMG-1的生存分析显示,头颈鳞癌中SMG-1阴性组5年生存率(77.8%)明显优于SMG-1阳性组(38.1%),差异有统计学意义(P=0.002),与Gubanova[16]和Zhang等[19]的头颈鳞癌结果相似,提示HPV阳性头颈鳞癌中SMG-1高表达者预后不良,SMG-1可能成为头颈鳞癌患者预后的标记物之一。
DNMT1是一种将甲基转移至基因组DNA胞嘧啶核苷酸的酶,DNA的甲基化在表观遗传基因调控中起重要作用,异常的甲基化与多种恶性肿瘤的发生发展有关[8]。有研究证实HPV阳性头颈鳞癌中抑癌基因的甲基化水平高于HPV阴性头颈鳞癌[9-11],HPV感染可能与肿瘤的甲基化相关。本研究中HPV阳性头颈鳞癌DNMT1阳性率(86.96%)高于HPV阴性组(62.20%),差异有统计学意义(P<0.05),提示在HPV阳性头颈鳞癌中DNMT1表达上调。相关研究报道在HPV阳性头颈鳞癌中存在RXRG[9],EREG[10],p16[11]等多种抑癌基因的异常甲基化及其沉默,与DNMTs密切相关。本研究组中SMG-1和DNMT1表达呈负相关,提示SMG-1和DNMT1可能参与HPV阳性头颈鳞癌中抑癌基因的异常甲基化,调控肿瘤的发生发展。头颈鳞癌中DNMT1表达随着N分期及肿瘤分期等级提高呈上升趋势,提示HPV阳性头颈鳞癌中DNMT1表达可能与淋巴结浸润及肿瘤分期相关。DNMT1的生存分析显示,头颈鳞癌中DNMT1阳性组5年生存率(71.8%)明显优于DNMT1阴性组(41.2%),与Xue等[22]的头颈鳞癌结果相似,提示HPV阳性头颈鳞癌中DNMT1低表达者预后不良,DNMT1可能成为头颈鳞癌患者预后的标记物之一。
在HPV阳性头颈鳞癌中,SMG-1与DNMT1表达呈负相关,SMG-1和DNMT1均与头颈鳞癌的预后相关,SMG-1高表达者预后不良,DNMT1低表达者预后不良,我们前期研究显示[19]HPV阳性头颈细胞株对放化疗敏感性强于HPV阴性细胞株。因此,本研究为进一步的研究提供参考,在HPV阳性头颈鳞癌中,DNMT1可能通过调控SMG-1的表达,提高肿瘤对放化疗敏感性,从而影响其预后,为后续研究探讨DNMT1和SMG-1在HPV阳性头颈鳞癌中的作用机制提供依据。
