木脂素-1通过抑制DNA拓扑异构酶I诱导胃癌细胞凋亡的机制研究
2021-09-03娄红刚张琛涵康富贵聂静云柴琛
娄红刚 张琛涵 康富贵 聂静云 柴琛
据统计,我国新发胃癌病例占全球范围内所有胃癌的44.10%左右[1]。DNA 拓扑异构酶I(Topoisomerase I,TopoI)在胃癌肿瘤细胞DNA 复制、转录中具有关键作用,抑制其活性是选择性抑制肿瘤细胞增殖、诱导细胞凋亡的重要靶点[2]。目前,羟基喜树碱(Hydroxycamptothecin,HCPT)是唯一上市的以TopoI 为靶点的抗肿瘤药物,在多种肿瘤治疗中取得一定疗效,但临床实践发现此类化合物存在药物代谢效力低下、稳定性差异等局限性[3]。故亟需开发以TopoI 为靶点的非喜树碱类药物。木脂素属于天然化合物,结构类型丰富,具有包含抗炎、抗病毒、抗肿瘤在内的广泛生物活性[4]。本研究通过体外实验探讨Mzs-1 诱导SGC-7901 细胞凋亡、靶向抑制TopoI 的机制,为临床开发、应用Mzs-1 作为治疗胃癌候选药物提供实验依据。报告如下。
1 材料与方法
1.1 主要实验材料
Mzs-1 有青岛科技大学夏亚穆教授合成提供,人胃癌细胞株SGC-7901 购于上海生命科学研究院,由兰州大学第一临床医学院中心实验室冻存,DEME 培养基(高糖)购于Gibco 公司,PBS 购于Hyclone 公司,胎牛血清(FBS)购于浙江天杭生物科技股份有限公司,0.25%胰蛋白酶(含0.02%EDTA)购于北京索莱宝科技有限公司,双抗(青/链霉素100×)、50×TAE 缓冲液、Meilunred 核酸电泳染料、羟基喜树碱(HCPT)购于大连美仑生物技术有限公司,DMSO 购于Sigma 公司,CCK-8 购于上海翊圣生物科技有限公司,PBR322 质粒、DNA Topo I、DNA marker、6× Loading buffer 购于TaKaRa 公司,琼脂糖购于HydraGene 公司,Annexin V-FITC/PI 凋亡试剂盒、BCA 蛋白定量试剂盒、PMSF 蛋白酶抑制剂购于上海碧云天生物技术有限公司,SDSPAGE 凝胶制备试剂盒、5×电泳缓冲液、10×转膜缓冲液、10× TBST、RIPA 裂解液、5×蛋白上样缓冲液购于北京索莱宝科技有限公司,甲醇购于天津市光复科技发展有限公司,脱脂奶粉购于Biofroxx 公司,蛋白标记物(marker)购于Thermo Scientific 公司,兔抗人Topo I 单克隆抗体购于Proteintech 公司,兔抗人β-actin 单克隆抗体购于爱必信生物科技有限公司,辣根过氧化物酶标记羊抗兔IgG 购于北京中杉金桥生物技术有限公司,ECL 化学发光液、聚偏二氟乙烯膜(PVDF 膜)购于Biosharp 公司。
1.2 方法
Mzs-1 使用二甲基亚砜(Dimethyl sulfoxide,DMSO)溶解,经滤膜孔径0.45 μm,滤器抽滤除菌后,置于4℃冰箱中保存,各组DMSO 浓度均低于0.1%。将人胃癌细胞株SGC-7901 分装于含有2 mL 原始培养基的25 cm2细胞培养瓶中,再加入完全培养基2 mL,放置在37℃、二氧化碳饱和湿度35%的细胞培养箱中进行培养,当细胞长满培养瓶底面积80%~90%后,依次进行细胞传代、细胞冻存、细胞复苏及细胞计数处理。采用CCK-8 法检测Mzs-1 对人胃癌细胞株SGC-7901 增殖抑制的影响,以酶标仪检测450 nm 处吸光度(OD)值,OD值重复测量3 次,取平均值。细胞存活率(%)=(加药组OD 值-空白组OD 值)/(阴性对照组OD 值-空白组OD 值)×100%,采用GraphPad Prism5 计算药物半数抑制浓度(IC50)。采用流式细胞术检测Mzs-1 对SGC-7901 细胞凋亡及细胞周期的影响,采用琼脂糖凝胶电泳Mzs-1 对TopoI 活性的影响,采用蛋白印迹法检测TopoI 蛋白表达量。
1.3 统计学方法
采用统计软件SPSS 22.0 进行统计学分析,计量资料以()描述,多组间比较采用单因素方差分析,进一步两两组间比较采用LSD-t 检验,两组间比较采用独立样本t检验;实验数据使用GraphPad Prism5 软件进行作图及计算药物IC50,以P<0.05 认为差异有统计学意义。
2 结果
2.1 Mzs-1 对SGC-7901 细胞的增殖抑制作用
Mzs-1 能明显抑制SGC-7901 细胞增殖,且存在时间-浓度依赖性(P<0.05)。见图1。

图1 Mzs-1 对SGC-7901 细胞的增殖抑制作用Figure 1 The inhibitory effect of Mzs-1 on the proliferation of SGC-7901 cells
2.2 Mzs-1 对SGC-7901 细胞的诱导凋亡作用
不同浓度Mzs-1 处理SGC-7901 细胞48 h 后,各组早期凋亡细胞比率差异有统计学意义(P<0.05);与空白对照组相比,不同浓度Mzs-1 处理SGC-7901 细胞48 h 后,随着Mzs-1 浓度增加,早期凋亡细胞比率不断升高,且呈现浓度依赖性(P<0.05)。与HCPT 阳性对照组比较,Mzs-1 浓度为80 μg/mL 时早期凋亡率略高(P>0.05)。见表1。
表1 Mzs-1 对SGC-7901 细胞早期凋亡率的影响(±s)Table 1 The effect of Mzs-1 on the early apoptosis rate of SGC-7901 cells(±s)
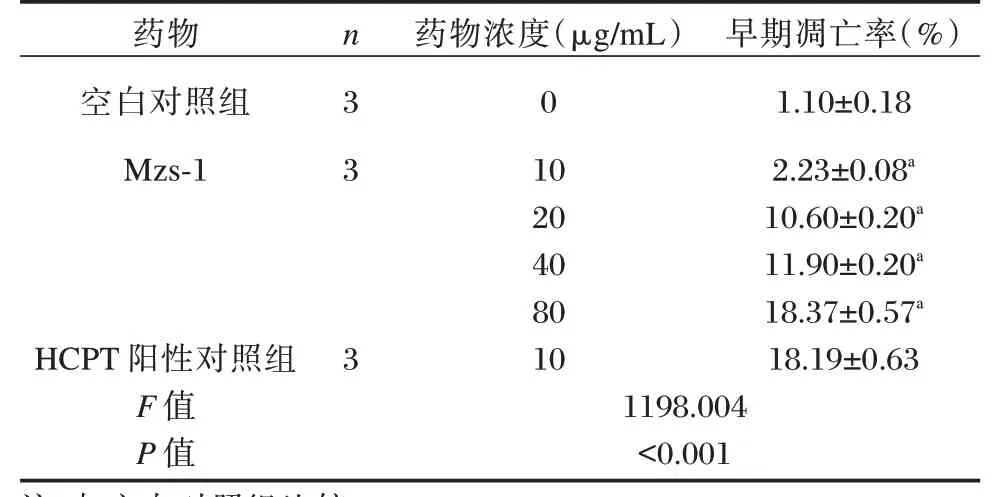
表1 Mzs-1 对SGC-7901 细胞早期凋亡率的影响(±s)Table 1 The effect of Mzs-1 on the early apoptosis rate of SGC-7901 cells(±s)
注:与空白对照组比较,aP<0.05。
药物空白对照组Mzs-1 HCPT 阳性对照组F 值P 值n 3 3 3药物浓度(μg/mL)0 10 20 40 80 10 1198.004<0.001早期凋亡率(%)1.10±0.18 2.23±0.08a 10.60±0.20a 11.90±0.20a 18.37±0.57a 18.19±0.63
2.3 Mzs-1 对SGC-7901 细胞周期的影响
不同浓度Mzs-1 作用于SGC-7901 细胞48 h后,各组处于G2/M 期细胞比例差异有统计学意义(P<0.05);与空白对照组相比,相同时间内,随着Mzs-1 药物浓度增加,处于G2/M 期细胞比例明显增加(P<0.05);与HCPT 阳性对照组相比,Mzs-1浓度为80 μg/mL 时G2/M 期细胞比例略高(P>0.05)。见图2、表2。

图2 Mzs-1 对SGC-7901 细胞周期变化的影响Figure 2 The effect of Mzs-1 on SGC-7901 cell cycle changes
表2 Mzs-1 对SGC-7901G2/M 期细胞比例的影响(±s)Table 2 The effect of mzs-1 on the proportion of SGC-7901 cells in G2/M phase(±s)
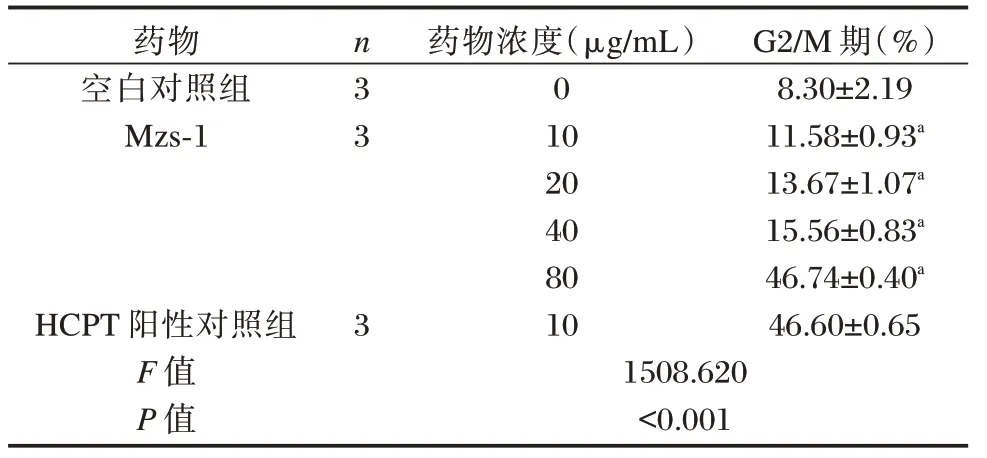
表2 Mzs-1 对SGC-7901G2/M 期细胞比例的影响(±s)Table 2 The effect of mzs-1 on the proportion of SGC-7901 cells in G2/M phase(±s)
注:与对照组比较,aP<0.05。
药物空白对照组Mzs-1 HCPT 阳性对照组F 值P 值n 3 3 3药物浓度(μg/mL)0 10 20 40 80 10 1508.620<0.001 G2/M 期(%)8.30±2.19 11.58±0.93a 13.67±1.07a 15.56±0.83a 46.74±0.40a 46.60±0.65
2.4 Mzs-1 对DNA TopoI 活性的影响
与只加入pBR322 DNA 泳道相比,加入TopoI的超螺旋pBR322 DNA 被解旋为松弛型DNA;HCPT 阳性对照组在浓度为10 μg/mL 时完全抑制TopoI 对pBR322 DNA 的解旋作用;加入Mzs-1 的泳道随着药物浓度增加,超螺旋DNA(SC)增多,Mzs-1 浓度为40 μg/mL 时,完全抑制TopoI 活性,与HCPT 对照组趋势一致。见图3。

图3 Mzs-1 对DNA TopoI 活性的影响Figure 3 The effect of Mzs-1 on DNA TopoI activity
2.5 Mzs-1对SGC-7901细胞TopoI蛋白表达的影响
Mzs-1 处 理SGC-7901 细胞48 h 后,各组TopoI 蛋白相对表达量差异有统计学意义(P<0.05);与空白对照组相比,随Mzs-1 药物浓度增加,TopoI 蛋白表达量逐渐下降(P<0.05),且Mzs-1浓度为80 μg/mL 时抑制率略低于HCPT 阳性对照组。见表3。
表3 Mzs-1 对SGC-7901 细胞中TopoI 蛋白相对表达量的影响(±s,n=3)Table 3 The effect of Mzs-1 on the relative expression of TopoI protein in SGC-7901 cells(±s,n=3)
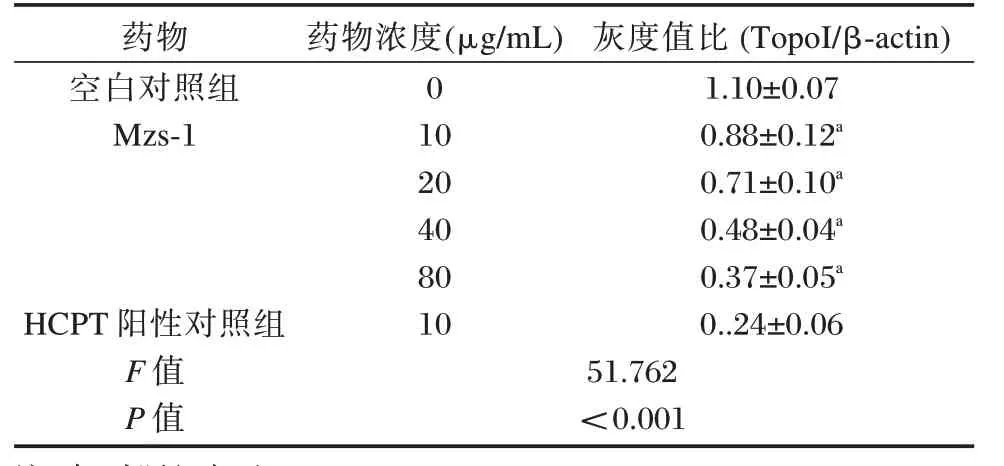
表3 Mzs-1 对SGC-7901 细胞中TopoI 蛋白相对表达量的影响(±s,n=3)Table 3 The effect of Mzs-1 on the relative expression of TopoI protein in SGC-7901 cells(±s,n=3)
注:与对照组相比,aP<0.05。
药物空白对照组Mzs-1 HCPT 阳性对照组F 值P 值药物浓度(μg/mL)0 10 20 40 80 10 51.762<0.001灰度值比(TopoI/β-actin)1.10±0.07 0.88±0.12a 0.71±0.10a 0.48±0.04a 0.37±0.05a 0..24±0.06
3 讨论
胃癌是国内最常见消化道恶性肿瘤之一,发病率、死亡率仅次于肺癌,总体预后仍处于较低水平[5]。胃癌早期无明显症状,多数患者就诊时已处于进展期甚至晚期,丧失手术根治时机,放化疗成为主要治疗手段,可杀伤肿瘤细胞、抑制肿瘤细胞扩散,延长生存时间,但毒副反应较多,严重降低患者生存质量[6]。
中医药疗法在减轻临床症状、抑制转移、减少复发等抗肿瘤治疗中卓有成就。牛蒡属于菊科牛蒡属植物,其果实可入药,称为牛蒡子,木脂素类化合物是其主要活性成分,具有调节免疫、保肝、抗病毒、抗炎等作用[7]。同时,大量国内外报道证实,木脂素具有良好抗肿瘤作用,此类化合物可经由众多途径抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡[8-9]。而细胞增殖与凋亡失衡是胃癌的基本病理机制[10]。Mzs-1 是以牛蒡子活性成分衍生物为基础合成的一种新型木脂素类化合物,属于木脂素类的合成前体。本研究结果提示Mzs-1 可能通过阻滞SGC-7901 细胞,使其停滞于G2/M 期,从而诱导细胞凋亡,最终抑制人胃癌细胞株SGC-7901 增殖。因此,探究Mzs-1 在胃癌中的抗肿瘤作用机制、开发高效的药用Mzs-1 具有重要意义。
Topo 可直接影响或参与细胞DNA 复制、转录等过程,其中TopoI 对单链DNA 作用,每次仅作用于一条链,能够催化DNA 链断裂和重新连接,无需能量辅助因子,可直接发挥相关作用[11]。TopoI 具有增殖依赖性,在非循环增殖细胞与循环增殖细胞中无差异,研究显示,TopoI 虽无肿瘤特殊性,但与正常组织相比,在肿瘤细胞中的表达量显著升高[12]。故抑制TopoI 活性成为临床公认抗肿瘤药物的作用靶点。目前,HCPT 是临床应用较为广泛的化疗药物,其主要作用机制便是经由抑制TopoI 活性诱导肿瘤细胞凋亡,已投入到胃癌的治疗中。但临床证实,HCPT 因其自身耐药性、稳定性、患者个体差异性等因素导致疗效受限[13]。本研究采用琼脂糖凝胶电泳法测定Mzs-1 对TopoI 活性的影响,发现随着Mzs-1 浓度增加,TopoI 活性逐渐下降直至失活。由此可知,Mzs-1 能够抑制TopoI 活性,其作用机制可能在于以下两个方面:一方面Mzs-1 可能通过直接抑制TopoI 催化活性导致其失活,另一方面Mzs-1 可能是经由干扰TopoI 与DNA 结合,促使TopoI、DNA、药物形成三元复合物,从而阻滞DNA 复制,诱导肿瘤细胞死亡。
为进一步探究Mzs-1 抗肿瘤活性及相关机制,本研究结果发现TopoI 蛋白表达量随Mzs-1 浓度增加呈不断降低趋势。说明Mzs-1 能靶向抑制TopoI 蛋白表达。此外,体内、体外实验均表明,TopoI 抑制剂的抗肿瘤作用主要与诱导肿瘤细胞凋亡有关,多数涉及线粒体依赖途径,即经由Caspase 家族介导的凋亡途径发挥相关药物作用,作用机制与激活、上调Caspase-3 相关[14-15]。有文献指出,采用Mzs-1 处理SGC-7901 细胞株后,Caspase-3 表达呈上调趋势[16]。提示Mzs-1 靶向抑制TopoI 表达的作用可能是依赖于Caspase-3 的酶联反应而启动细胞凋亡程序。且与HCPT 相比,Mzs-1 具有可人工合成、成本较低等优势,为临床治疗胃癌提供新思路。
综上可知,Mzs-1 能抑制人胃癌细胞株SGC-7901 增殖,诱导SGC-7901 细胞凋亡,机制可能与Mzs-1 抑制SGC-7901 细胞内TopoI 活性及蛋白表达有关。但Mzs-1 对其他恶性肿瘤细胞的抑制增殖、诱导凋亡作用仍需进一步探索。
