微乳液中豆荚过氧化物酶催化制备(S)-奥美拉唑
2021-09-03王志勇李德鹏李惠玲王繁业
王志勇,李德鹏,李惠玲,王繁业
(青岛科技大学化工学院,山东 青岛 266042)
奥美拉唑属于质子泵抑制剂(proton pump inhibitor,PPI),是手性亚砜的一种,是一类治疗消化系统溃疡性疾病的有效药物,其立体构型与药物的药理活性等密切相关[1].手性亚砜的合成主要采用化学氧化法[2],这种方法存在很多缺点,包括对环境不友好及重金属残留等[3].由于酶具有对映体选择性,区域选择性以及反应条件温和等特点,使得利用酶促氧化前手性硫化物制备手性亚砜近年来备受关注[4].手性亚砜是一类具有重要价值的药物,利用过氧化物酶催化硫醚的不对称氧化制备手性亚砜一直是合成研究的探究热点.一些过氧化物酶,包括辣根过氧化物酶(horseradish peroxidase,HRP)[5]、豆壳过氧化物酶(soy husk peroxidase,SHP)[6]、烟曲柳氯过氧化物酶[7]等,通过研究它们的反应机理[8],证明这些酶均可用于制备手性亚砜.研究发现单酶[9-10],肌红蛋白[11]和细胞色素[12]可用来催化不对称氧化合成亚砜化合物,然而也存在一些严重的缺点,如需要昂贵的辅助因子或辅助因子循环系统,有些则需使用昂贵且商业化程度较低的酶源.
本研究首次将从豆荚中提取的豆荚过氧化物酶(soybean pod peroxidase,SPP)用于硫醚的不对称亚砜氧化制手性亚砜,SPP价廉易得,与种皮中的豆壳过氧化物酶(SHP)有所不同.SPP尚未有用于不对称氧化的研究报道.微乳液体系适合于疏水底物的反应,而且酶在微乳液中具有超活性.在本研究中,由于疏水底物和产物的存在,因此选用油包水微乳液为反应介质.十六烷基三甲基溴化铵/氯仿/正丁醇/水是常用的油包水微乳液体系,适用于本反应体系.
本研究从大豆荚中提取SPP,在十六烷基三甲基溴化铵/氯仿/正丁醇/水构成的微乳液中,催化奥美拉唑硫醚氧化生成(S)-奥美拉唑.在酶催化不对称氧化反应中,影响产物转化率和对映体纯度的因素很多,如反应温度、W/O值(水和表面活性剂摩尔浓度之比,即水与CTAB之比)、底物浓度等,为提高(S)-奥美拉唑的收率,将采用RSM优化不对称亚砜氧化反应条件.
1 实验材料
奥美拉唑硫醚购自济南沃德化工有限公司,(S)-奥美拉唑购自苏州维塔化工有限公司,奥美拉唑购自山东寿光富康药业有限公司,鲜豆荚购自蔬菜市场.其他试剂均为分析纯.
2 实验方法
2.1 豆荚过氧化物酶的分离纯化
清洗后的新鲜大豆豆荚用高速食品搅拌机破碎,转速为15 000 r·min-1,然后在4 ℃磷酸盐缓冲液中浸提2 h,用500目滤布过滤.滤液用质量分数为12%的聚乙二醇(PEG 4000)和质量分数为13%的K2HPO4构成的双水相体系分离,超滤,利用锌离子除杂,使用葡聚糖凝胶(Sephadex G-75)分离纯化.最后将浓缩液冷冻干燥,制得活性为160 U·mg-1的过氧化物酶粉末.
2.2 过氧化物酶催化油包水微乳中奥美拉唑硫醚制备(S)-奥美拉唑
在25 mL小锥形瓶中,用SPP催化油包水微乳中的奥美拉唑硫醚,加入CTAB(1.265 g)、氯仿(7.8 mL)、正丁醇(1.2 mL)、奥美拉唑硫醚,1 mL磷酸盐缓冲液(pH=6.0),制得W/O值为16的CTAB/氯仿/正丁醇/水油包水微乳液,最终SPP酶活性浓度范围为240 ~ 3 200 U·mL-1.在微乳中加入H2O2引发亚砜氧化,反应温度50 ℃,摇床转速150 r·min-1,反应5 h.用注射器从反应介质中取样,在样品中加入3倍蒸馏水以分离水相和有机相,有机相用于测定奥美拉唑硫醚的转化率和(S)-奥美拉唑产率.从反应混合物中取样,采用 HPLC测定H2O2浓度.由于底物、产物在水中溶解度很小,所以,它们在水中残留很小.
2.3 高效液相色谱(High-Performance Liquid Chromatography,HPLC)分析
采用手性HPLC测定S构型和R构型的奥美拉唑硫醚的转化率和(S)-奥美拉唑产率.采用Agilent 1200 LC型液相色谱仪(安捷伦科技有限公司),检测波长为302 nm,柱温为30 ℃,手性色谱柱为Amyose-SA(规格250 mm×4.6 mm,填料粒径5 μm,日本维美希公司生产).流动相为体积比15∶85的乙腈-磷酸盐缓冲液(pH=6.0),流速0.6 mL·min-1.测定H2O2浓度的色谱柱为Inertsil ODS-SP(规格为15 mm × 4.6 mm,填料5 μm),流动相为体积比2∶8的甲醇和水,检测波长220 nm,流速0.5 ml·min-1.(S)-奥美拉唑的保留时间为6.96 min,(R)-奥美拉唑的保留时间8.28 min.
2.4 (S)-奥美拉唑核磁谱图数据
1H NMR (500 MHz,DMSO-d6),δ:8.10 (s,1H),7.51 (d,J=7.5 Hz,1H),7.09 (d,J=1.3 Hz,1H),6.97 (dd,J=7.5,1.3 Hz,1H),5.00 (s,1H),4.76 (s,2H),3.87 (s,3H),3.69 (s,3H),2.23 (s,3H),2.16 (s,3H).
13C NMR(125 MHz,DMSO-d6),δ:166.19 (s),164.25 (s),158.20 (s),150.87 (s),149.70 (s),140.20 (s),139.29 (s),127.52 (s),126.29 (s),116.18 (s),114.20 (s),99.81 (s),61.27 (s),59.86 (s),55.56 (s),12.94 (s),11.28 (s).
反应制得(S)-奥美拉唑的1H NMR和13C NMR数据均与文献[13]数据相符.
3 实验设计与统计分析
通过单因素实验,确定了SPP在油包水微乳液中催化亚砜氧化的主要影响因素.选取W/O值、H2O2浓度和温度三个因子作为自变量,底物奥美拉唑硫醚的转化率作为因变量进行分析实验,分别用A、C、T、Y表示.用Design Expert 8.0.6软件设计实验,共17个实验点,表1给出设计的实验方案的因素及水平.
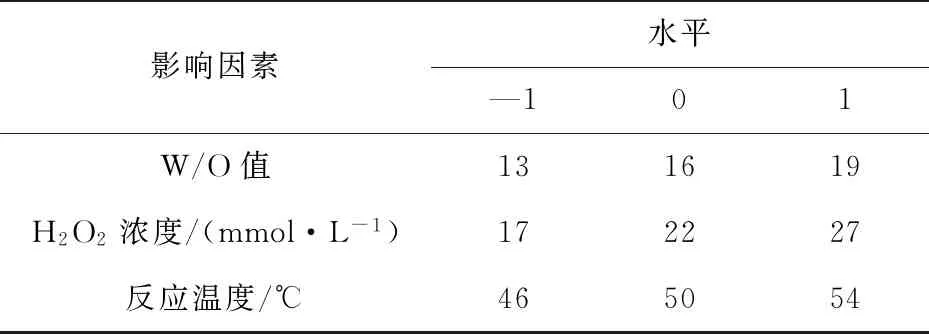
表1 Box-Behnken实验设计的因素和水平Tab.1 Factors and levels of Box-Behnken experimental design
4 实验结果与讨论
4.1 SPP催化奥美拉唑硫醚生物氧化制备(S)-奥美拉唑
SPP催化奥美拉唑硫醚生物氧化生成(S)-奥美拉唑的反应式为:
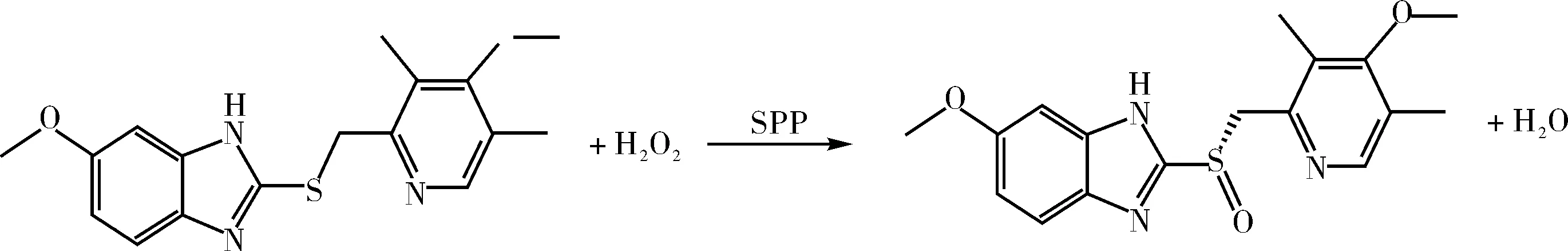
.
根据选定实验点的条件,利用SPP催化奥美拉唑硫醚,测定奥美拉唑硫醚的转化率,实验结果如表2所示.
利用RSM确定了最优拟合模型(式1),表3给出回归分析结果,分析了W/O值(A)、H2O2浓度(C)和温度(T)对奥美拉唑硫醚转化率(Y)的影响.
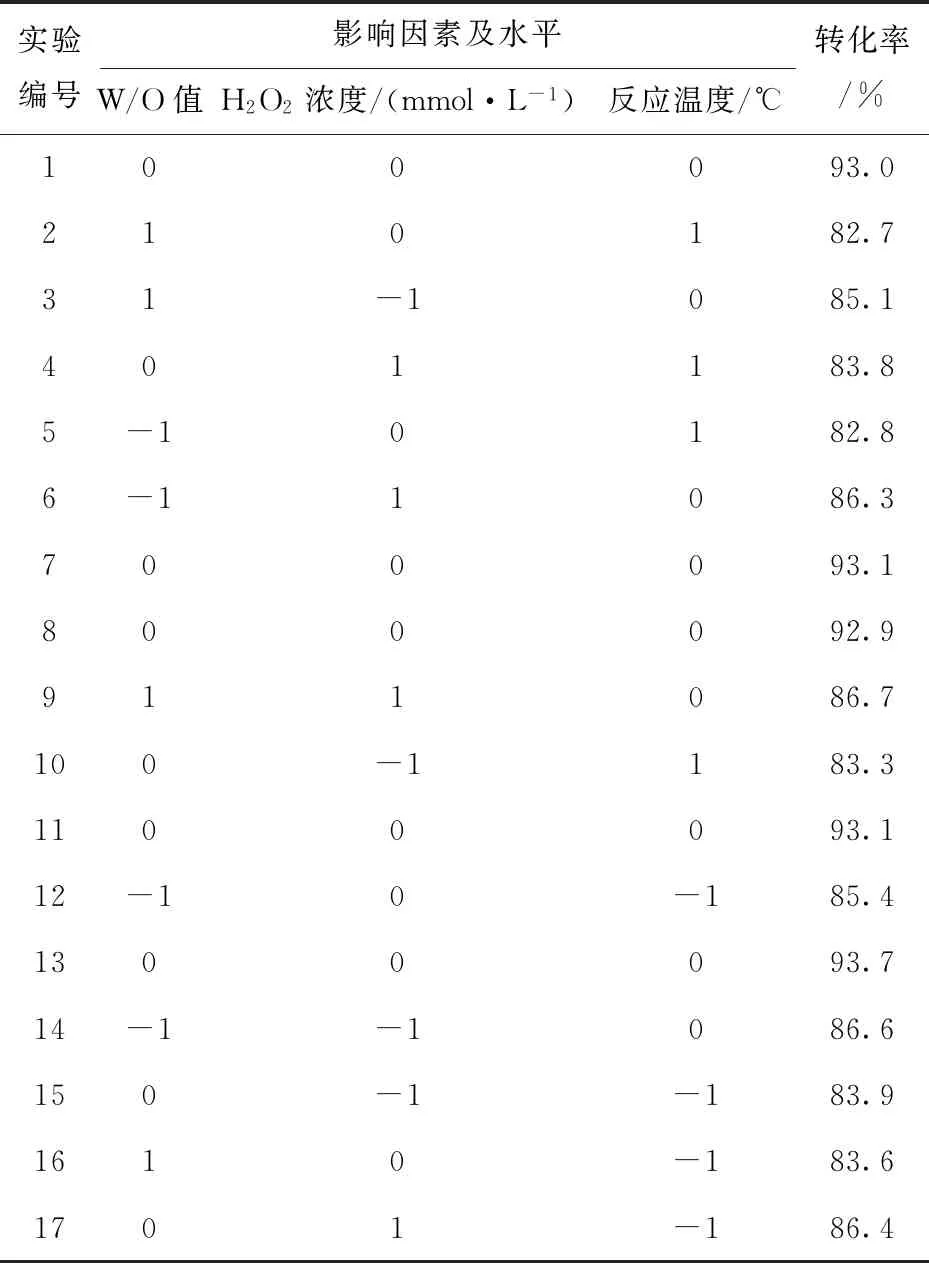
表2 Box-Behnken设计和RSM产量结果Tab.2 Box-Behnken design and RSM output results
Y=93.16-0.37A+0.54C-0.84T+
0.47AC+0.43AT-0.50CT-3.86A2-
3.13C2-5.68T2,
(1)
式中,A为W/O值的水平,C为H2O2浓度的水平,T为反应温度的水平,Y为奥美拉唑硫醚转化率.
回归模型式1中,系数为正时,表明该因素与响应值相应值正相关;反之,系数为负则说明为负相关.如式1所示:C、AC和AT的系数为正,表明如果提高这些因素,则奥美拉唑硫醚的转化率增加.在选定的17个试验点的水平下,对拟合模型和模型中各单项式(如0.54C,—0.50CT)进行方差分析,分析结果如表3所示.
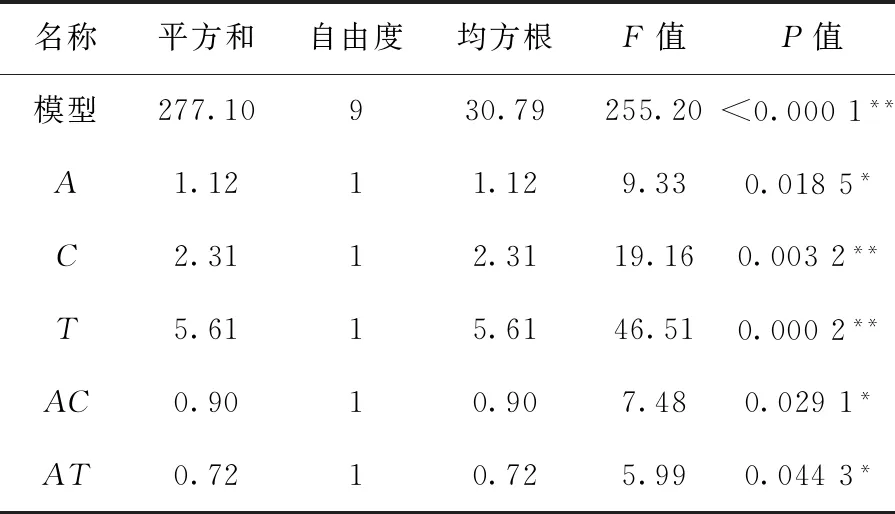
表3 拟合模型的方差分析Tab.3 Analysis of variance of the fitted model
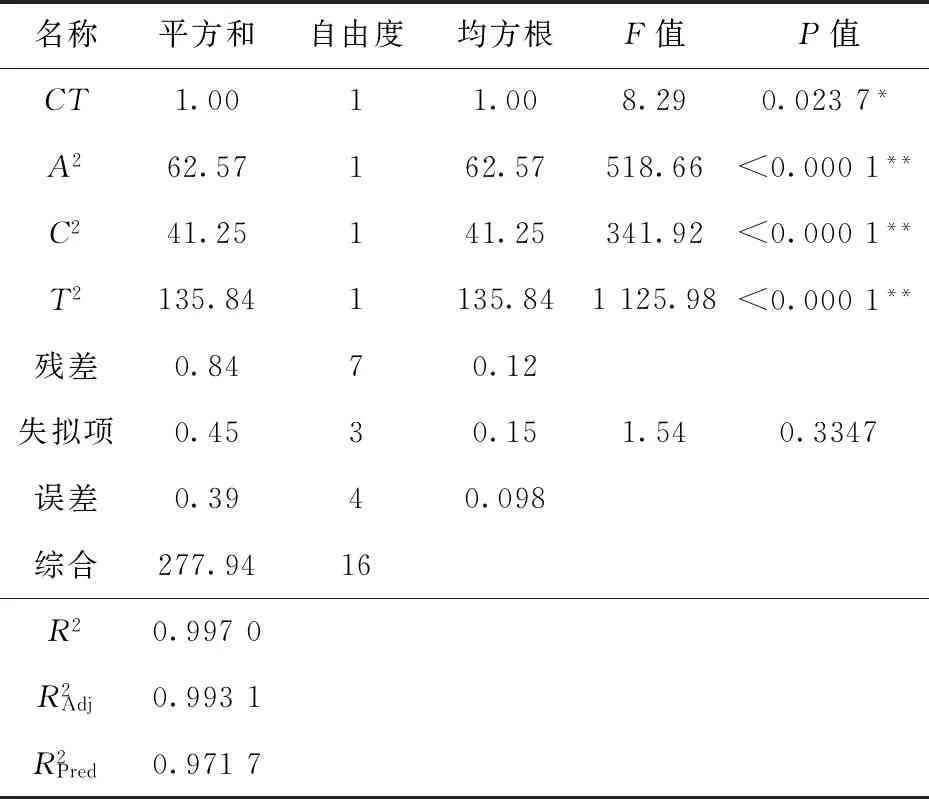
续表3
4.2 各种因素交互作用对奥美拉唑硫化物转化率的影响
根据该模型绘制了响应面图,直观地反映了各因素对奥美拉唑硫化物转化率的影响.如图1、图2和图3所示,每个图都有两个目标变量,而另一个变量的编码值保持为零.W/O值(A)和H2O2浓度(C)对转化率(Y)的影响如图1所示:开始时转化率随W/O值的增加而增加,直到出现最大转化率61.5% (W/O值约为16);然后转化率随W/O值的增加而下降.W/O值直接影响微乳液中水核的尺寸,而水核大小是影响酶活性的关键因素,因而存在一个最佳W/O值使底物转化率最大.在微乳液中,酶活性与W/O值的关系曲线形状一般为钟形曲线[14].在油包水微乳液中,W/O值对酶活性的影响很大[15-16].最优W/O值表明油包水微乳液中的水核尺寸与酶分子的大小相适应,从而使酶表现出超活性.如果W/O值非常小,会导致大多数酶分子不能浸泡在水核中,而是直接在有机溶剂中失活;而当W/O值较大时,酶活性随W/O值的增加而降低,这可能是由于微乳液中水分含量的增加所致[17].
反应介质可能会改变过氧化物酶的构型偏好.SHP催化硫化物反应在水环境中的不对称氧化有利于生成S构型,而在有机溶剂中则有利于生成R构型[18].本实验研究的油包水型微乳液中,反应主要发生在水相,而不是有机相,因此SPP构型偏好应与在水中相同,为S构型.SPP和SHP的催化性能也可能存在一定的差异.在缓冲液中,SHP催化不对称氧化生成手性亚砜,e.e.约为90%[6],而已有报道无手性.HRP催化氧化表现出明显的对映选择性,在pH 7.0和4.5下,e.e.为60% ~ 70%[5].
图2和图3分别显示了W/O值与温度的相互作用以及H2O2浓度与温度的相互作用.反应温度会直接影响反应的活性和稳定性[19].从图2可见,反应的最适温度为49.67 ℃,转化率为93.75%,HRP通常工作在20~30 ℃之间,说明SPP的热稳定性高于HRP.当温度高于50 ℃后继续升高温度时,转化率逐渐降低,这是因为高温在一定程度上会使酶失活.
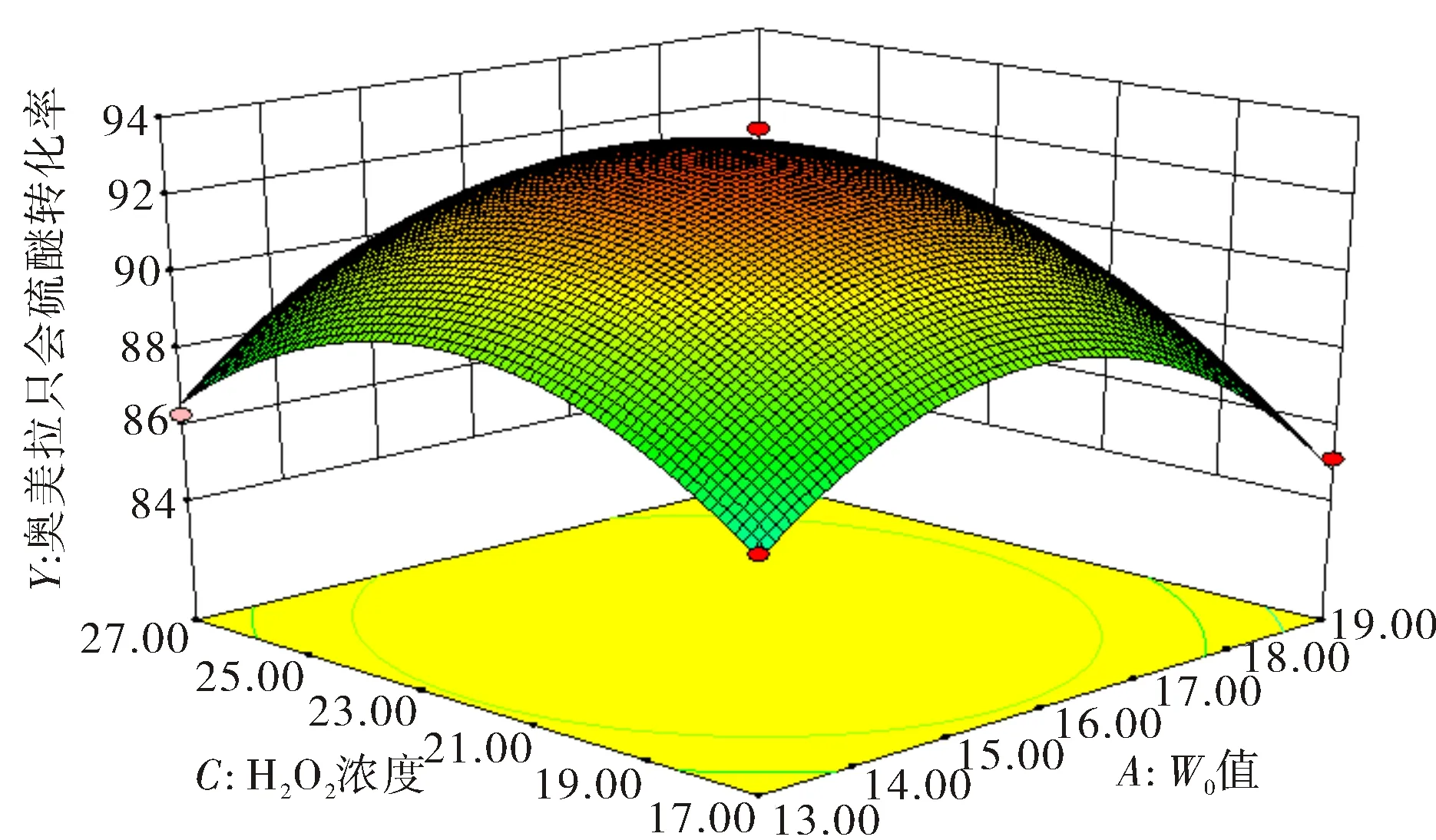
图1 W/O值和H2O2浓度对奥美拉唑硫醚转化率影响的响应曲面图Fig.1 Response surface graph of the influence of W/O value and H2O2 concentration on the conversion rate of omeprazole sulfide
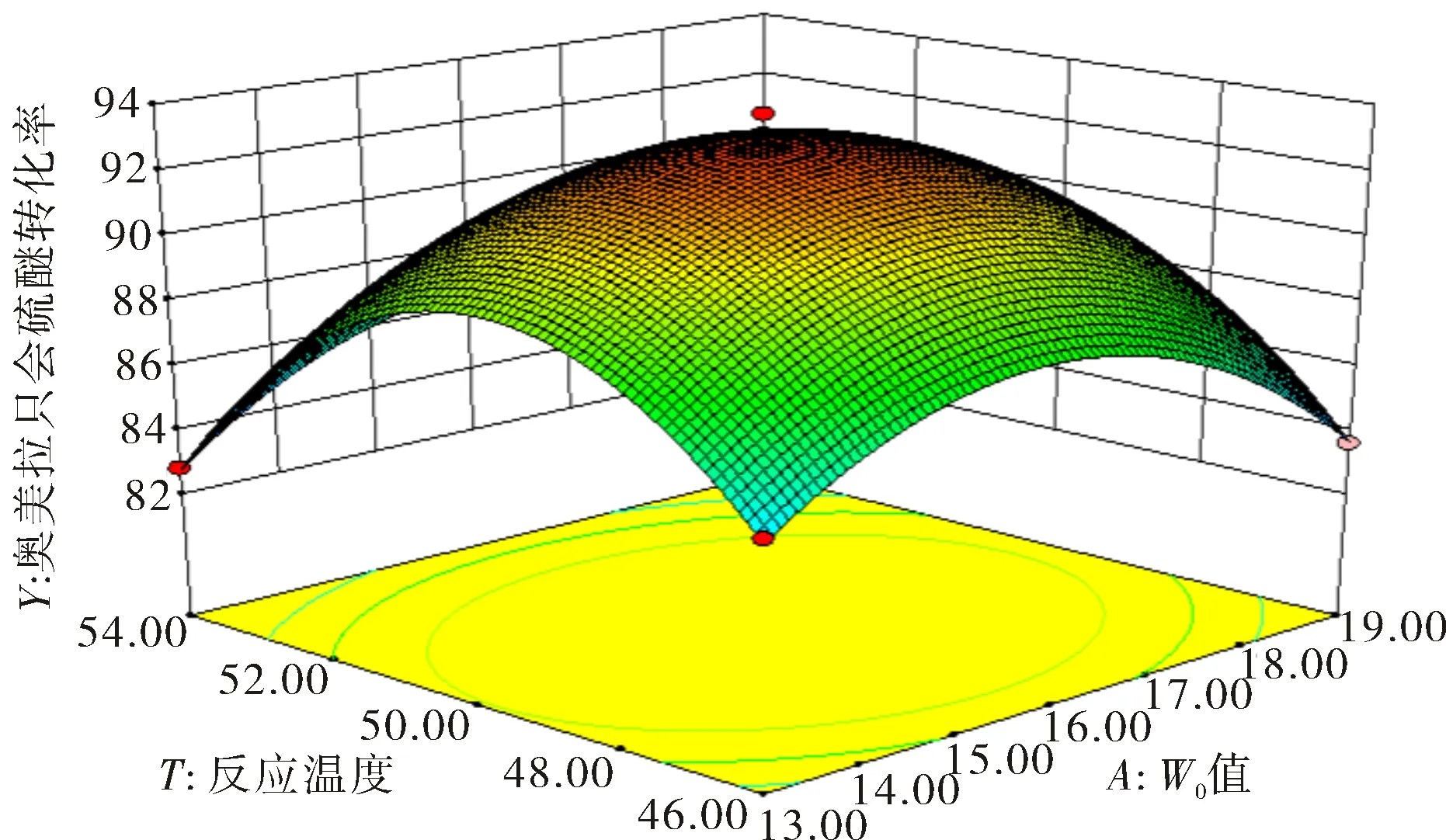
图2 W/O值和反应温度对奥美拉唑硫醚转化率影响的响应曲面图Fig.2 Response surface graph of the influence of W/O value and reaction temperature on the conversion rate of omeprazole sulfide
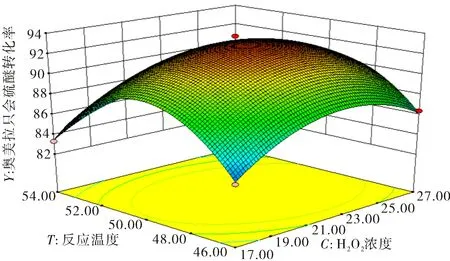
图3 H2O2浓度和反应温度对奥美拉唑硫醚转化率影响的响应曲面图Fig.3 Response surface plot of the influence of H2O2 concentration and reaction temperature on the conversion rate of omeprazole sulfide
图1和图3显示,H2O2的浓度对奥美拉唑硫醚的转化率有显著影响.开始时,转化率随着浓度的增加而增加,直到浓度达到22 mmol·L-1,奥美拉唑硫醚与H2O2的物质的量比为1∶1.1,奥美拉唑硫醚最高转化率达到93.75%,然后随着浓度的增加,转化率逐渐下降.当H2O2浓度过低时,无法满足奥美拉唑硫醚氧化所需要的量,导致转化率下降;当H2O2浓度过大时,由于过氧化物酶可被H2O2灭活[20],导致SPP活性受到抑制使得转化率降低.H2O2的氧化作用导致酶中的二硫键被破坏和蛋白质一级结构丧失[21-23],从而使酶失活.因此,存在最佳H2O2浓度使得奥美拉唑硫醚转化率最高.采用响应面分析法确定了最佳条件.响应面分析和模型计算得到了最佳工艺条件:W/O值为15.85,H2O2浓度为22.44 mmol·L-1,反应温度为49.68 ℃.在SPP初始酶活性浓度为3 200 U·mL-1,反应时间为50 ℃的条件下,重复实验3次,得到的奥美拉唑硫化物的转化率为93.75%,与预测值(93.23%)非常接近,相应的(S)-奥美拉唑的收率和EE分别为91.56%和96.08%,表明SPP具有良好的对映选择性和较高的热稳定性.
5 结论
(S)-奥美拉唑抑制胃酸的效果优于其他质子泵抑制剂,而且对胃酸相关性疾病有更好的临床治疗效果[24].采用响应面法优化了在CTAB/氯仿/正丁醇/水油包水微乳液中SPP催化奥美拉唑硫醚生成(S)-奥美拉唑的反应条件.当SPP初始酶活性浓度为3 200 U·mL-1时,获得的奥美拉唑硫醚的转化率、(S)-奥美拉唑收率及e.e.分别为93.75%、91.56%、96.08%.最佳反应条件:W/O值为15.85,H2O2浓度22.44 mmol·L-1,反应温度为49.68 ℃,建立了响应面模型,其R2为0.997 0,表明该模型对实验值具有较高的预测精度.该实验使用游离酶,无法循环使用,可对酶进行固定化处理,使得酶可以循环使用,降低成本.
本研究同时证明SPP成本低、对映体选择性好、热稳定性好,可替代成本较高的HRP用于进行生物催化反应.
