人参寡肽抗苯并芘诱发肺上皮细胞炎性损伤研究
2021-09-02赵传欣
高 超,刘 杰,赵传欣
(1.南方医科大学第三附属医院药剂科,广东广州 510000;2.深圳大学呼吸系统变态反应国家重点实验室,广东深圳 518060;3.东营市人民医院科教科,山东东营 257000)
人参作为一种常用中药,具有补脾益肺、扶正祛邪、补齐益智的功效,在韩国、中国和日本等国家被广泛使用。人参富含生物活性成分,如人参皂苷、人参多糖、多肽和黄酮类化合物等[1]。研究发现人参皂苷是其主要有效成分,具有抗肿瘤、抗氧化、抗菌抗病毒等多种功效[2]。然而,人参肽类化合物的研究较少。寡肽是多肽的一种分类,一般由4~10个氨基酸组成,具有易于吸收的特点;现代研究发现,多种寡肽具有极强的生物活性,如免疫调节功能[3]、抗氧化[4]、抗炎[5]等,因此寡肽是新药研发的潜力股。
随着大气污染的加剧,哮喘、急性呼吸道感染和肺癌等疾病不断发生。研究表明,长期暴露在空气污染物中会增加哮喘的发病率[6]。化石燃料燃烧被认为是空气污染中多环芳烃的主要来源[7],其中苯并芘(Benzopyrene,Bap)是一种常见的致癌物,与哮喘等呼吸系统疾病的发病有着密切的关系[8]。芳香烃受体(Aromatic Hydrocarbon Receptor,AHR)是一种配体激活转录因子,被激活后AHR从细胞质转运到细胞核,导致靶基因转录的改变(如CYP1A1、CYP1B1)和诱发免疫反应[9−10]。此外,AHR可通过调控炎症细胞因子的表达进而影响免疫反应[11]。此外,气道上皮细胞也可通过产生炎性细胞因子对环境刺激作出反应[12],在哮喘的发生过程中发挥着关键作用[13]。核因子(NF-κB)在炎症反应的基因调控和炎症细胞因子转录调控中都起着重要作用[14]。如在LPS刺激的THP-1细胞中,c-Jun复合物与NF-κB蛋白p50/p65相互作用会协同增强TNF-α启动子活性[15]。
基于此,本研究将分离人参中的寡肽类活性成分,治疗由Bap导致的肺上皮细胞损伤,检测肺上皮细胞中ROS的含量、线粒体膜电位的变化和细胞凋亡等指标,并研究其可能涉及的作用机制,为人参的功能性产品的开发甚至是寡肽新药的研发提供新的思路和参考依据。
1 材料与方法
1.1 材料与仪器
新鲜人参 深圳市凯联健康生物技术有限公司(2019年11月,购买于吉林省通化市东昌区光明路11号同仁堂药店,经暨南大学药学院周光雄教授鉴定为(Panax ginsengC. A.Meyer)是五加科、人参属多年生草本植物人参根);IMDM、DMEM培养基和胎牛血清(FBS)Invitrogen(Termo Fisher Scientifc,MA,USA);人肺上皮II型细胞(A549) 中国科学院细胞库(上海);ELISA试剂盒 碧云天生物科技有限公司(江苏省碧云天生物技术研究所);其他化学试剂 均为分析纯。
Alliance MINIHD6多功能化学发光成像仪UVITEC公司;multiskan GO全波长酶标仪 赛默飞公司;CytoFLEX小型细胞信号分析仪 贝克曼公司。
1.2 实验方法
1.2.1 人参总蛋白的制备及寡肽的分离筛选
1.2.1.1 蛋白的提取 所有提取和分离步骤均在低于4℃条件下进行。将未做烘干处理的新鲜人参(2.0 kg)用榨汁机搅碎,100~200目筛过滤,滤液在2500 mL水/异丙醇(1:15 w/v)中搅拌4 h。随后,抽滤,收集沉淀物(110 g)并溶解在0.20 mol/L磷酸盐缓冲溶液(PBS,pH7.3)中(5%,w/v)。离心(8000×g,15 min),收集上清液并冷冻干燥,作为总蛋白在−20℃下保存备用。
1.2.1.2 超滤分馏 以1 k Da分子量(MW)的超滤膜对所得总蛋白进行分离,获得两种肽组分RSO-A(MW≤1 k Da)和RSO-B(MW>1 k Da)。
疏水色谱:将RSO-A溶解于1.20 mol/L(NH4)2SO4中并上样于缓冲液(0.20 mol/L PBS,pH7.3)平衡的Sepharose CL-4B疏水色谱柱(3.0 cm×90 cm)。以2.0 mL/min流速的(NH4)2SO4(1.20、0.60和0 mol/L)逐步洗脱。每50 mL收集并280 nm监测。共收集到10个组分,冻干,检测其增强A549细胞抗Bap暴露导致细胞损伤的活性,收集活性最强的部分用于阴离子交换色谱。
1.2.1.3 阴离子交换色谱 将RSO-A-2溶液(3 mL,786 mg/mL)装入去离子水预平衡的DEAE-52纤维素阴离子交换柱(2.5 cm×110 cm)中,用蒸馏水、0.10、0.60和1.20 mol/L (NH4)2SO4溶液以2.5 mL/min的流速洗脱,每60 mL收集洗脱液,280 nm监测。收集6个组分(RSO-A-2-1~RSO-A-2-6)冻干,检测其增强A 549细胞抗Bap暴露导致的细胞损伤的活性,收集活性最强的部分用于凝胶过滤色谱。
1.2.1.4 凝胶过滤色谱 在Sephadex G-25柱(2.2 cm×110 cm)上以1.5 mL/min的流速对RSO-A-2-3溶液(2 mL,252 mg/mL)进行分馏。280 nm处收集并监测,收集4个组分(RSO-A-2-3-1~RSO-A-2-3-4)并冷冻干燥,检测其增强A549细胞抗Bap暴露导致的细胞损伤的活性。收集活性最强的部分用于反相高效液相色谱(RP-HPLC)。
1.2.1.5 反相高效液相色谱 RSOA-2-3-3最终用RPHPLC(安捷伦1200-HPLC)分离。色谱柱为Zorbax,SB C-18柱(4.6 mm×250 mm,5μm),洗脱溶剂体系由水/三氟乙酸(溶剂A;100:0.1,v/v)和乙腈/三氟乙酸(溶剂B;100:0.1,v/v)组成。流速:1.0 mL/min,梯度洗脱法(溶剂B 30%~80%),洗脱时间:60 min,检测波长:280 nm,柱温:20℃。RSO-1(tR 3.32 min)、RSO-2(tR 5.54 min)、RSO-3(tR 7.58 min)、RSO-4(tR 9.96 min)、RSO-5(tR 11.3 min)。HPLC法测定RSO-1~5的纯度(>97.0%),RSO-1~5溶于PBS(10.0 mmol/L)。
1.2.2 细胞培养及活性测定A549细胞于DMEM培养基(10%FBS、100 U/mL青霉素、100μg/mL链霉素和2 mmol/L L-谷氨酰胺)于37°C 5%的CO2培养箱中培养。A 549细胞(3×104细胞/孔)接种于96孔培养板中培养过夜。Bap(10 nmol/L)处理细胞3.0 h后,离心,弃上清液,细胞分别与RSO-1~5(20μmol/L)共培养12 h,CCK8检测试剂盒检测细胞活性。
1.2.3 活性氧(ROS)定及线粒体膜电位(ΔΨm)检测5×105细胞/孔接种于6孔板中培养24 h,Bap(10 nmol/L)处理3.0 h后,离心,弃上清液,细胞换用新的培养基并加入RSO-1(10、50μmol/L)共培养12 h,ELISA试剂盒检测ROS含量。
5×105细胞/孔接种于6孔板中培养24 h,Bap(10 nmol/L)处理3.0 h后,离心,弃上清液,细胞换用新的培养基并加入RSO-1(10、50 μmol/L)共培养12 h后,收集细胞,冷PBS洗涤,用1μg/mL JC-1在37℃黑暗中孵育30 min。流式细胞仪(BD-FACS-Calibur,Franklin Lakes,USA)分析ΔΨm变化情况。
1.2.4 细胞凋亡及Western blotting检测5×105细胞/孔接种于6孔板中培养24 h,Bap(10 nmol/L)处理3.0 h后,离心弃上清液,细胞换用新的培养基并加入RSO-1(10、50μmol/L)共培养12 h,收集细胞用Annexin V-FITC/PI孵育,流式细胞术检测细胞凋亡情况。
5×105细胞/孔接种于6孔板中培养24 h,Bap(10 nmol/L)处理3.0 h后,离心,弃上清液,细胞换用新的培养基并加入RSO-1(10、50μmol/L)共培养12 h,采集细胞总蛋白,参考文献[16]方法测定相关蛋白表达变化情况。
1.3 数据处理
数据用means±SD表示;实验数据使用SPSS19.0软件或GraphPad Prism 5.1版软件(GraphPad)进行进行统计处理;正态分布样本的统计显著性采用独立的Studentt检验或方差分析进行评估;所有实验重复3次,P<0.05在所有分析中被认为具有统计学意义。
2 结果与分析
2.1 人参寡肽抗Bap诱导的A549细胞损伤作用
肽类化合物通常在ESI-MS/MS条件下质子化,由于在如此低的能量下很难打破侧链的化学键,因此碎片大多发生在酰胺键上。因此,当碰撞能量小于200 ev时,b和y离子是主要的碎片离子[17]。将分离得到的人参寡肽用高效液相色谱-电喷雾质谱(HPLCESI-MS)对其氨基酸序列进行鉴定。以对RSO-1进行分子质量测定和肽结构表征(图1)为例,离子片段m/z 546.2298为[M+H]+。离子片段m/z 417.1883为b4离子,m/z 382.1508为y4离子,m/z 324.1308为y3离子,m/z 306.1194为[y3-H2O+H]+离子。离子(m/z 278.1248)为[y3-COOH+H]+离子,m/z 195.0872为b3-b1离子,m/z 110.0705为典型片段[His-COOH+H]+。据此,推断该肽的氨基酸序列为EGHGF。其余RSO-2~5氨基酸序列鉴定方式参考RSO-1,氨基酸序列见表1。
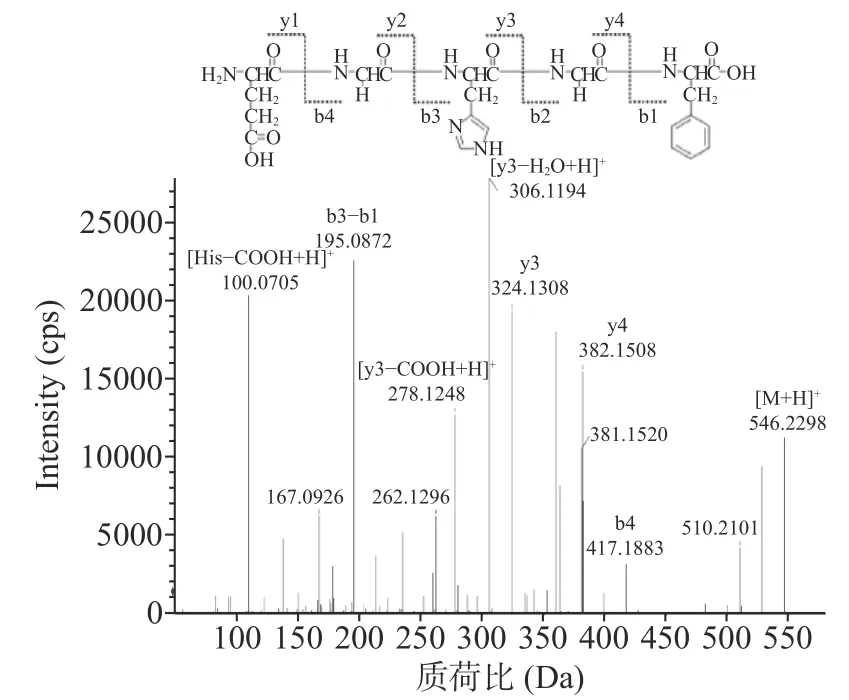
图1 RSO-1结构及质谱图Fig.1 Structure and mass spectrum of RSO-1

表1 RSO-1~5增强A549细胞抗Bap暴露导致的细胞损伤作用Table 1 RSO-1~5 enhance the effect of A549 cells against cell damage caused by Bap exposure
为了避免RSO寡肽本身可能存在的细胞毒性,检测了RSO寡肽对A 549细胞活性的影响。此外,RSO-1~5对A 549细胞的细胞毒性实验采用CCK8方法检测,实验结果显示RSO-1~5在0~1.18 mmol/L(24 h)范围内对A549细胞活性无影响。
研究发现,Bap暴露会诱发氧化应激、炎性因子分泌进而导致呼吸道上皮细胞损伤[18]。如表1所示,将正常对照组细胞活性设为100%,与正常对照组相比,Bap组细胞活力降低20.7%,说明Bap暴露使A 549细胞受到严重损伤。RSO-1~5处理提高了细胞活性,如经RSO-5使细胞活力提高了7.90%,而RSO-1组的细胞活力提高了13.0%(P<0.05),说明RSO-1具有增强A 549细胞抗Bap暴露诱导的氧化应激、炎性损伤的功能。
2.2 RSO-1增强A549细胞抗Bap暴露导致的细胞凋亡
细胞凋亡是一种程序性细胞死亡,细胞凋亡过程中会出现细胞收缩、核碎裂和染色质浓缩等细胞形态的特征性变化[19]。流式检测结果显示,与Control组相比,Bap组细胞总凋亡上升5.60%。而与Bap组相比,RSO-1(10、50μmol/L)治疗组细胞总凋亡率分别降低2.77%和5.28%,说明RSO-1可增强细胞抗Bap诱导的细胞凋亡能力。细胞凋亡实验为RSO-1抗Bap诱导A 549细胞损伤的保护作用提供了直观的证据。
2.3 RSO-1减轻Bap暴露诱导的A549细胞氧化应激
自由基过量产生或抗氧化能力下降将导致DNA损伤并诱发细胞凋亡[20]。在炎症细胞中,Bap可通过诱导活性氧(Reactive Oxygen Species,ROS)产生和线粒体膜电位(ΔΨm)降低,诱发氧化应激反应进而损伤细胞[21]。因此,可通过检测细胞ROS变化情况以研究RSO-1是否能抑制Bap暴露诱导的细胞ROS产生,结果如图3A所示。将正常对照组ROS含量设为1,与Control组相比,Bap组的ROS含量上升了2.73倍(P<0.05)。当RSO-1治疗后,Bap诱导的ROS生成明显减少。经不同浓度的RSO-1处理后,A549细胞中ROS含量分别下降31.6%(P<0.05)和56.8%(P<0.05)。
线粒体依赖通路在细胞受到氧化损伤时起着重要作用[22]。为探讨RSO-1抗Bap诱导A549细胞氧化损伤的机制,检测了细胞线粒体膜电位(ΔΨm)变化情况。如图3A所示,Bap暴露使ΔΨm降低的A 549细胞比例从4.05%(对照组)下降到17.6%(P<0.05)。而经RSO-1处理后,ΔΨm下降的A549细胞比例分别减少了6.42%和11.7%。说明,RSO-1减少了细胞ROS的积累,减少了A549细胞的ΔΨm下降,说明RSO-1能减轻Bap暴露导致的A 549细胞氧化应激反应,保护细胞免受氧化损伤。
线粒体功能障碍会导致细胞色素c(Cytochrome C,Cyt c)从线粒体释放到细胞质[23]。因此,用Western blotting方法检测细胞质和线粒体Cyt c水平。结果表明,与Control组相比,Bap暴露导致细胞质Cyt c含量增加和线粒体Cyt c含量减少(图3B)。然而,RSO-1处理逆转了Bap暴露导致的细胞质和线粒体Cyt c的变化。
Trx系统在维持细胞氧化还原稳态中起着至关重要的作用[24],鉴于Bap暴露会导致ΔΨm降低,ROS含量升高,进一步检测A549细胞中Trx和TrxR的变化。如图3B所示,Bap暴露导致Trx和TrxR的表达减少,而RSO-1使Trx和TrxR的表达均增加。
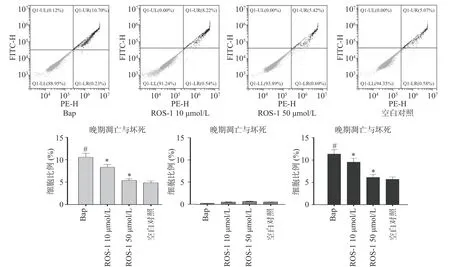
图2 RSO-1抑制Bap暴露诱导的A549细胞凋亡Fig.2 RSO-1 inhibits A549 cell apoptosis induced by Bap exposure
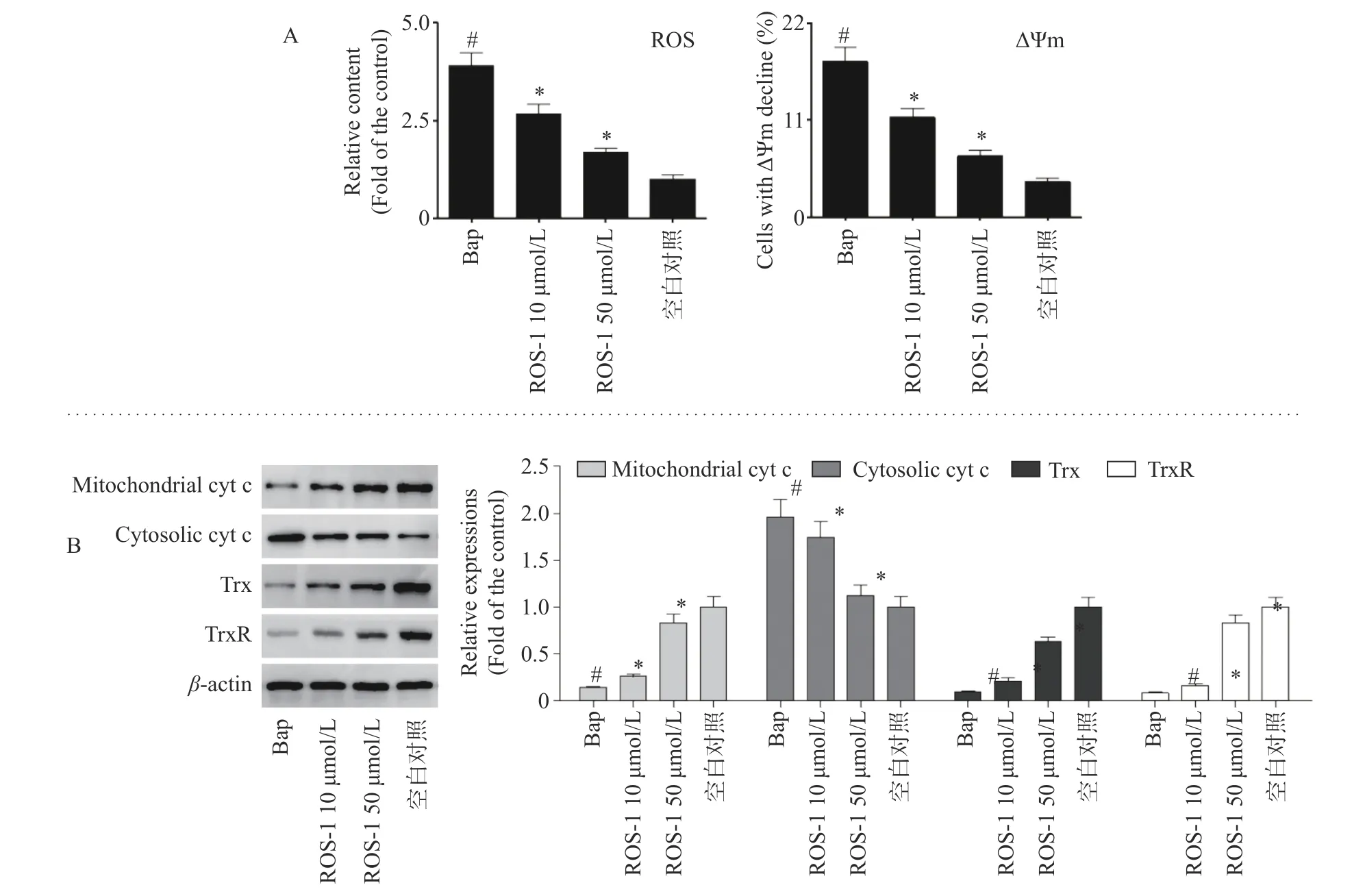
图3 RSO-1抑制Bap诱导的氧化应激反应Fig.3 RSO-1 inhibits Bap-induced oxidative stress
2.4 RSO-1对NF-κB和MAPKs信号通路的影响
NF-κB信号通路在许多炎症性疾病中会被激活,可以调控TNF-α和IL-1β等炎症介质的表达[25]。研究表明,巨噬细胞通过有丝分裂原激活蛋白激酶(Mitogen-activated protein kinase,MAPKs)和NF-κB信号途径上调诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达,从而产生一氧化氮(Nitric Oxide, NO)[26]。因此,检测了RSO-1是否通过MAPK和NF-κB信号途径调控A 549细胞以抗Bap诱导的损伤。如图4A所示,Bap暴露激活NFκB信号途径相关蛋白的表达。而与Bap暴露不同,RSO-1作用后A 549细胞NF-κB信号通路的蛋白表达被抑制。如图4A所示,50μmol/L RSO-1作用后显著降低了A549细胞IκBα、IKKα及p65的磷酸化。
MAPKs与NF-κB信号通路类似,与Bap诱导的巨噬细胞炎症介质调节有关。为进一步探讨RSO-1抗Bap暴露诱导的炎性损伤机制,检测了JNK和p38在Bap暴露及RSO-1干预后的表达变化情况。如图4B所示,Bap使JNK和p38磷酸化表达增加并抑制了JNK和p38的表达,而RSO-1下调了JNK和p38的磷酸化,使JNK和p38的表达上升。推测RSO-1的保护作用是通过调节p38和JNK-MAPK,抑制NF-κB的活化发挥作用的。

图4 RSO-1抑制Bap暴露诱导的NF-κB和MAPKs信号通路激活Fig.4 RSO-1 inhibits the activation of NF-κB and MAPKs signaling pathways induced by Bap exposure
2.5 RSO-1抑制Bap暴露诱导的AHR活化及AP-1因子的表达
激活蛋白-1(activator protein-1, AP-1)是调节细胞生存和死亡途径关键的转录因子。AP-1是一种二聚体复合物,由原癌基因编码的Jun家族和Fos家族蛋白质组成。AP-1是由碱性亮氨酸拉链(basic leucine-zipper, bZIP)结构的Jun蛋白质(c-Jun、v-Jun、JunB和JunD)、Fos蛋白质(c-Fos、v-Fos、FosB、Fra1和Fra2)、激活转录因子(activating transcription factor,ATF,包括ATF2、ATF3/LRF1、B-ATF、JDP1和JDP2)和肌肉腱膜纤维肉瘤(musculoaponeurotic fibrosarcoma,MAF,包括C-Maf、Maf B、Maf A、Maf G/F/K和Nrl)家族形成高度保守的同源或异源二聚体,可激活下游靶基因的转录。作为启动基因转录的分子开关,通过细胞应激刺激等各种条件调节基因的表达,参与增殖、凋亡、转化和炎症等多种细胞过程[27]。
因此,检测了RSO-1对A 549细胞AP-1因子表达的影响,结果如图5A所示。与Control组相比,Bap暴露使c-Jun、Jun-B、c-Fos和Fra-1表达增加298%、351%、252%和287%,而RSO-1处理降低了Bap暴露诱导的c-Jun、Jun-B、c-Fos和Fra-1表达。经50μmol/L RSO-1干预后,Bap暴露诱导的c-Jun、Jun-B、c-Fos和Fra-1表达分别下调46.2%、33.9%、49.4%和48.1%。据此推测,RSO-1抗Bap暴露诱导的炎性损伤作用可能是通过调控AP-1因子的表达发挥作用的。

图5 RSO-1抑制Bap暴露诱导的AHR通路激活和AP-1因子表达Fig.5 RSO-1 inhibits AHR pathway activation and AP-1 factor expression induced by Bap exposure
AHR的激活在哮喘和炎症性疾病的重要诱发因素[28]。为探讨RSO-1对Bap暴露诱导A549细胞AHR活化的抑制作用,本研究检测了AHR及其下游CYP1A 1蛋白的表达情况。结果如图5B所示,Bap暴露使AHR表达显著(P<0.05)增加;同样,CYP1A1的表达也显著增加。本研究表明RSO-1干预抑制AHR信号通路的激活。
3 讨论与结论
研究显示环境污染物苯并芘与哮喘等呼吸系统疾病的发病有着密切的关系[28]。人参作为传统中药已经使用历史已达上千年,本课题研究了人参中含有的活性寡肽抗Bap暴露导致的人肺上皮细胞炎性损伤的活性及机制。
炎症反应涉及多条信号通路,其中NF-κB是炎症反应的中枢分子,是抗炎药物的重要靶点[29]。研究发现,RSO-1可抑制暴露Bap诱导的IκBα、IKKα和p65磷酸化。AP-1复合物在调节炎症和炎症介质释放中发挥着重要作用。Bap诱导了c-Jun、Jun-B、Fra-1和c-Fos的表达,而RSO-1抑制Bap暴露诱导的c-Jun、Jun-B、Fra-1和c-Fos的表达。据此推测AP-1可能是RSO-1的重要靶点。AHR是一种受体和转录因子,结果表明Bap暴露诱导AHR信号的激活,而经RSO-1干预后,Bap诱导AHR和CYP1A1在A 549中的表达显著降低,提示AP-1和AHR可能在RSO-1的抗炎作用中起重要作用。推测RSO-1的抗炎作用是通过调节AP-1、NF-κB和AHR通路,抑制Bap诱发的氧化应激反应而发挥作用的。本研究的人参寡肽抗Bap诱发的肺上皮细胞炎性损伤的活性仅为细胞层面的体外实验,实验周期短、费用低,可以一次性检测多种寡肽的抗炎活性,后续实验可构建动物模型,针对一种或多种活性较好的寡肽进行深入研究。本文为人参功能性产品的进一步开发和抗炎新药的开发提供理论基础。
