曲美他嗪对糖尿病大鼠心肌细胞氧化应激和内质网应激水平的影响
2021-09-02杨智勇姜旭朱红
杨智勇,姜旭,朱红
(中国医科大学附属盛京医院心血管内科,沈阳 110004)
糖尿病是一个全球性健康问题,预计到2030年将会有超过5亿5千万人罹患糖尿病,其最主要的一个并发症是心血管疾病,在糖尿病患者死亡原因中占2/3以上[1-3]。高糖状态下,心肌细胞病理生理状态改变导致心肌细胞肥大,心肌纤维化进一步导致心肌细胞凋亡的发生,从而引发心肌功能障碍,若不及时干预,极易进展成糖尿病心肌病,进而引发全心衰竭[2]。心肌细胞在高糖状态下发生上述变化的发病机制尚未完全阐明,研究[4]显示,氧化应激反应和内质网应激深度参与其中,糖尿病患者产生的高水平活性氧(reactive oxygen species,ROS)与体内抗氧化防御系统不平衡,过量的ROS攻击心肌细胞,加速其凋亡的速度。持续高血糖状态还可触发内质网应激,激活分子伴侣糖调节蛋白78(glucose-regulated protein 78,GRP78)参与的未折叠蛋白反应,启动程序性细胞凋亡[5]。高糖状态下,心肌细胞内的氧化应激和内质网应激水平增高并互相协同,导致心肌细胞凋亡的发生,更加重了其向糖尿病心肌病的加速进展[6]。
曲美他嗪是哌嗪类衍生物,可通过抑制心肌细胞线粒体脂肪酸的摄取,促进葡萄糖有氧氧化提供能量,增加其抗氧化能力,并保护心肌免受ROS的损害,它对冠状动脉血流、心肌收缩力、心率并无影响,而是直接改善心肌能量代谢[7]。但曲美他嗪在糖尿病心肌细胞氧化应激和内质网应激中的作用尚不明确。本研究通过高脂饮食联合小剂量链脲佐菌素的方法,建立稳定、可靠、优质的糖尿病大鼠模型,并给予曲美他嗪进行干预,检测各组大鼠心肌组织中氧化应激和内质网应激关键指标,探讨曲美他嗪改善糖尿病大鼠心肌细胞氧化应激和内质网应激水平及其可能的机制。
1 材料与方法
1.1 动物建模与分组
雄性SD大鼠30只,体质量200~220 g,购自北京华阜康实验动物有限公司。所有入选大鼠均饲养于室温25 ℃的动物房中,采用标准颗粒适应性喂养1周,自由进食水。将大鼠随机分为对照组(C组)、糖尿病组(DM组)、糖尿病+曲美他嗪治疗组(TDM组),每组10只。C组采用标准饲料进行喂养,DM组和TDM组给予高脂饲料(D12451)进行喂养。喂养4周后,DM组和TDM组按照30 mg/kg剂量一次性腹腔注射1%链脲佐菌素,C组大鼠一次性腹腔注射同等剂量的柠檬酸盐缓冲液。经尾静脉取血,采用氧化还原方法测定血糖,随机血糖≥16.7 mmol/L并且持续稳定3 d,为糖尿病大鼠模型建立成功。模型建立成功后,TDM组给予曲美他嗪20 mg·kg-1·d-1灌胃,C组和DM组给予等量盐水灌胃,持续4周。记录大鼠每周体质量和血糖的变化情况。本研究中动物建模及处理方法经过中国医科大学附属盛京医院伦理委员会批准,均符合动物伦理学标准。
1.2 主要试剂和药品
链脲佐菌素(美国Sigma公司);高脂饲料(D12451)(京华阜康实验动物有限公司);兔抗大鼠超氧化 物歧化酶(superoxide dismutase,SOD)抗体、小鼠抗大鼠8-羟基脱氧鸟苷(8-hydroxy-2’-deoxyguanosine,8-OHdG)抗体、兔抗大鼠Bcl-2抗体、山羊抗大鼠GRP78抗体(美国Santa Cruz公司);HRP标记的通用型IgG 抗体(北京中山金桥生物技术有限公司);辣根过氧化物酶标记驴抗山羊、山羊抗小鼠、山羊抗兔二抗(上海碧云天公司);曲美他嗪(齐鲁制药有限公司)。
1.3 免疫组化检测心肌组织SOD-1和8-OHdG的表达
采用10%水合氯醛(3 g/kg)腹腔注射麻醉后处死大鼠。取心尖部组织,置于4%多聚甲醛中,石蜡包埋,脱蜡至水,加马血清封闭,3%过氧化氢消除外源性过氧化氢酶,用0.01 mol/L PBS漂洗3次后,分别加入以1 ∶200稀释的兔抗大鼠SOD抗体和小鼠抗大鼠8-OHdG抗体,4 ℃过夜。然后分别用1 ∶100稀释HRP标记的通用型IgG抗体孵育1 h,DAB显色。每组随机选取8个视野,于200倍显微镜下观察、摄像。采用Image-Pro Plus系统对蛋白表达量进行分析。
1.4 Western blotting检测心肌组织SOD、8-OHdG、Bcl-2、GRP78蛋白的表达
取大鼠心肌组织100 mg,经研磨、裂解、匀浆、离心后,提取蛋白,采用BCA法测定提取蛋白的浓度。随后根据浓度进行蛋白电泳,转膜,5%脱脂牛奶封闭,洗 膜,加 入SOD(1 ∶1 000)、8-OHdG(1 ∶1 000)、Bcl-2(1 ∶1 000)、GRP78(1 ∶1 000)抗体4 ℃过夜孵育。洗膜后再选择合适的二抗室温下孵育,洗膜液洗膜。在避光条件下发光法显色,应用凝胶电泳图像分析系统扫描定量,将扫描后得到的蛋白灰度值与相应β-actin灰度值相比,计算出各组蛋白表达的相对百分比,作为蛋白的相对含量。
1.5 统计学分析
采用SPSS 22.0软件处理数据,数据以表示,2组间比较采用t检验,多组间比较采用单因素方差分析,所有数据进行方差齐性检验,方差齐时使用Dunnettt检验,方差不齐时使用非参数检验。P< 0.05为差异有统计学意义。
2 结果
2.1 糖尿病大鼠模型建模的基本情况
DM组和TDM组大鼠毛发粗糙,而C组大鼠毛发顺滑。干预期间,DM组大鼠死亡3只,TDM组大鼠死亡1只,C组大鼠无死亡。
统计建模0周和第1、2、3、4周末大鼠的体质量和血糖。0周时,3组比较,体质量无统计学差异(P> 0.05);与C组比较,DM组和TDM组血糖明显升高(P< 0.05);且DM组与TDM组比较,血糖无明显差异(P> 0.05)。第1、2、3、4周末,与C组比较,DM组和TDM组大鼠体质量均明显降低,血糖均明显升高(均P< 0.05);且DM组与TDM组比较,体质量和血糖均无明显差异(均P> 0.05)。
C组中,大鼠体质量随时间增加而增长,第1、2、3、4周末体质量均高于0周(均P< 0.05),且每周末测得的体质量均高于前一时间点(均P< 0.05);DM组中,大鼠体质量虽然也呈现随时间增加而增长的趋势,第1、2、3、4周末体质量均高于0周(均P< 0.05),但体质量增长速度较C组下降,仅第2、3、4周末的体质量高于第1周末(均P< 0.05),其余各时间点组内比较未见明显差异(均P> 0.05);TDM组中,大鼠体质量变化不明显,各时间点组内比较,体质量无统计学差异(均P> 0.05)。3组中,各时间点组内比较,血糖无统计学差异(均P> 0.05)。上述结果证实,DM组和TDM组糖尿病大鼠模型建模成功。
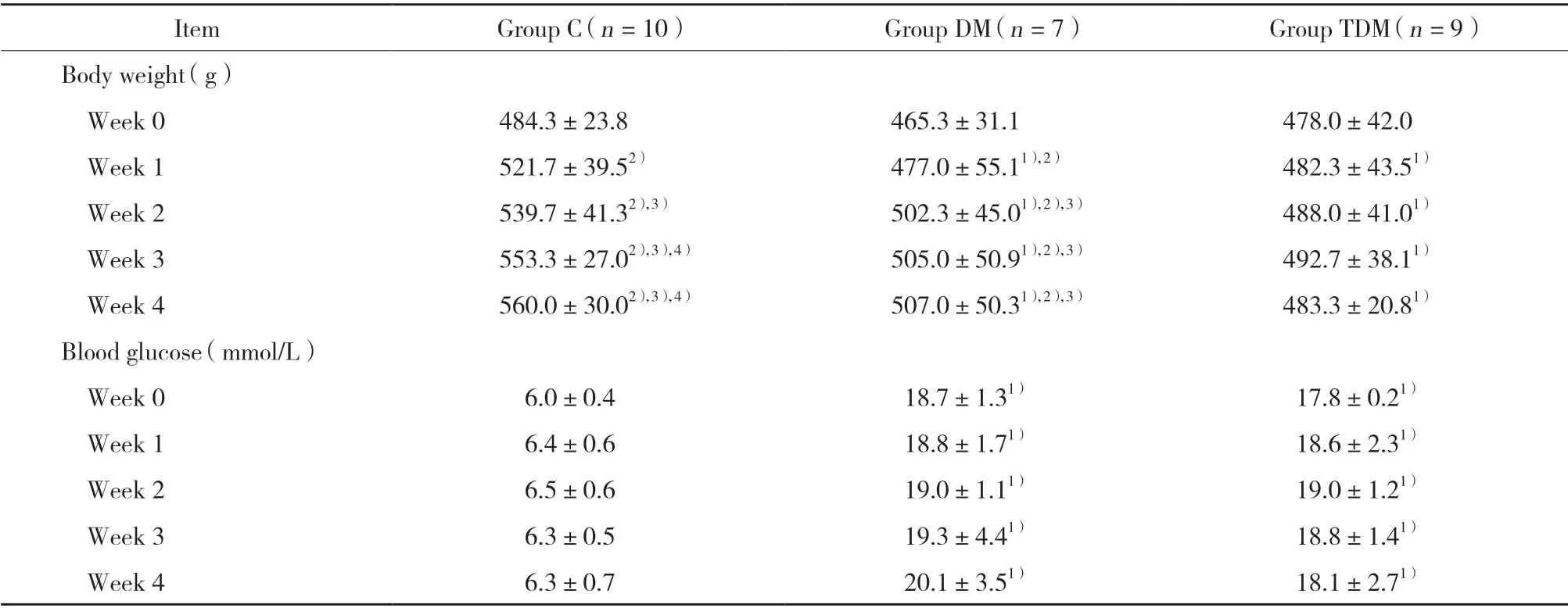
表1 3组大鼠体质量和血糖的变化情况Tab.1 Changes in body weight and blood glucose level of rats in three groups
2.2 免疫组化检测曲美他嗪对大鼠心肌组织中SOD表达的影响
与C组相比,DM组大鼠心肌组织中SOD表达明显下降(P=0.001),而TDM组大鼠心肌组织SOD表达较DM组升高(P=0.012)。说明曲美他嗪可以逆转糖尿病心肌细胞中SOD下降。见图1。
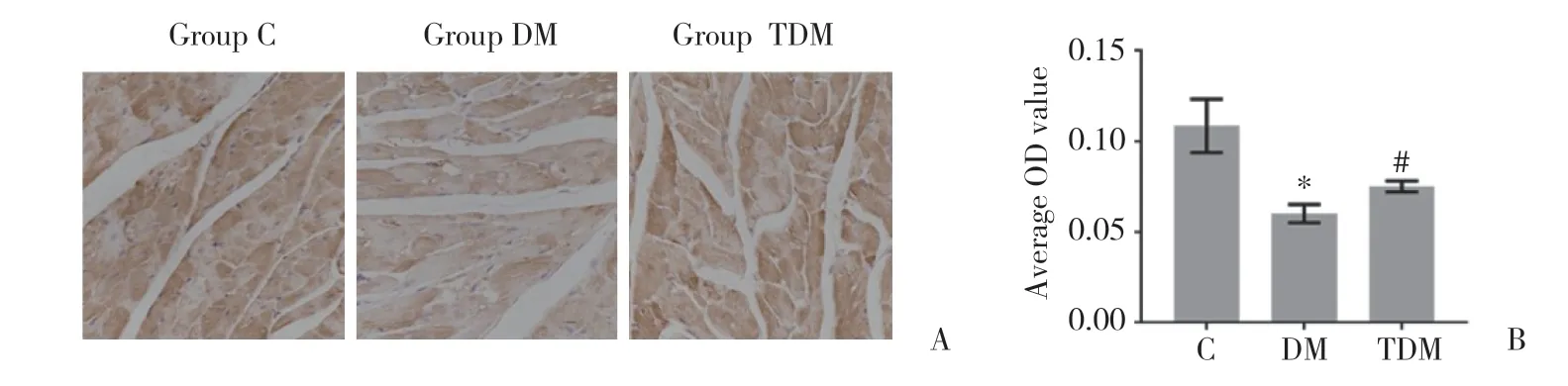
图1 各组大鼠心肌组织SOD的表达和比较Fig.1 Detection and comparison of SOD expression in the myocardium of rats in each group using immunohistochemistry
2.3 免疫组化检测曲美他嗪对大鼠心肌组织中8-OHdG表达的影响
与C组相比,DM组大鼠心肌组织中8-OHdG表达明显升高(P=0.003),而TDM组大鼠心肌组织中8-OHdG表达较DM组降低(P=0.002)。说明曲美他嗪可以逆转糖尿病心肌细胞中8-OHdG过度表达。见图2。

图2 各组大鼠心肌组织8-OHdG表达和比较Fig.2 Detection and comparison of 8-OHdG expression in the myocardium of rats in each group using immunohistochemistry
2.4 Western blotting定量检测曲美他嗪对大鼠心肌组织中氧化应激关键指标的影响
利用Western blotting定量检测各组大鼠心肌组织中氧化应激关键指标SOD、8-OHdG、Bcl-2和GRP78蛋白的表达量。结果显示,与C组比较,DM组中SOD、Bcl-2蛋白表达水平明显降低,8-OHdG、GRP78蛋白表达水平明显升高,而TDM组SOD、Bcl-2蛋白表达水平明显高于DM组,8-OHdG、GRP78蛋白表达水平明显低于DM组,差异均有统计学意义(均P< 0.05)。说明曲美他嗪可以逆转糖尿病时心肌组织中氧化应激水平的升高。见图3。
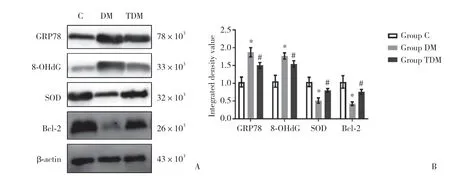
图3 Western blotting检测各组大鼠心肌组织中氧化应激关键指标Fig.3 Detection and comparison of oxidative stress key indicators in the myocardium of rats in each group using Western blotting
3 讨论
糖尿病是一种以慢性代谢性紊乱为表现的内分泌系统疾病,因代谢失调和氧化应激可引发一系列并发症,包括心肌病、视网膜病变、神经病变和肾病。在无高血压和冠状动脉疾病的情况下出现的心肌功能障碍被称为糖尿病心肌病,早期表现为左心室舒张功能损伤,伴有心肌细胞肥大、心肌纤维化和心肌细胞凋亡的发生,进而出现收缩功能障碍。糖尿病心肌病的发病机制极其复杂,目前已知有糖代谢、脂代谢、钙调节异常、氧化应激、炎症反应、内质网应激、线粒体自噬等多种因素参与[8-9],如果不在糖尿病早期心肌细胞病变时及时干预,会造成严重不良后果。
氧化应激在糖尿病心肌细胞损伤及糖尿病心肌病的发生、发展中起重要作用,细胞内氧化应激产生的ROS与机体内抗氧化防御系统不平衡,过量的活性氮介导细胞蛋白质及核酸损伤,引发细胞凋亡,从而引起组织器官功能障碍[10]。SOD是抵抗ROS 的第一道防线,可降低细胞内外ROS水平,具有抗氧化作用,能够有效的抑制氧化应激。ROS介导的DNA损伤在修复过程产生鸟嘌呤修饰产物8-OHdG,鸟嘌呤在DNA碱基中氧化性最强,因此8-OHdG可作为DNA氧化性损伤的标志物。心肌组织中8-OHdG水平,可以反映氧化应激造成心肌损伤的程度[11]。本研究结果显示,糖尿病大鼠心肌组织SOD蛋白表达下降,8-OHdG表达增多,表明氧化应激途径可能参与了糖尿病心肌组织损伤的过程。
糖尿病导致的持续高血糖状态使心肌细胞内未折叠蛋白在内质网腔内聚集,钙离子稳态和氧化还原状态失衡等都会引起内质网功能的改变,当超过内质网的处理能力时会触发内质网应激,启动程序性细胞调亡,引起炎症反应。内质网应激的启动可激活由分子伴侣GRP78参与的未折叠蛋白反应。研究[12]指出,糖尿病大鼠出现心肌舒张功能降低的同时,心肌组织中GRP78升高。本研究结果显示,糖尿病大鼠心肌组织GRP78蛋白表达增多,表明内质网应激可能参与了糖尿病心肌病心肌组织损伤的过程。
糖尿病心肌组织的高氧化应激和内质网应激水平共同作用,进一步加剧了心肌细胞的凋亡,进展至终末期可导致心肌收缩和舒张功能障碍。研究[13]表明,细胞凋亡Bcl-2家族是参与细胞凋亡的重要调节因子,能够通过促进和抑制凋亡的基因相互作用调节细胞凋亡过程。Bcl-2存在于线粒体内,通过阻止细胞色素C释放,抑制细胞凋亡和延长细胞存活时间,发挥抑制心肌组织凋亡的作用。高血糖可引起心肌组织中Bcl-2减少,加速心肌细胞凋亡。本研究结果显示,糖尿病会引起心肌细胞Bcl-2减少,加剧心肌细胞凋亡。
因此,延缓糖尿病心肌病进展的关键之一,是有效抑制糖尿病心肌细胞的氧化应激和内质网应激,从而抑制心肌细胞的凋亡。曲美他嗪是治疗心绞痛的临床常用药,其在心肌细胞线粒体内通过抑制长链3酮酰辅酶A 硫解酶,减少脂肪酸氧化摄取,提高葡萄糖氧化供能,改善心肌能量代谢,发挥抗缺血效应。糖尿病心肌细胞对葡萄糖的利用受损,胰岛素信号通路发生改变,导致心肌细胞对葡萄糖的摄取和利用降低,增加了游离脂肪酸含量,促进动脉硬化形成,导致心肌弥漫性损伤[14-15]。曲美他嗪通过维持细胞膜磷脂合成功能、抑制钙超载、防止线粒体损伤,对糖尿病心肌细胞引起的炎症反应及氧化应激起到抵抗作用,减少心肌细胞凋亡,在预防和治疗糖尿病心肌病中已经取得良好的疗效[12]。但曲美他嗪对糖尿病心肌细胞氧化应激和内质网应激的作用及其机制的研究尚待完善。
本研究通过建立糖尿病大鼠模型,给予曲美他嗪干预,检测各组大鼠心肌组织中氧化应激、内质网应激和细胞凋亡指标。结果证实,曲美他嗪处理组大鼠心肌组织SOD、Bcl-2的表达升高,而8-OHdG、GRP78的表达降低。说明曲美他嗪能够抑制心肌细胞凋亡,对心肌组织起保护作用,其作用机制可能与抑制糖尿病大鼠心肌细胞氧化应激和内质网应激相关。
综上所述,曲美他嗪升高糖尿病大鼠心肌组织中SOD、Bcl-2的表达,降低8-OHdG、GRP78的表达,可能通过抑制心肌细胞氧化应激和内质网应激对心肌起保护作用。上述指标的具体作用机制,今后需进一步深入研究。
