熊果酸联合阿霉素对宫颈癌HeLa细胞增殖的影响*
2021-09-01王沙凝李再巧叶桂芝桂明英
王沙凝,李再巧,吴 冲,田 迪,叶桂芝,宋 羚,桂明英,马 啸,
(1.云南农业大学 普洱茶学院,云南 昆明 650201;2.云南省高原特色农业产业研究院,云南 昆明 650201)
宫颈癌是女性常见恶性肿瘤,发病率仅次于乳腺癌,位居女性生殖系统恶性肿瘤首位,发病早期无特异性症状,部分出现症状就诊时已进展至中晚期,目前多采用以手术和放化疗为主的综合治疗方案,毒副作用较强[1-3]。阿霉素(doxorubicin,DOX)为蒽醌类高效广谱化疗药物,用于临床治疗各类恶性肿瘤,具有较大副作用,主要体现在心肌损伤,并伴随肌肉萎缩等不良症状,因此其临床应用受限[4-5]。由于近年来女性患者人数逐渐增多,年龄逐渐年轻化,新型辅助药物的开发显得越发重要。熊果酸(ursolic acid,UA),又称乌索酸、乌苏酸,为五环三萜类化合物,富含于苦丁茶中,苦丁茶老叶中熊果酸的平均含量为1.211%,嫩叶中熊果酸的平均含量为0.574%,具有广泛的生物学活性[6-8]。许多研究发现:熊果酸能够抑制肿瘤细胞增殖、诱导细胞凋亡,发挥抗肿瘤活性[9-11]。本研究通过将熊果酸与阿霉素联合使用,初步探讨其对宫颈癌HeLa 细胞增殖的影响,为熊果酸能否作为化疗辅助药物,减少阿霉素的使用剂量,以减轻抗癌药物的毒副作用提供依据。
1 材料与方法
1.1 材料
UA 和DOX 均购自北京索莱宝科技有限公司;宫颈癌HeLa 细胞购自云南省细胞工程有限公司。
1.2 方法
1.2.1 细胞培养
细胞培养使用含10%胎牛血清(购自Hyclone 公司)、1%青链霉素(北京索莱宝科技有限公司)的DMEM 高糖培养基(购自Hyclone 公司),于37 ℃、5% CO2恒温培养箱中进行培养。在倒置显微镜下观察细胞生长状态,待细胞长满培养皿80%~90%时,进行传代培养。
1.2.2 MTT 检测细胞存活率
将处于对数生长期的细胞以4×104个/mL的密度接种于96 孔板中,每孔200 μL,每组设5 个复孔,置于培养箱中进行贴壁培养。待细胞贴壁后,进行加药处理,DOX 质量浓度梯度为1、2、3、4、5、6、7、8 和9 mg/L;UA 浓度梯度为0、5、10、15 和20 μmol/L;联用试验组为2 mg/L DOX 分别与5、10、15 和20 μmol/L UA 联用。将细胞进行药物培养24 h,后加入MTT (购自上海碧云天生物技术有限公司),每孔16 μL,继续培养4 h,吸除培养基,每孔加入160 μL DMSO (购自北京索莱宝科技有限公司),使用酶标仪进行震板并在492 nm 处检测吸光值,计算细胞存活率,采用Prism 8.0 进行数据分析。
1.2.3 细胞形态学观察
将处于对数生长期的细胞以1.25×105个/mL的密度、每皿4 mL 的体积接种于60 mm 培养皿中,放置于37 ℃、5% CO2恒温培养箱中进行培养。待细胞贴壁后,进行4 h 饥饿处理,后加药处理,处理组分别为0 (CK)、20 μmol/L UA、2 mg/L DOX、5 mg/L DOX 和2 mg/L DOX+20 μmol/L UA。药物培养24 h 后吸除培养基,使用PBS 冲洗2 次,在倒置显微镜下进行观察。
1.2.4 Hoechest 染色
将处于对数生长期的细胞以1.25×105个/mL的密度接种于6 孔板中,每孔接种2 mL。待细胞贴壁后,进行4 h 饥饿处理,后加药处理,药物处理剂量同1.2.3 节。药物培养24 h 后吸除培养基,使用PBS 冲洗1 次,再加入1 mL培养基,并加入10 μL Hoechst 33342 活细胞染色液(100 ×)(购自上海碧云天生物技术有限公司)染色10 min,吸除培养基,用PBS 冲洗3 次,在倒置荧光显微镜下进行观察并拍照。
1.2.5 Western-blot 法检测HeLa 细胞凋亡相关蛋白的表达
将处于对数生长期的细胞以1×106个/mL的密度、每皿4 mL 的体积接种于60 mm 培养皿中。待细胞贴壁后,进行4 h 饥饿处理,后进行加药处理,培养12 h。收集处理后的各组细胞,用预冷的PBS (购自北京索莱宝科技有限公司)缓冲液洗细胞2 次,加入预冷的裂解液(购自上海美仑试剂有限公司) 100 μL 处理细胞,在冰上裂解30 min 后用4 ℃离心机14 000 r/min 高速离心15 min,收集上清液,进行BCA (购自上海碧云天生物技术有限公司) 蛋白定量检测。采用湿转膜法将目标蛋白转移至PVDF 膜上,使用TBST 进行洗涤,5% 脱脂奶粉封闭1 h,后铺一抗:Bax Antibody (购自Cell Signaling Technology)、Bcl-2 Antibody (购 自Cell Signaling Technology)、Caspase-3 Antibody (购自abcam)和Beta Tubulin Antibody (购自Cell Signaling Technology),置于4 ℃摇床上孵育过夜。后铺相应二抗室温孵育1 h,经TBST 溶液洗涤后,将曝光液(购自北京四正柏生物科技有限公司)均匀滴在PVDF 膜置上进行曝光,并使用ImageJ 软件对条带灰度值进行分析,采用Prism 8.0 进行数据分析。
1.2.6 统计学分析
数据采用SPSS 17.0 软件进行分析,单因素分析采用AVONA 进行数据处理,图像处理采用imageJ,P<0.05 为差异具有统计学意义。
2 结果与分析
2.1 UA 与DOX 单独使用对HeLa 细胞存活率的影响
当UA 浓度为5 μmol/L 时,HeLa 细胞存活率与对照组不存在显著差异(图1);当UA 浓度增加至10 μmol/L 以后,细胞存活率极显著低于对照组(P<0.01),抑制效果增强;当UA 浓度为20 μmol/L 时,细胞存活率最低,抑制效果最为显著。当DOX 质量浓度为1~3 mg/L 时,HeLa 细胞存活率与对照组相比显著降低(P<0.01);当DOX 质量浓度为3~8 mg/L 时,虽然与对照组相比显著降低(P<0.01),但处理组之间不存在显著差异。

图1 UA 与DOX 单独使用对HeLa 细胞存活率的影响)Fig.1 The effects of UA and DOX uesed alone on the survive rate of HeLa cells
2.2 UA 与DOX 联用对HeLa 细胞存活率的影响
选取5、10、15、20 μmol/L UA 分别与2 mg/L DOX 进行联用,由图2 可知:4 组不同浓度的UA 和2 mg/L DOX 联用分别与2 mg/L DOX 单独使用相比,细胞存活率均极显著降低(P<0.01),且4 个联用组的细胞存活率均极显著低于5 mg/L DOX 单独使用;5、10、15 μmol/L UA 与2 mg/L DOX 的3 组联用分别与相应的3 个不同浓度的UA 单独使用相比,细胞存活率均极显著降低(P<0.01),而20 μmol/L UA 和2 mg/L DOX 联用与20 μmol/L UA 相比,细胞存活率不存在显著差异,但显著低于15 μmol/L UA 单独使用,达到UA 与DOX 联用作用效果最高剂量。
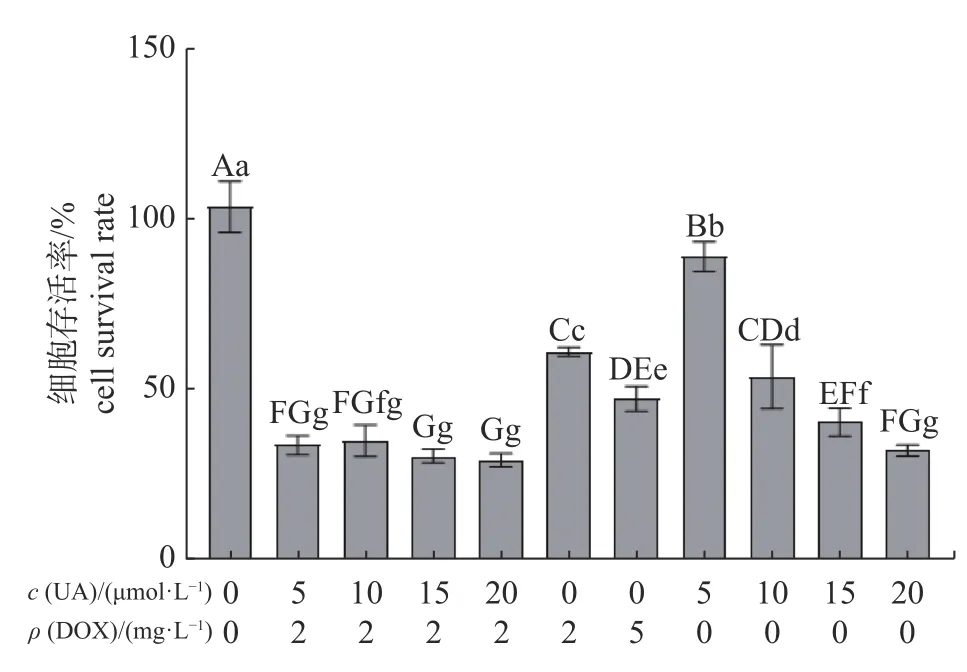
图2 UA 和DOX 联用对HeLa 细胞存活率的影响)Fig.2 The effect of the combination of UA and DOX on the survival rate of HeLa cells
2.3 UA 与DOX 联用细胞形态学观察
细胞具有表面结构和自身表面张力,以及受到外界的机械压力,能够保持一定的形态。细胞形态学观察发现(图3):经20 μmol/L UA 和2 mg/L DOX 单独给药处理的HeLa 细胞的形态由梭状转变为不规则形状,细胞密度降低、细胞分离数增加;经5 mg/L DOX 单独处理的HeLa 细胞形态明显皱缩,由梭状变为圆形,细胞密度明显降低;联用组(20 μmol/ UA+2 mg/L DOX)处理的HeLa 细胞形态变化最为明显,由梭状变为圆形,而细胞密度变化不太明显。

图3 HeLa 细胞形态)Fig.3 Cell morphology of HeLa
2.4 UA 与DOX 联用细胞凋亡观察
Hoechst 是一种可穿透细胞膜的蓝色荧光探针,常用细胞凋亡检测。在荧光显微镜下,活细胞核呈现弥散均匀荧光;出现细胞凋亡时,细胞核或细胞质可见浓染致密的颗粒块状荧光。如图4 所示:联用组(20 μmol/L UA+2 mg/L DOX)给药处理的HeLa 细胞出现较强的浓染致密的颗粒块状荧光(红色圆圈所示)。因此,联用组细胞凋亡数量高于单独用药组。

图4 Hoechest 染色)Fig.4 Staining of Hoechest
2.5 HeLa 细胞促凋亡相关蛋白的表达
相关促凋亡蛋白的表达结果如图5 所示:对于Cleaved caspase-3 蛋白表达量,联合用药组(20 μmol/L UA +2 mg/L DOX)显著高于20 μmol/L UA 单独使用(P<0.05),但与2 mg/L DOX 相比,没有显著差异;联用组Bax/Bcl-2 表达量分别与20 μmol/L UA 和2 mg/L DOX 单独使用相比,也没有显著差异。
3 讨论
本研究MTT 结果显示:熊果酸可显著降低HeLa 细胞的活性,与阿霉素联用效果高于2 种药物单独使用效果,且高于较高质量浓度的阿霉素单独使用效果,这发挥了熊果酸抑制肿瘤细胞增殖和诱导细胞凋亡的作用[10]。
在细胞形态学中,二者联用对细胞形态的影响较为明显;细胞凋亡观察结果中发现:出现较强的浓染致密的颗粒块状荧光,即凋亡细胞数较多。此外,有研究表明:经熊果酸可诱导人乳腺癌细胞凋亡,导致核固缩,细胞核呈致密浓染的颗粒块状荧光[12],该结果与本试验结果一致。
关于促凋亡蛋白,半胱天冬蛋白酶Caspase-3是细胞凋亡的级联反应途径中的执行者,在Caspase 家族介导的凋亡通路中,级联反应最终聚集于此,并将刺激信号往下传导,可与大量的蛋白因子共同调控细胞凋亡,具有不可逆作用[13]。Caspase-3 活化可导致细胞凋亡进入不可逆阶段,最终使得核小体间DNA 降解,细胞发生凋亡[13-15];B 细胞淋巴瘤/白血病-2 基因即Bcl-2基因是一种原癌基因,它具有抗凋亡作用。Bax是Bcl-2 家族中的促凋亡蛋白,具有促进细胞凋亡的功能,在通过线粒体应激诱导的细胞凋亡中起关键作用,是细胞凋亡内源性线粒体途径的重要调节因子,通常以二者比值判断细胞凋亡状态。有研究表明:线粒体跨膜电位的改变预示细胞可能出现凋亡[16]。熊果酸可保护心脏免受阿霉素引起的伤害,其通过增加AKT 磷酸化水平和增强内皮型一氧化氮合酶(eNOS)的表达,同时抑制阿霉素诱导的eNOS 通过NADPH 氧化酶4 (NOX4)下调解偶联[17]。本试验结果提示:二者联用可达到减少阿霉素毒副作用的效果。有研究表明:高剂量熊果酸(50 mg/kg)可以降低阿霉素肾病小鼠的尿蛋白,抑制肾小管间质TGF-β1 蛋白的表达,减轻阿霉素的毒副作用[18]。Western-blot 结果显示:Cleaved caspase-3 蛋白含量(图5)联用组低于高剂量阿霉素组,与熊果酸单独用药组存在差异性(P<0.05),但与低剂量阿霉素组不存在差异性,这可能与熊果酸的给药剂量有关。相关研究显示:20~50 μmol/L 熊果酸作用于HuH7 肝癌细胞8 h 后,能呈剂量依赖性地下调凋亡相关蛋白(XIAP) 的表达量[19]。而Bax 蛋白含量不存在差异性,可能是进行了细胞核凋亡途径,此外,还可能与药物作用时间、给药浓度以及相关凋亡通路有关,具体作用机制还有待深入研究。
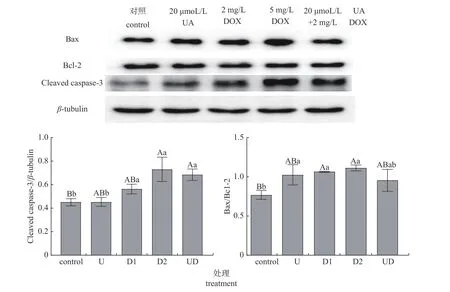
图5 促凋亡蛋白的表达量)Fig.5 Levels of proteins associating with apoptosis
4 结论
MTT 结果显示:熊果酸与阿霉素联用效果高于2 种药物单独使用效果;联用效果在细胞形态学结果中变化最为明显,由梭状变为圆形,且在荧光染色中出现较强的浓染致密的颗粒块状荧光,细胞凋亡较多。而根据相关细胞凋亡蛋白Cleaved caspase-3、Bax/Bcl-2 的表达量结果显示:二者联用的作用机制可能是进行了细胞核凋亡途径,具体机制仍需探究。因此,二者在一定程度上减少阿霉素的使用剂量,增强阿霉素对宫颈癌HeLa 细胞的治疗作用。
