利用病毒诱导的基因沉默技术沉默TSWV的NSm基因*
2021-09-01张萍萍李慧芳张美玲李永忠刘雅婷
张萍萍,桂 敏,李慧芳,张美玲,李永忠 ,刘雅婷
(1.云南农业大学 农学与生物技术学院,云南 昆明 650201;2.云南农业大学 植物保护学院,云南 昆明 650201;3.云南农业大学 烟草学院,云南 昆明 650201)
植物病毒病是当前农业生产中最严重的病害之一,几乎涉及所有的经济作物种类,目前侵染植物的病毒超过1 400 种[1],植物病毒所造成的植物病害每年造成的经济损失估计超过300 亿美元,它们在导致新发和再发植物病害的病原体中占50%[2]。番茄斑萎病毒(Tomato spotted wilt orthotospovirus,TSWV)为正番茄斑萎病毒属(Orthotospovirus)的代表种,属于布尼亚病毒目(Bunyavirales)番茄斑萎病毒科(Tospoviridae)。2011年,TSWV 被列为世界十大植物病毒之一,仅次于烟草花叶病毒(Tobacco mosaic virus,TMV),位居第二位[3],可以侵染超过70 个植物科的650多种植物[4]。TSWV可以在昆虫媒介蓟马体内复制[5-6],并且主要通过蓟马的活动在植物间传播[7]。
病毒诱导的基因沉默(virus-induced gene silencing,VIGS)早期是发现于转入病毒基因的植物产生对其他病毒具有抗性的现象[8-9]。近年来,VIGS 已专门用于指通过构建重组病毒载体来沉默植物内源基因的反向遗传学技术[10-11],其作用原理是通过携带目的片段的病毒载体侵入植物细胞后,会先形成双链RNA,之后会被特异性核酸内切酶进行切割,形成大约21~24 nt 小分子干扰RNA,之后RNA 聚合酶进一步扩增siRNA,其与一些蛋白质结合形成RNA 诱导沉默复合体,之后会与互补的同源RNA 进行配对,随后同源RNA 被剪切[12]。VIGS 操作简单,对实验室的设备要求低,不像传统的转基因手段需要植物组织培养,传代纯合后才能进行深入的基因功能分析,其发生在RNA 转录后,不需要遗传转化,因此大大缩短了植物生长发育相关调控基因功能验证所需要的时间[13-14]。目前已有大量VIGS 载体应用于多种植物,并且可以实现对植物各个组织的基因沉默[15-17]。虽然新的基因编辑技术TALEN[18]以及CRISPR-Cas9[19]已相继推出,但VIGS 技术快速简单的优势决定其在生物研究领域还会继续发挥作用。烟草脆裂病毒(Tobacco rattle virus,TRV)介导的VIGS 基因沉默体系与其他病毒载体相比对寄主影响更小,可以在包括植株生长点和分生组织的多个组织器官内扩散[20],宿主范围广,已广泛应用于茄科植物研究中[21]。TRV 介导的VIGS 体系是将TRV 的基因组RNA1 和RNA2分别构入2 个载体骨架中,沉默载体构建只需将目的基因片段插入RNA2 链上的多克隆酶切位点区[22-23]。八氢番茄红素脱氢酶(phytoene desaturae,PDS)是类胡萝卜素合成途径中的一个关键酶,该基因沉默后,叶片出现白化症状,通常在VIGS 实验中作为报告基因[24-26]。
NSm 蛋白是由TSWV 的M RNA 链正向编码的运动蛋白,分子量为33.8 ku。早期的定位研究发现:NSm 蛋白定位于叶片的细胞壁、细胞膜以及胞间连丝,而在昆虫体内主要集中在各个细胞器的膜结构上和细胞质中的纤维状聚集体上[27-28],之后LEWANDOWSKI 等[29]证实NSm 是TSWV的运动蛋白,涉及病毒在植物细胞间的长距离运动,2015 年LEASTRO 等[30]证明TSWV 的NSm蛋白可以和N 蛋白相互作用形成二聚体,这种相互作用不仅是TSWV 长距离运动的关键,还会影响病毒的生命周期。
本研究通过构建靶向TSWV 的NSm基因的沉默载体pTRV2-NSm,注射辣椒(Capsicum annuumL.)后接种TSWV,辣椒表型显示注射pTRV2-NSm沉默载体的植株新叶无症状;qRT-PCR 分析结果显示:TRV 介导的VIGS 沉默体系对TSWV的NSm基因确实起到了沉默作用,且沉默效果很好。本研究旨在为VIGS 技术在植物病毒防控中的应用奠定基础。
1 材料与方法
1.1 试验材料
本试验植物寄主为辣椒(C.annuumL.) (湘研十一号),TSWV (TSWV-YN)毒源是在本氏烟(Nicotiana benthamiana)上进行传代培育;VIGS体系所用的病毒载体pTRV1 和pTRV2 均由云南农业大学植物保护学院陈小姣老师惠赠。
1.2 辣椒叶片总RNA 提取及目的基因片段扩增
用TRNzoL-A+总RNA 提取试剂(天根生化科技有限公司,北京)提取采集叶片样品的总RNA;选用HiScript Ⅱ 1st strand cDNA Synthesis Kit (诺唯赞生物科技有限公司,南京)对上述得到的RNA样品进行反转录获得cDNA。根据NCBI 中TSWV的NSm基因序列(GenBank 登录号:JF 960236.1)和辣椒的PDS基因序列(GenBank 登录号:X68 058)设计引物,本试验选取的插入片段为NSm基因的107~426 bp 和PDS基因的815~1 144 bp,片段上、下游分别加入酶切位点EcoRI 和KpnI,目的片段扩增引物序列见表1,并根据NCBI上TRV2 序列的注释信息(GenBank 登录号:Z36974)合成上游引物 pTRV2-F:TGGGAGATGATACGCTGTT。
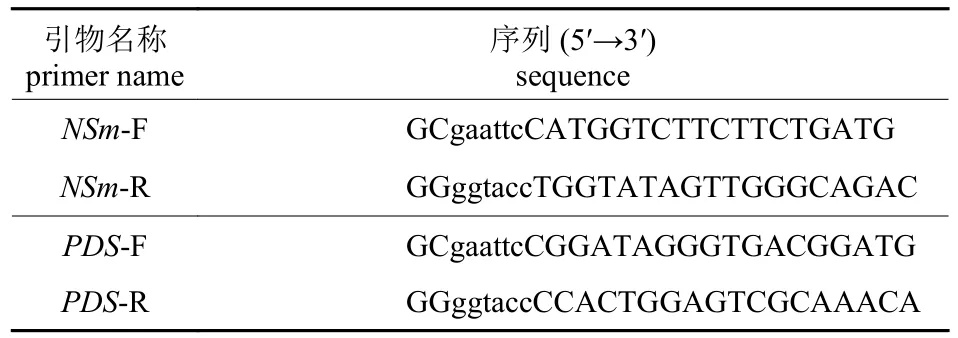
表1 目的片段扩增引物Tab.1 Primers for amplification of target fragments
使用Prime STAR Max Premix (2×)高保真酶(宝日医生物技术有限公司,北京)扩增目的片段,PCR 反应体系为:Prime STAR Max Premix (2×) 25 μL,正向引物和反向引物各2.5 μL,cDNA 2.5 μL,补充ddH2O 总体积至50 μL。PCR 反应条件:98 ℃预变性20 s,98 ℃变性10 s,50 ℃退火10 s,72 ℃延伸30 s,35 个循环;最后72 ℃延伸10 min。PCR 产物用1.2%琼脂糖凝胶电泳检测。
1.3 VIGS 重组载体的构建
TSWV 的NSm基因片段扩增回收产物、辣椒的PDS基因片段扩增回收产物和pTRV2-00,同时采用限制性内切酶EcoRI 和KpnI 进行双酶切,将酶切产物分别回收,用T4 DNA 连接酶在16 ℃下反应4 h,采用热激转化将连接产物转入大肠杆菌感受态细胞DH5α (擎科新业生物技术有限公司,北京)。PCR 筛选阳性单克隆进行测序验证(生工生物工程有限公司,上海),序列正确的载体即为VIGS 所需的重组沉默载体pTRV2-PDS和pTRV2-NSm。
1.4 农杆菌注射及TSWV 接种
将沉默载体pTRV2-PDS和pTRV2-NSm通过热激法转化农杆菌GV3101 感受态细胞,在卡那霉素(50 μg/mL)和利福平(25 μg/mL)抗性条件下筛选转化子,PCR 鉴定呈阳性的克隆菌液即为本试验所需的农杆菌单克隆。
得到VIGS 所需的携带有TRV 重组载体的农杆菌后,在带有抗性的YEB 培养基中培养至OD600约为0.6 (需2~3 d),取等体积转入pTRV1的农杆菌重悬液分别与带有pTRV2-00、pTRV2-PDS以及pTRV2-NSm的农杆菌重悬液进行混合。在辣椒的4 叶期进行农杆菌叶背注射。为验证VIGS 沉默体系设计如下试验:一组辣椒注射带有pTRV2-00 载体的混合菌液,另一组辣椒注射带有pTRV2-PDS载体的混合菌液,还有一组辣椒不做任何处理。7 d 后开始观察辣椒植株情况并拍照记录。
为验证VIGS 体系是否能在辣椒中沉默TSWV的NSm基因并使辣椒产生抗性,设计对比试验:一组辣椒注射带有pTRV2-00 的混合菌液,另一组辣椒注射带有pTRV2-NSm载体的混合菌液。4 d 后摩擦接种TSWV,7 d 后开始观察辣椒植株情况并拍照记录。
1.5 TSWV NSm 基因的沉默效果检测
运用qRT-PCR 技术检测接种TSWV 病毒22 d后新叶(接近生长点)中NSm的表达量。对照组为注射带有pTRV2-00 辣椒植株,重复4 次。将采集的样本分别提取总RNA 并反转录得到cDNA。以辣椒的cDNA 为模板,对NSm基因的表达量进行qRT-PCR 检测,qRT-PCR 采用SYBR®Premix ExTaq™ II (Tli RNaseH Plus)试剂盒(宝日医生物技术有限公司,北京),使用辣椒的Actin基因(GenBank 登录号:GQ339766.1)做内参,设置3 个重复,用2-ΔΔCt法计算基因相对表达量。因为处理组的辣椒中转入了NSm基因的107~426 bp片段,设计qRT-PCR 引物扩增片段避开了这一区域,具体qRT-PCR 引物见表2。qRT-PCR 反应体系为:SYBR Premix ExTaqII (2×)加入10 μL,前引物(10 μmol/L)以及后引物(10 μmol/L)各加1 μL,cDNA 模板2 μL,加入0.4 μL 的ROX Reference Dye II (50×)进行仪器校正,最后加ddH2O总体积至20 μL。qRT-PCR 反应程序如下:95 ℃30 s,之后95 ℃ 3 s,以及60 ℃ 30 s,循环次数设为40。统计结果经SPSS 17.0 分析软件进行分析,试验组与对照组比较采用独立样本t检验。
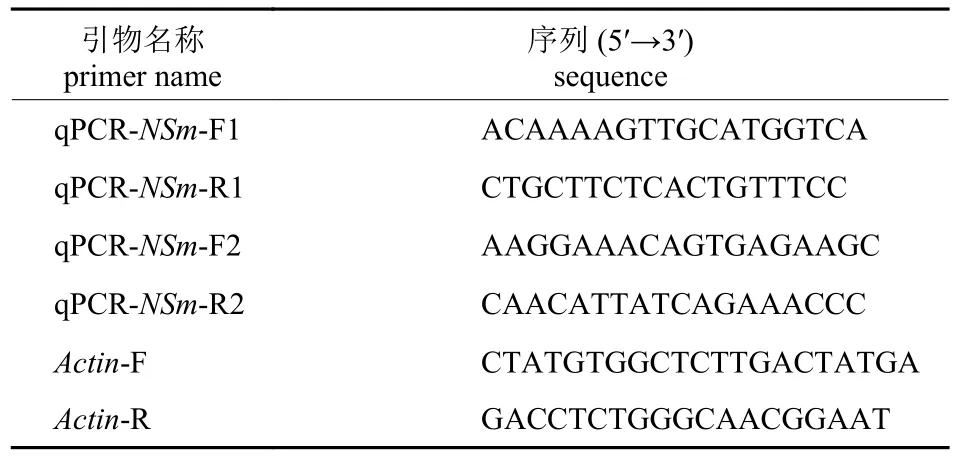
表2 实时荧光定量引物Tab.2 Primers for qRT-PCR
2 结果与分析
2.1 辣椒总RNA 的提取
采样后提取样品的总RNA,并采用1.2%的琼脂糖凝胶电泳检测。由图1 所示:可以观察到3 条明亮的条带(从上至下依次为28S、18S、5S),说明提取的RNA 完整性很好,可进行后续反转录试验。
图1 辣椒总RNA)Fig.1 Total RNAs of pepper
2.2 VIGS 重组载体的构建
本试验共需构建2 个VIGS 重组载体。靶向辣椒PDS基因的沉默载体pTRV2-PDS以及靶向TSWVNSm基因的沉默载体pTRV2-NSm。扩增的PDS片段长度为330 bp,NSm片段长度为320 bp。PCR 结果显示:2 个重复都扩增出单一条带,并且条带大小与预测相符(图2a);NSm目标片段扩增电泳条带大小与预测相符,并且阴性对照没有扩增出条带(图2b)。说明PDS和NSm2 个目标片段都扩增成功。
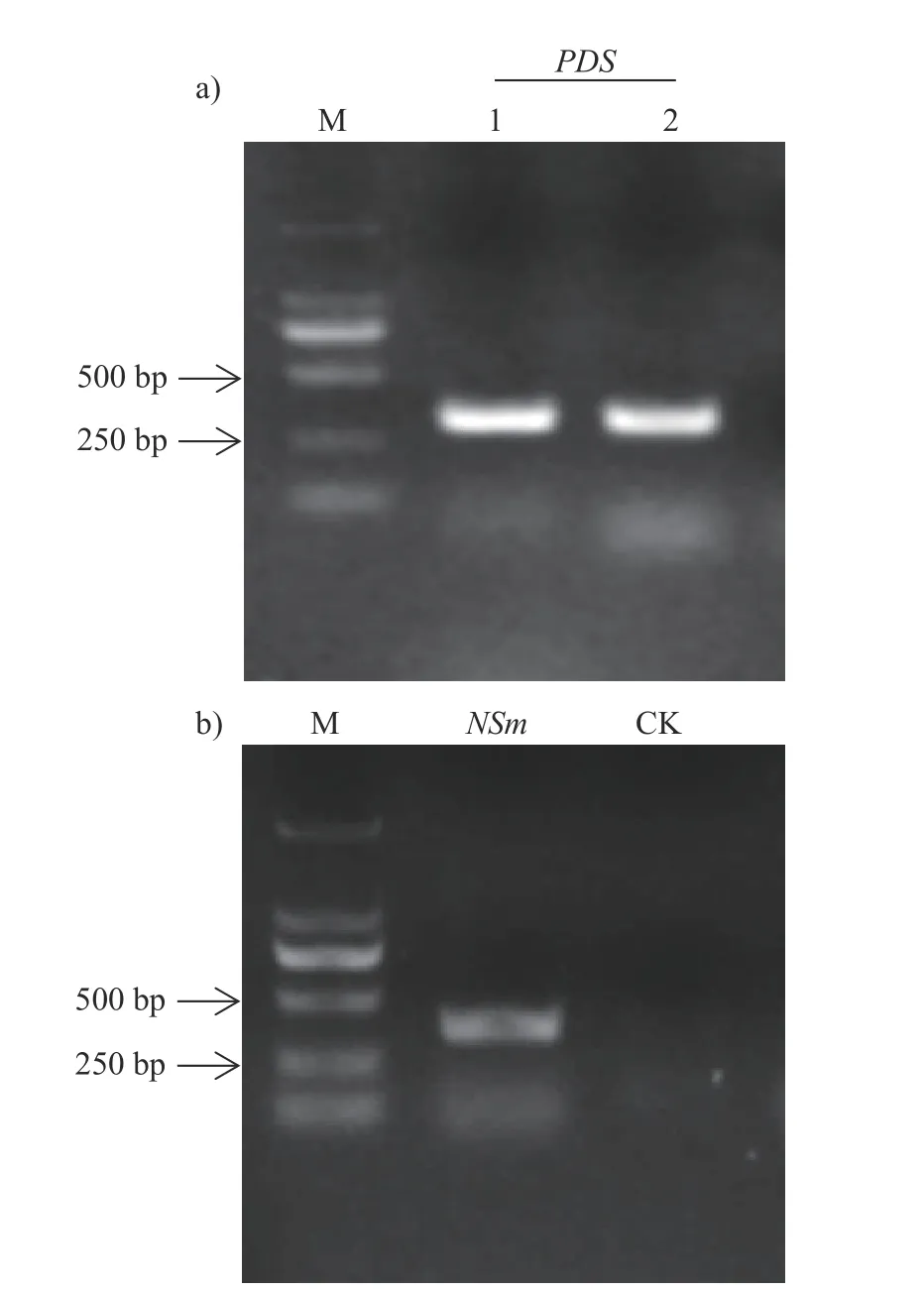
图2 目标片段扩增)Fig.2 PCR of target fragments
2 个目标片段PCR 产物电泳切胶回收后用限制性内切酶EcoRI 和KpnI 进行双酶切,同时pTRV2 也用EcoRI 和KpnI 进行双酶切,酶切后的2 个目标片段分别与酶切好的pTRV2 病毒载体用T4 DNA 连接酶连接,转化大肠杆菌后进行PCR 检测,PCR 所用的引物为pTRV2-F 和插入的目标片段的扩增后引物。pTRV2-PDS扩增片段为505 bp,pTRV2-NSm扩增片段为495 bp。电泳结果(图3)显示扩增出的单一条带大小均与预期相符。将pTRV2-PDS载体的2#、3#和4#单克隆与pTRV2-NSm载体的1#、2#和3#单克隆进行测序(生工生物工程有限公司,上海),测序引物为pTRV2-F,测序结果显示:2 个载体的3 个单克隆峰图单一且序列完全正确,说明载体pTRV2-PDS和pTRV2-NSm均构建成功。
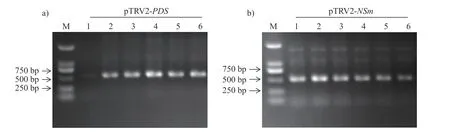
图3 重组载体菌液PCR 验证)Fig.3 PCR identification of reconstructed vectors
2.3 VIGS 对辣椒PDS 基因沉默的有效性验证
由图4 所示:本研究用注射携带pTRV2-00 载体农杆菌的辣椒植株,培养22 d 后与未处理植株相比无明显症状,说明注射pTRV2-00载体对辣椒的生长没有产生影响;而注射携带有PDS沉默载体的辣椒植株,约22 d 时植株叶片出现光漂白现象,最开始出现在叶脉处,随着植株的生长,白化现象逐步扩展到整个叶片,随着接种沉默载体时间的延长新叶全部白化,说明病毒载体成功侵入辣椒体内,并沉默了辣椒的PDS基因,使叶片白化但对植株发育无明显影响。

图4 注射TRV 载体后的辣椒表型)Fig.4 Phenotype of pepper inoculated with TRV vectors
2.4 辣椒注射沉默载体pTRV2-NSm 后对TSWV抗性表型评估
由图5 所示:注射pTRV2-00 载体和pTRV2-NSm沉默载体的辣椒植株在22 d 时出现了明显的表型差异,先注射pTRV2-00 载体后接种TSWV辣椒植株的新叶及老叶都出现黄化斑,而先注射沉默载体pTRV2-NSm后接种TSWV 的辣椒植株的新叶无症状,老叶只在叶边缘出现黄化斑。说明注射沉默载体pTRV2-NSm的辣椒植株对TSWV 表现出一定的抗性。

图5 注射TRV 沉默载体后接种TSWV 的辣椒植株表型)Fig.5 Phenotype of peppers inoculated with TSWV after injection with TRV vectors
2.5 沉默载体pTRV2-NSm 对TSWV NSm 基因的沉默效果
利用qRT-PCR 技术检测注射了沉默载体pTRV2-NSm的辣椒植株对TSWVNSm基因的沉默效果,结果(图6)表明:注射了沉默载体pTRV2-NSm的辣椒在接种TSWV 后与对照组相比,NSm的表达量仅为对照组的4.6%±5.3% (mean±SD),具有极显著差异(P<0.001)。结果表明:沉默载体pTRV2-NSm在辣椒上能够高效沉默TSWV 的NSm基因。
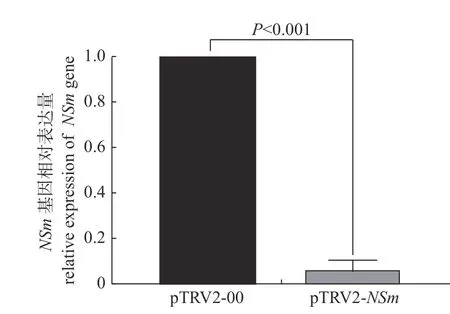
图6 沉默植株中NSm 基因的相对表达量)Fig.6 The relative expression of gene NSm in silenced peppers
3 讨论
目前,防控植物病毒病的方法很多,但都存在一些缺点。如传统的田间管理费时耗力,在小农经济中比较实用,不易大面积推广;化学制剂往往使用不易降解的化学物质,存在化学物质的残留以及污染的风险[31];生物来源抗毒物质仍处于试验阶段,生产应用中少有推广;选育抗性品种就是筛选抗性基因培育优良品种,目前筛选抗性基因仍十分困难,针对TSWV 的抗性基因只有辣椒(C.chinense,PI 152225 line)的Tsw基因和番茄(Lycopersicon esculentum,89R line)的Sw-5基因[32-33],对于更多植物病毒这种方法显得不够高效;转基因手段能快速获得性状优良的抗性品种,目前转基因技术已非常成熟,转入的病毒基因片段可以使植株得到相应的抗性,但转基因手段存在基因漂移的风险,插入1 个外源片段对于物种在进化上的作用来说短时间内无法进行评估,同时转基因技术中的伦理道德问题也引发人们的关注,因此对转基因作物应持谨慎态度[34-35]。VIGS 的优势由此得以体现。首先,VIGS 是一种不遗传的基因沉默技术;其次,VIGS 导入的不是基因全序列而是小片段,避免基因表达对植株的影响;第三,VIGS 体系的基因沉默周期短[36]。因此,将VIGS 应用于植物病毒防控具有广泛前景。
本研究通过VIGS 体系来沉默TSWV 的NSm基因,验证了沉默载体pTRV2-PDS对辣椒PDS基因的沉默效果,辣椒叶片在接种沉默载体22 d后开始出现光漂白现象,漂白首先出现在新叶附近叶片的叶脉,后逐步扩张到整个叶片,几天后长出的新叶全部白化。
本研究表明:先注射pTRV2-00 载体4 d 后接种TSWV 的辣椒植株的新叶以及老叶均出现黄化斑;而先注射沉默载体pTRV2-NSm后接种TSWV 的辣椒植株新叶无症状,只在老叶的叶尖部位出现黄化斑,病斑分布与沉默了PDS基因辣椒的白化区域互补,可能是由于TRV 介导的VIGS体系在靠近生长点的位置沉默效果最好[20],导致靠近这个位置的白化最明显,辣椒也是在这一区域表现为无病症。qRT-PCR 结果显示:沉默载体pTRV2-NSm能够高效沉默TSWV 的NSm基因。虽检测到有少量的NSm表达,但新叶无症状,可能是由于虽然有少量NSm 蛋白协助TSWV进行长距离运动,但是TSWV 的积累量较少,因此叶片无症状。在注射pTRV2-NSm沉默载体4 d 后接种TSWV,虽新叶无症状但老叶有症状,可能是由于VIGS 沉默体系起作用需要一定的时间,间隔接种的时间不同,达到的沉默效果也会不同。之前用于植物病毒防控的基因沉默大都是针对植物内源基因[37]或病毒的结构蛋白[38],而本研究的沉默载体靶向非结构蛋白基因NSm,接种沉默载体后辣椒对TSWV 具有抗性,说明非结构蛋白基因也可作为防控病毒的靶基因。
通过TRV 介导的VIGS 体系沉默了TSWV的NSm基因,而如何达到更好的防治效果需要进一步的试验验证,例如VIGS 与病毒接种所需的间隔时间以及TSWV 基因片段的选择。本研究还验证:利用NSm的107~426 bp 片段插入TRV 载体对NSm基因沉默可以起到一定的抗TSWV 效果,使得通过基因沉默培育抗性品种过程中筛选目标基因以及插入片段过程变得更加简便。研究者们可以先通过VIGS 快速筛选出最合适的基因片段,然后构建转基因抗性植株。
4 结论
本研究构建了pTRV2-NSm载体,注射带有pTRV2-NSm农杆菌的辣椒可以高效沉默TSWV的NSm基因,进而抑制TSWV 在辣椒上的传播,使辣椒对TSWV 产生一定的抗性。
