添加解磷菌剂的生物炭对冬马铃薯磷吸收和土壤细菌群落组成的影响*
2021-09-01强茹茹达布希拉图
强茹茹,曾 捷,达布希拉图
(1.云南农业大学 资源与环境学院,云南 昆明 650201;2.云南磷化集团,国家磷资源开发利用工程技术研究中心,云南 昆明 650607)
磷是植物必需的营养素之一[1]。磷尾矿中含有很多作物生长所需的矿质元素,将磷矿粉作为磷源已有多年的历史[2]。但磷尾矿综合利用率低,且传统的磷提取方法存在成本高和无法被植物直接吸收等问题[3]。目前,利用解磷微生物(phosphate-solubilizing microorganism,PSM)可以分解出磷矿粉中的磷,也可以把土壤中难溶性或不溶性磷酸盐转化为速效磷形态,以供植物生长所需[4-5]。生物炭作为一种性质独特的材料,其丰富的孔隙结构及对水肥有吸附作用[6],可直接为土壤微生物提供良好的庇护所和生长所需养分[7]。大量研究表明:生物炭不仅能通过改变微生物群落结构来影响土壤磷素转化[8],还可以通过抑制土壤中速效磷与其他离子结合来提高土壤有效磷含量[9-14]。蔡越桐[15]研究表明:单施生物炭或解磷菌均可促进土壤磷素活化,且添加3%的生物炭+解磷菌更能加快土壤磷素活化速率。赵毅珺等[16]发现:每盆增施50.1 g 生物炭并配施10 mL 解磷菌剂对苜蓿土壤养分、酶活性、产量及营养元素吸收量效果最好。马梅荣等[17]研究表明:麦麸和锯末可以在较长时间保持较高的吸菌量,可为微生物提供充足的营养成分;其极好的吸水性使载体疏松,更适合微生物生长繁殖。
目前,大多研究集中在从磷尾矿中或富含磷尾矿的土壤中筛选高效解磷微生物,分析其对土壤中磷素和微生物群落组成的影响。而筛选出的解磷微生物能否被高效利用、在土壤环境中是否可以存活甚至优势我们认为与土壤环境中的炭组成关系密切。因此,本研究选用从土壤中分离筛选的3 株解磷能力较强的解磷菌,制成混合菌剂,通过田间试验,研究生物炭和解磷菌剂对马铃薯植株的生长、土壤中磷素的活化效果及植株对磷素吸收利用的影响,并进一步探讨生物炭对解磷菌剂的作用,旨在为提高磷素利用率及磷尾矿资源的利用提供科学依据。
1 材料与方法
1.1 试验地概况及供试品种
田间试验在云南省德宏州芒市风平镇帕底村(N24°05′~24°39′,E98°05′~98°44′)进 行,海拔916 m,年平均气温17 ℃,年降水量2 100 mm。试验地前茬作物为水稻。供试品种为马铃薯丽薯6 号。
1.2 供试土壤
试验布置前每个小区按五点采样法采样,用土钻取0~20 cm 耕层土壤混合带回实验室自然风干并过20 目和100 目筛,保存备用。参照《土壤农化分析》[18]测定其基本理化性质为:pH 5.94,有机质含量21.85 g/kg,碱解氮含量80.13 mg/kg,速效磷含量22.45 mg/kg,速效钾含量158.91 mg/kg。
1.3 试验材料
生物炭(原材料为小麦秸秆,500 ℃高温厌氧条件下热解4 h)由南京勤丰秸秆科技有限公司提供;磷尾矿为晋宁磷尾库的擦洗尾矿,将其粉碎至0.5~1.0 cm 颗粒,速效磷用质量分数为30%的工业级盐酸酸解提取,P2O5净出率在96%以上;麦麸和锯末(混合木)作为一个整体,为优化接种解磷微生物的有机物料,由云南磷化集团有限公司磷资源开发利用工程技术研究分公司提供。各材料基本性质见表1。

表1 试验材料基本性质Tab.1 Basic properties of the tested materials
本课题组于云南山原红壤中分离筛选得到3 株高效解磷菌株,解磷量为47.08~83.86 mg/L。菌株间无拮抗反应,可以进行菌株复配(菌株鉴定与试验高通量测序一并进行)。委托云南省微生物发酵工程研究中心培养菌液,制成3 株菌株的混合解磷菌剂,其活菌密度为108CFU/mL 量级菌液。
1.4 试验设计
田间试验采用随机区组排列,每个处理3 次重复,共12 个试验小区,每个小区面积为7 m×7 m。设置4 个处理:以(麦麸+锯末)+磷尾矿为对照(CK),分别添加生物炭(WB)、解磷菌剂(WP)以及生物炭和解磷菌剂配施(WBP) (表2)。
试验于2017 年12 月12 日播种,2018 年4 月16 日收获。马铃薯生长所需的氮肥为尿素(N 151.73 kg/hm2),钾肥为硫酸钾(K2O 119.52 kg/hm2),将上述氮肥和钾肥总量的2/3 基施,剩余1/3 分别于2018 年1 月22 日和2 月10 日等量追施完成;以磷尾矿为磷肥,设置每100 g 土施用0.5 g 的生物炭,将二者与麦麸和锯末一次性施入,并与20 cm 耕层土翻耕均匀。解磷菌液以1∶50 稀释,将其喷洒在WP 和WBP 处理中的固体基料(麦麸和锯末)上,使其湿润;其余处理喷施等量水。试验期间2018 年1 月11 日喷施代锌锰森预防早疫病,7 d 后再喷施1 次;2 月10 日喷施百泰,进行病虫害防治。马铃薯生育过程中,各处理田间管理保持一致。
1.5 样品采集
分别于马铃薯生长的苗期、开花期、现蕾期和收获期采集植株和土壤样品。
植株:每个试验小区随机取具有代表性的5 株植株,将整株带回实验室,用自来水冲洗干净,晾干,将地上部、根(包括匍匐茎和根系)和块茎等器官分离包装,于105 ℃杀青30 min,75 ℃烘至恒质量,用于全磷的测定。
土壤:在每个试验小区按五点取样法采集表层土(0~20 cm),拣去石头和植物残茬后置于自封袋中,准确标记,带回实验室后自然风干并过筛,用于速效磷的测定。将WP 和WBP 处理苗期和收获期的土壤样品取出一半分别放于无菌封口袋中,准确标记,保存于放有冰袋的保温箱中,带回试验后立即存于-80 ℃冰箱中,用于16S rRNA (细菌)测序。将委托于云南省微生物发酵工程研究中心培养制成的3 株菌株的混合解磷菌剂(DB4 处理)同样用于16S rRNA (细菌)测序。
1.6 指标测定
土壤速效磷含量采用0.5 mol/L NaHCO3浸提—钼锑抗比色法测定,植株全磷含量采用浓H2SO4—H2O2消煮—钒钼黄比色法测定。具体方法步骤参照《土壤农化分析》[18]。
采用以下公式对指标进行计算:
磷素累积吸收量=各器官干物质积累量×磷含量×100%;
磷分配率=各器官磷素累积量/马铃薯全株磷累积量×100%。
1.7 土壤DNA 的提取与高通量测序
1.7.1 基因组 DNA 的提取
采用 MO BIO 强力土壤DNA 提取试剂盒(MO BIO Laboratories,Carlsbad,CA,USA)[19-20]。对样本的基因组 DNA 进行提取,之后利用琼脂糖凝胶电泳和Nanodrop 检测 DNA 的纯度和含量,取适量的样品于离心管中,使用无菌水稀释样品至10 ng/μL,于-40 ℃冰箱保存备用。
1.7.2 PCR 扩增
以稀释后的基因组 DNA 为模板,根据测序区域的选择,使用带 Barcode 的特异引物和高效高保真的酶(TAKARA,大连)进行PCR,确保扩增效率和准确性。引物对应区域:细菌16S V4区引物515F (5′-GTGCCAGCMGCCGCGGTAA-3′)和909R (5′-CCCCGYCAATTCMTTTRAGT-3′)。
1.7.3 PCR 产物纯化和定量
PCR 产物使用1%的琼脂糖凝胶进行电泳检测。根据PCR 产物质量浓度进行等量混样,充分混匀后使用1%的琼脂糖凝胶电泳检测PCR 产物,对目的条带使用生工公司提供的胶回收试剂盒(Sangon Biotech,China,Cat# SK8132)回收产物,并用Nanodrop 进行含量和质量的测定、文库构建和上机测序:使用TruSeq®DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,构建好的文库经过Qubit 和qPCR 定量,文库合格后,使用v2 测序试剂盒 (2×250 bp)和Miseq 测序仪进行上机测序。
1.8 统计分析方法
试验数据均用Microsoft Excel 2010 进行处理和制图,SPSS 18.0 软件进行方差分析,利用Qiime软件(Version 1.9.0)计算α 多样性指数(Chao1 指数、Shannon 指数和Simpson 指数),用Origin 软件绘制稀释曲线。
2 结果与分析
2.1 生物炭和解磷菌对冬马铃薯植株干物质积累量的影响
由表3 可知:在整个生育期内,各处理马铃薯地上部积累量呈先增加后减少的趋势,在盛花期达到最大值,且生物炭(WB)、解磷菌(WP)和生物炭+解磷菌(WBP)处理的干物质积累量均显著高于对照(CK),增幅分别为44.57%、32.14%和60.56%,WBP 处理效果最优;根部干物质积累量的上升趋势较为平缓,且各时期WB 和WP处理间差异未达显著水平;块茎干物质积累量呈持续上升趋势,于收获期达到峰值,此时,WB 比WP 处理的积累量显著增加8.2%,WBP处理的干物质积累量分别比WB、WP 及CK 处理显著增加5.32%、13.98%和31.64%。在整个生育期内,马铃薯整株的干物质积累量呈“S”形增长的趋势,且干物质积累量依次为WBP>WB>WP>CK 处理。

表3 马铃薯植株不同器官干物质积累量Tab.3 Dry matter accumulation in different organs of potato plant
2.2 生物炭和解磷菌对冬马铃薯磷素累积和分配的影响
2.2.1 冬马铃薯各器官磷素累积量
由表4 可知:马铃薯整株磷素累积量呈持续递增的变化趋势,其中,除苗期外,WBP 处理的磷素累积量显著高于WB、WP 和CK 处理;到收获期,WB、WP 和WBP 处理的整株磷素累积量分别比CK 增加53.58%、45.91%和90.65%。块茎磷素累积量也呈持续上升趋势,且高于其他器官;在盛花期大幅度提升,WBP 处理的磷素累积量显著高于WB、WP 和CK 处理,分别增加25.58%、48.08%和85.35%。地上部磷素累积量与根部变化趋势相似。在苗期WB、WP 和WBP处理地上部磷素累积量差异未达显著水平,于现蕾期出现显著差异;盛花期时,各处理磷素累积量达到最高,且均显著高于CK,WBP 处理相较WB 和WP 处理分别显著增加21.50%和28.82%。根部的磷素累积量于现蕾期达到峰值,此时,WBP 处理显著高于WB、WP 和CK 处理,分别提高16.44%、20.60%和56.81%,而后由于向块茎中转移磷素而下降。总体上看,WB、WP 和WBP 处理在马铃薯生长期间磷素累积量均大于CK,添加生物炭后对马铃薯各器官磷素累积量的促进作用高于未添加生物炭处理,其中,WBP处理效果达到最优。

表4 不同处理的马铃薯各器官磷素积累量Tab.4 Phosphorus accumulation in potato organs of different treatments
2.2.2 冬马铃薯植株磷的分配运转
磷在马铃薯植株内的分布随着生长中心的转移而发生变化。由图1 可知:在马铃薯生长初期,磷主要分配在地上部茎叶中,用于建成光合系统;随着植株的生长,现蕾期地上部磷迅速下降;到块茎形成时,地上部茎叶中大部分的磷随着养分在植株各器官的运转分配到块茎中,用于块茎的形成和营养储存,块茎中磷的分配比例随之增加;还有一部分磷在根部,以供植株生长。
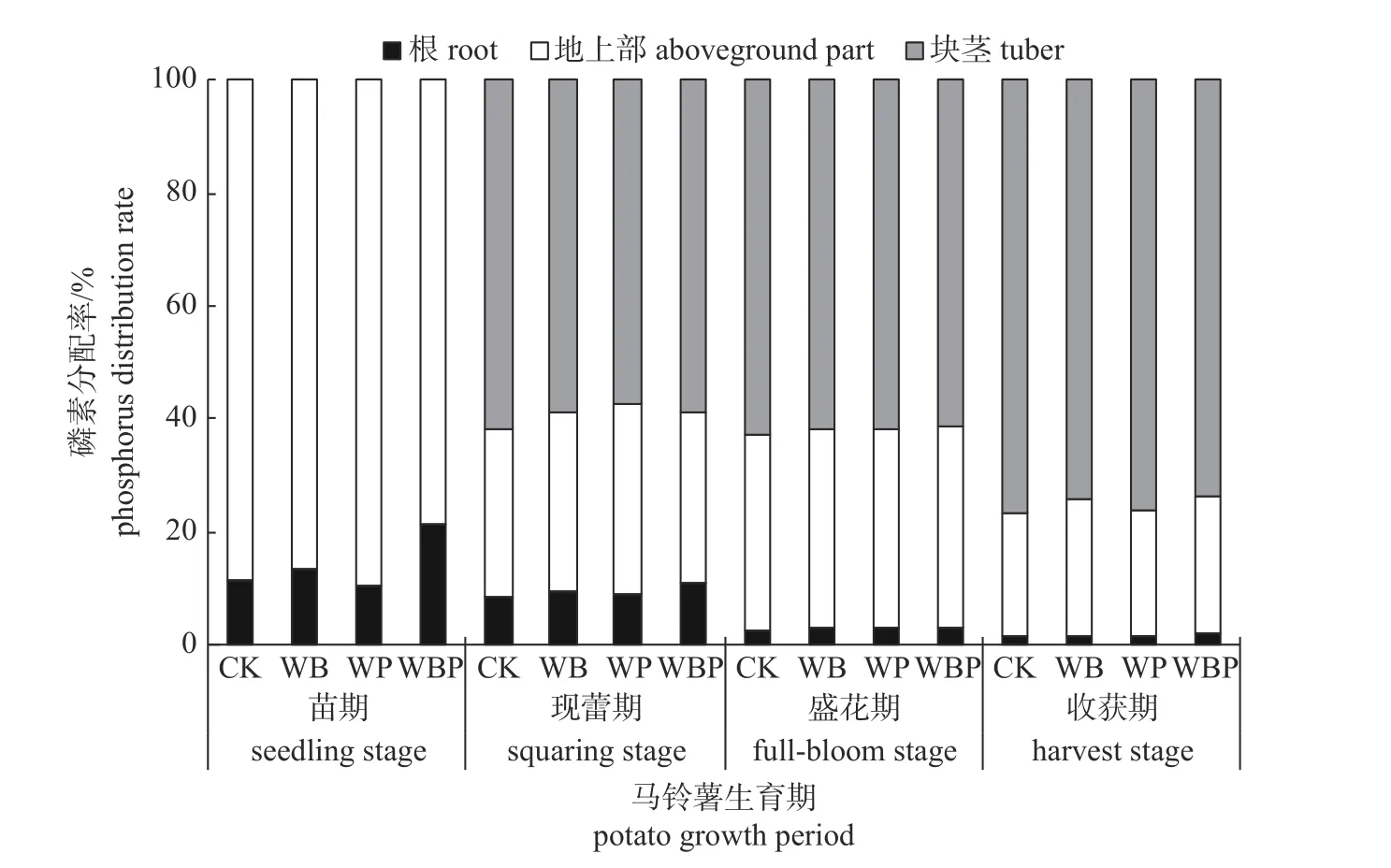
图1 马铃薯植株磷分配率动态变化)Fig.1 Dynamic change of phosphorus distribution rates of potato plants
2.3 不同处理对土壤速效磷含量的影响
由图2 可知:随着马铃薯生育期的推进,各处理速效磷的含量均呈先增后减的趋势,在植株收获期时最低。从苗期到现蕾期,WBP 处理的土壤速效磷含量显著高于WB、WP 和CK 处理;现蕾期时,表现为WBP>WP>WB>CK;收获期时,WBP、WB 和WP 处理间的差异不显著。而WP 和WB 处理在整个生育期间差异均不显著。从苗期到收获期,WBP 处理比WB 和WP 处理的土壤速效磷含量分别高11.14%和18.72%、16.00%和12.11%、12.16%和30.96%、33.22%和16.88%。土壤速效磷含量在现蕾期达到峰值,此时,WBP、WP 和WB 处理依次比CK 高73.50%、54.76%和49.57%。总体上看,WBP 处理可显著提高土壤速效磷含量。

图2 土壤速效磷含量的变化)Fig.2 Changes of available phosphorus content in soil
2.4 生物炭对土壤细菌群落的影响
2.4.1 添加解磷菌剂处理对土壤细菌多样性的分析
由图3 可知:随着测序量的不断增大,各样品 OTUs 数量的增加趋于平缓,测序趋于饱和,说明测序数据量合理,足以反映土壤样本的物种多样性。两个取样时期中,添加生物炭处理物种丰富度高于未添加生物炭处理;在马铃薯收获期,物种丰富度最高。

图3 添加解磷菌剂的生物炭处理后土壤样品的稀释曲线)Fig.3 Dilution curve of soil sample after treatment with biochar added with phosphate liberation bacteria
由表5 可知:细菌文库的覆盖率均可达到85%以上,说明试验所建立的文库可以满足解释土壤细菌多样性的需要。WP 和WBP 处理于马铃薯苗期及收获期的 OTUs 数为1 290~2 282。在苗期和收获期,与WP 相比,WBP 处理提高了Chao1 指数,说明添加生物炭可以提高土壤群落丰富度;在苗期,生物炭的添加能提高香农指数,说明可提高群落多样性,但在收获期,添加生物炭对群落多样性影响不大。

表5 添加解磷菌剂的生物炭处理后土壤细菌α 多样性指数Tab.5 Soil bacterial α diversity index after treatment with biochar added phosphate liberation bacteria
2.4.2 添加解磷菌剂的生物炭处理后土壤细菌群落组成分析
3 株解磷菌所制成的解磷菌剂测序结果显示:这3 株解磷细菌为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)。由图4 可知:将添加解磷菌剂的WP 和WBP 处理施入土壤后,土壤中的优势菌群丰度从高到低依次为变形菌门(Proteobacteria) (平均为36.32%)、拟杆菌门(Bacteroidetes) (平均为32.82%)和放线菌门(Actinobacteria) (平均为7.63%),而厚壁菌门(Firmicutes)不再为优势菌群。在苗期,相较WP 处理,WBP 处理下变形菌门的相对丰度增加36.71%,说明生物炭的添加促进变形菌门的生长繁殖;而随着时间的推移,在收获期,其群落丰度下降。此外,添加生物炭后,苗期和收获期的拟杆菌门群落相对丰度分别减少10.92%和9.79%;对厚壁菌门的生长繁殖影响不大。综上,说明生物炭对土壤中细菌群落分布有影响,且在不同时间表现有所不同;而生物炭对解磷菌是有影响的。

图4 相对丰度前10 的群落结构分布(门))Fig.4 Community structure distribution of the top 10 relative abundance (phylum)
3 讨论
已有研究表明:生物炭对许多作物都有正效应。房彬等[21]施加不同生物炭用量发现:玉米根茎叶生物量提高8.6%~46.8%,油菜根茎叶生物量提高17.2%~30.3%。柯春亮等[22]研究表明:施加解磷菌剂对香蕉植株生长具有明显的促进作用。本研究与前人研究结果一致。生物炭(WB)和解磷菌剂(WP)均能显著增加马铃薯各器官及整株的生物量,其中,以生物炭为载体的解磷菌剂(WBP)效果优于单施生物炭和解磷菌处理。田间试验表明:配合施用生物炭和解磷菌剂后,植株长势强于其他处理。
土壤速效磷是表征土壤供磷能力的重要指标[15]。本试验中,在马铃薯现蕾期、盛花期和收获期,WB、WP 和WBP 处理的土壤速效磷的含量均高于CK。其中,于现蕾期达到峰值,WBP、WP 和WB 处理依次比CK 高73.50%、54.76%和49.57%。其原因可能是研究选用的解磷菌株属于肠杆菌属和假单胞菌属,施入土壤后,一些简单的有机物质被降解,释放出多种有机酸和酸性物质,进而促进磷矿粉溶解。前人研究表明:以磷矿粉作为唯一磷源,培养解磷能力较强的菌株为假单胞菌和欧文氏菌,5 d 后可溶性磷的含量最高可达11.7 mg/L[23],溶磷能力较强的细菌还有肠杆菌属和伯克氏菌属[24-25]。还有可能是因为生物炭木质组织在炭化过程中会释放磷酸盐,是土壤中磷素的直接来源[8,26];或是生物炭减少对土壤中磷素的固定,促进土壤中难溶态磷的活化作用[27],从而提高土壤有效态磷的含量[28]。
马铃薯磷素的吸收利用以及各器官磷素分配比例对其生长发育尤为重要[29]。夏锦慧[30]研究表明:马铃薯的磷素在生育前期主要分配在茎和叶中,块茎一旦形成,便向其中进行转移,成熟收获时块茎中的磷素可占全株的80%以上。这与本研究结果相同。块茎磷的分配率和马铃薯各器官磷素的积累量结果均表现为WBP>WB>WP>CK,说明生物炭和解磷菌剂的添加有利于马铃薯对磷素的吸收与利用,进而促进马铃薯植株的生长,二者之间有协同作用,配施效果更好。赵毅珺等[16]研究发现:生物炭与解磷菌剂配施可以明显提高土壤养分含量,这与本研究结果一致。
微生物对土壤中磷素的转化有着重要的意义[31]。一些研究发现:生物炭都会对土壤细菌和真菌等群落结构有所影响。江琳琳[32]研究发现:拟杆菌门(Bacteroidetes)为主要的细菌群落,在模拟条件下添加生物炭第7 周时可增加红壤和棕壤中拟杆菌门丰度;在盐碱土和棕壤土中添加生物炭可增加变形菌门(Proteobacteria)丰度;而在玉米棕壤农田试验中,拟杆菌门、厚壁菌门和浮霉菌门丰度减少。本研究筛选出的3 株解磷细菌分别为变形杆菌门、拟杆菌门和厚壁菌门。将添加有解磷菌剂的WP 处理和WBP 处理施入土壤后,变形菌门、拟杆菌门和放线菌门为优势菌群,平均相对丰度分别为36.32%、32.82%和7.63%。相较于WP 处理,添加生物炭后,拟杆菌门相对丰度减少;在苗期,变形菌门相对丰度增加;对厚壁菌门相对丰度影响不大,且不再为优势菌群。这在一定程度可以说明生物炭对解磷菌是有作用的。而产生这种现象的原因可能是因为当土壤基本理化性状被生物炭影响后,细菌为适应土壤的改变而改变自身的群落结构[33-34],导致适应性较强或喜好这种改变的细菌菌群得以保留和发展[35]。随着马铃薯的生长,在收获期,变形菌门相对丰度下降,反映了在不同取样时间生物炭对解磷微生物的影响有所不同。变形菌门作为细菌最大的门类,包含大肠杆菌和沙门氏菌等在内的诸多病原菌,丰度下降的原因可能是生物炭会抑制变形菌门活性,进而降低相关病原菌的相对丰度,有利于作物的生长;也有可能是因为到生育后期,其活性降低或者是由于其他微生物群落的增加而使其丰度降低。赵毅珺等[16]研究发现:解磷菌剂能在适宜的条件下,通过结合土壤中的有益微生物改善土壤微生物菌群,分解土壤中的有效养分,帮助土壤养分系统更好地运转,对土壤表现出活化效应。陈敏等[36]研究表明:生物炭的施用促进了土壤中微生物数量的增加,尤其是固氮菌、解磷菌和解钾菌的数量分别增加43.9%、35.7%和16.1%。
综上所述,在土壤中接种解磷菌剂和添加生物炭是增加土壤有效磷和改善作物磷素营养的有效途径[5]。相比于解磷菌剂或生物炭的单独施用,生物炭和解磷菌配施可促进马铃薯植株生长,促进磷素的活化与转化,提高植株对磷的吸收利用。这在一定程度上可以说明生物炭对解磷菌有促进作用。其主要原因是生物炭疏松多孔的孔隙结构及对水和养分的吸附作用为解磷微生物提供良好的生存空间[6,19],增强解磷菌的活性,进而达到活化磷的目的[37]。此外,有研究报道:将解磷菌接种到土壤后,其溶磷效果与土壤中碳素的供给密切相关[38],而生物炭中含有丰富的碳源,二者混合提高了解磷菌的解磷作用,有利于磷尾矿中磷素的分解。
4 结论
将解磷菌剂和生物炭直接施入土壤中,能促进土壤中磷素的活化;3 株高效解磷菌中,变形菌门和拟杆菌门活性较好,为优势菌群。生物炭的添加能影响解磷细菌,改变土壤细菌种群分布,增强其解磷效果,从而提高土壤磷素的有效性,促进植株对磷的吸收利用,进而利于植株生长发育。
