同位素内标法快速筛查分析动物源性食品中地西泮残留
2021-09-01崔瑞霞宋润娜赵喜华
◎ 崔瑞霞,宋润娜,赵喜华
(河南中测技术检测服务有限公司,河南 郑州 450000)
地西泮(Diazepam,C16H13CIN2O)又名安定,是苯二氮卓类药物的一种,主要作为抗焦虑和镇定剂类药物使用,对患有焦虑、睡眠不好、癫痫和惊厥的患者人群和动物有一定功效;地西泮也可以降低动物对外界的感知能力,降低其代谢功能,使之在运输和储存过程中仍然鲜活,并有促进生长和增重催肥的作用;地西泮也有一定的副作用,例如过度服用可引起嗜睡、宿醉反应,精神萎靡不振。长期服用地西泮会形成严重的药物依赖性,尤其对老人和小孩的身体损害较大,且损伤不可逆。近年来动物源性食品中检出了地西泮,可能是由于养殖户在养殖过程中违规使用相关兽药。镇静剂类药物被许多国家列为动物养殖和运输过程中明确禁止使用的药物,我国农业部176号公告也规定严禁在饲料和动物饮用水中使用地西泮等精神类药物。《食品安全国家标准 食品中兽药最大残留限量》(GB 31650—2019)[1]中规定地西泮在动物性食品中不得检出。
近年来食品抽检量加大,动物源性食品中地西泮检出率也相对较高[2]。报道的主要检测方法有液相色谱法[3-4]、高效毛细管电泳法[5]、气相色谱质谱法[6-9]、液相色谱串联质谱法[10-16]以及超高效液相色谱-四极杆/静电场轨道阱高分辨质谱[17-18]等检测方法。其中,液相色谱法检测禁用物质痕量灵敏度相对较低;气相色谱-质谱法前处理相对比较复杂,对除水要求较高;超高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测样品成本较高;液相色谱-串联质谱法因其痕量灵敏度高、选择性强和定性准确等优点,在兽药残留分析中应用最为广泛。目前国家抽检细则推荐使用标准《出口动物源食品中多类禁用药物残留量检测方法液相色谱-质谱/质谱法》(SN/T 3235—2012)[19],并且只有此标准适用于动物源性食品中地西泮的检测,但检测过程中发现该方法存在前处理繁琐、加标回收率较低、重复性差等问题,不适合日常大批量监督抽检筛查检测。每年7—12月份食品抽检高峰期,能建立一种快速检测动物源性食品中地西泮检测方法是很有必要的。
Cleanert LipoNo兽残除脂萃取管是博纳艾杰尔科技有限公司新研发的一种除脂材料,填料表面修饰了许多长的碳链,可针对性地吸附脂肪。此方法以QuEChERS[17]的方式对脂类含量较高的样品如肉、蛋、奶等进行前处理,能在除脂的同时保证良好的兽药回收率,方法操作简单便捷,适于处理大量样品。本研究将Cleanert LipoNo净化技术与同位素内标法相结合,采用LC-MS/MS法,建立了水产品中地西泮快速检测方法,考虑到日常监督抽检和风险监测时间短、任务重,此方法适用于大批量水产品中地西泮的定性定量分析,为水产品安全提供了一定的技术支撑。
1 材料与方法
1.1 仪器与材料
LC-MS/MS-1290-6470A超高效液相色谱-串联质谱仪(安捷伦公司);氮吹仪(日本Eyela公司);高速冷冻离心机SIGMA1-15K(德国Sigma希格玛离心机公司);MS205DU型电子天平(瑞典Mettler Toledo);涡旋振荡器(德国伊卡公司);Milli-QDirect-Q10超纯水机(美国默克密理博公司)。
标准品。甲醇中地西泮、甲醇中地西泮-D5均采购于北京坛墨质检标准物质中心。
乙腈、甲醇、甲酸质谱级,德国默克公司;乙二胺四乙酸二钠分析纯天津市凯通化学试剂有限公司);甲酸色谱纯德国默克公司;0.22 μm水系滤膜天津津滕公司;Cleanert LipoNo兽残除脂萃取管样品前处理净化剂(博纳艾杰尔科技有限公司)。
样品。水产品、禽蛋、羊肉、牛肉及猪肉共400批购于郑州市金水区的农贸市场和超市。
1.2 试验方法
1.2.1 溶液配制
将地西泮标准储备液100 mg·L-1标准储备液用乙腈稀释为10 mg·L-1的中间液,将地西泮-D5同位素内标稀释为4 mg·L-1中间液;将标准溶液用乙腈稀释成1.0~200 ng·mL-1的系列标准溶液,含内标100 μg·L-1,现用现配;称取空白样品2.0 g,分别加入系列标准溶液各100 μL,其他处理同样品前处理2.2.2,制成基质加标标准工作溶液。
0.1 mol·L-1乙二胺四乙酸二钠溶液。称取3.362 g乙二胺四乙酸二钠于100 mL容量瓶中,用水定容至100 mL。
0.2%甲酸水溶液。取0.2 mL甲酸于100 mL容量瓶中用水定容至100 mL。
1.2.2 样品前处理
(1)提取。称取均质后的样品1.00 g(精确至0.01 g)置50 mL离心管,加入2 mL 0.1 mol·L-1EDTA溶液,涡旋30 s,超声提取10 min;加入5 mL乙腈,再加入1 g无水硫酸镁后振荡提取2 min,8 000 r·min-1高速离心5 min。
(2)净化。取上乙腈层3 mL加入Cleanert LipoNo提取净化管中,涡旋振荡1 min,静置分层,取上清液过0.22 μm微孔滤膜至进样小瓶,待测。
1.2.3 液相色谱-串联质谱条件
(1)液相色谱条件。PerkinElmer Brownlee SPP(Superficially Porous Particles)C18色谱柱(2.1 mm×100 mm,2.7 μm);流动相:A为0.1%甲酸,B为乙腈;流速:0.3 mL·min-1; 进样体积:10 μL;柱温:30 ℃;液相色谱梯度洗脱程序:0~2 min,92% A,8% B;2.0~8.0 min,70%~40% A,30%~60% B;8~12min,92%A,8% B。
(2)质谱条件。离子源:ESI源,正离子模式;检测方式:多反应监测(MRM)模式;电喷雾电压:4.9 kV;脱溶剂管温度:380 ℃;气帘气压力:241 kPa;雾化气压力:345 kPa;辅助雾化气:275 kPa;碰撞气压力:50 kPa。碰撞气,氮气。地西泮的监测离子对及碰撞能量见表1。

表1 质谱参数表
2 结果与分析
2.1 质谱条件优化
将1 µg·mL-1乙腈中地西泮标准溶液以超高效液相注入质谱仪,在正离子模式下进行一级质谱全扫描,确定其分子离子峰;确定地西泮和地西泮-D5母离子,再对获得的母离子进行二级质谱扫描,确定目标物的主要离子碎片,选择相对丰度强、干扰小的离子对,通过优化碰撞能,确定最佳的质谱条件(见表1)。
2.2 前处理条件优化
2.2.1 称样质量的优化
分别精确称取1.00 g、2.00 g、5.00 g 3组9份空白基质样品,对每组空白基质样品中加地西泮1.0 ng、5.0 ng、10.0 ng,依次加入2 mL 0.1 moL·L-1乙二胺四乙酸二钠溶液和5 mL乙腈依次提取,再加入1 g无水硫酸镁后振荡提取2 min,8 000 r·min-1高速离心5 min,取3 mL乙腈层经Cleanert LipoNo提取净化管中净化,涡旋1 min后静置分层,取上清液乙腈层待测。基质内标法做标准曲线。经对比发现称样量1.00 g样品中目标物回收率最高。
2.2.2 提取的优化
地西泮易溶于甲醇、乙腈和乙酸乙酯等有机溶剂。本实验以牛蛙、鸡蛋、鲫鱼和羊肉为例,比较甲醇、1%(V/V)甲酸甲醇、乙腈、1%(V/V)甲酸乙腈、先加0.1 moL·L-1EDTA溶液再加乙腈提取、乙酸乙酯以及先加0.1 moL·L-1EDTA溶液再加乙酸乙酯提取7种提取方式提取效率,结果见表2。
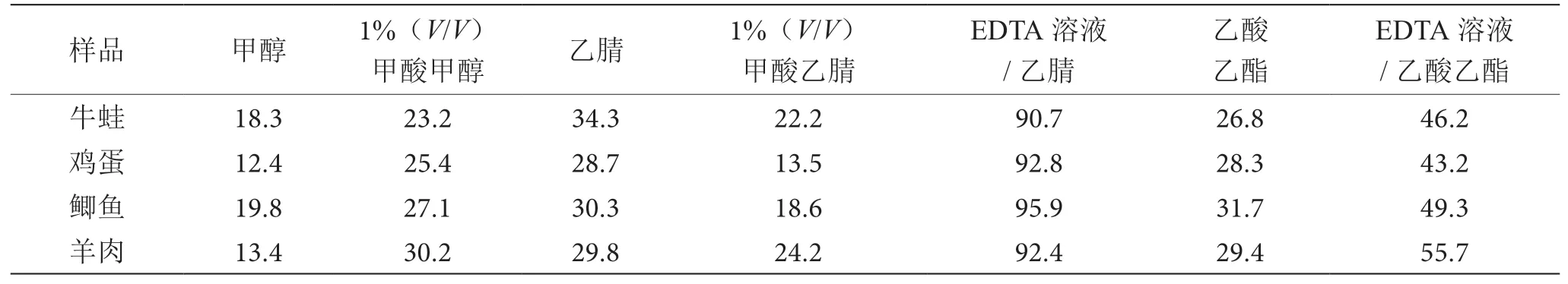
表2 提取溶剂不同对地西泮加标回收率的影响表(单位:%)
通过比较不同溶剂提取方法发现加甲醇、1%(V/V)甲酸甲醇、乙腈、1%(V/V)甲酸乙腈、EDTA溶液/乙腈、乙酸乙酯及EDTA溶液/乙酸乙酯其中提取方式,直接加有机溶剂做提取剂后样品直接聚合成一个团状,想要分散样品,要把已加过试剂的样品用高速匀浆机匀浆,但是过程中会有损失,加标回收率都不高,都在50%以下,用先加0.1 moL·L-1EDTA溶液提取再加乙腈或乙酸乙酯提取,发现样品加EDTA溶液涡旋后样品分散了,无需用高速匀浆机匀浆,提取更彻底,损失更少。对比发现用先加0.1 moL·L-1EDTA溶液再加乙腈提取加标回收率均在90%以上,故选择先加0.1 moL·L-1EDTA溶液再加乙腈此种提取方式。
2.2.3 净化方式的选择
动物源性食品中含丰富蛋白质、微量元素和不饱和脂肪酸等,基质比较复杂。有效去除基质中的干扰成分并彻底把目标物提取出来是最终目的。本研究实验过程中比较了QuEChERS-MAS、Cleanert LipoNo和QuEChERS固相萃取材料净化效果,均可以有效去除基质干扰,但是大批量的监督抽检需要操作更快捷准确。液液萃取法脱脂效果不是很好,脱脂不完全,容易堵塞仪器进样系统,降低色谱柱和仪器使用寿命。QuEChERS方法是一种普遍用于蔬菜或水果中的多农残检测预处理方法,主要是基于C18、PSA、石墨碳等材料的分散固相萃取技术,目前已延伸至非法添加[14-15]和兽药残留[18-19]等领域。考察了月旭科技和中检维康QuEChERS、天津博纳艾杰尔Cleanert LipoNo和QuEChERS-MAS的样品净化处理效果,结果显示Cleanert LipoNo净化后样品溶液相对比较澄清,去除动物源性中脂质率效果最好,且地西泮的回收率也相对较高,基质效应最小,因此选则Cleanert LipoNo净化样品。
2.2.4 基质效应
基质效应/(%)=B/A×100%,其中,溶剂中目标化合物的响应值记为A;取空白样品加入地西泮和地西泮-D5内标按照2.2.2制成与纯溶剂中浓度相同的基质测定溶液,测定后响应值记为B。经过实验,牛蛙、鸡蛋、鲫鱼、羊肉4种不同基质样品在经过样品处理后的基质效应为40.6%~61.8%,可以认为基质效应对目标物地西泮的提取有很大影响,为消除不同的基质效应,本方法用全程基质配制标准曲线,内标法进行定量分析。
2.3 方法验证
2.3.1 线性关系、检出限、回收率和精密度
取一定量的空白基质,加入一定体积的标准溶液和内标溶液,按2.2.2优化好的前处理条件进行提取、净化,按2.2.1配制成全程基质加标标准溶液,按浓度由低到高进行测定。在0.1~20.0 ng·mL-1范围内,线性回归方程为Y=68.06X+13.2,相关系数0.999 7,线性关系良好。以3倍信噪比(S/N)为检出限(LOD),以10倍信噪比为定量限(LOQ),得出检出限为0.05 µg·kg-1,定量限为0.15 µg·kg-1,表明该方法的检出限低,灵敏度高。取4个不同基质阴性样品,添加浓度、平均回收率、相对标准偏差计算如表3所示。
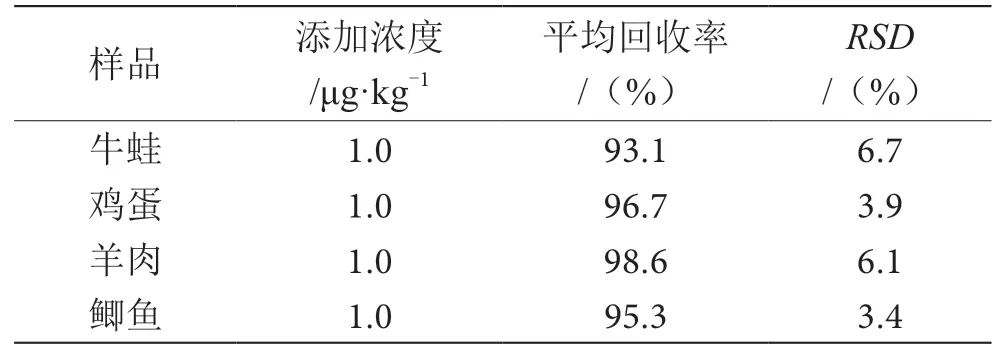
表3 不同基质中地西泮平均回收率与精密度表(n=6)
2.3.2 方法稳定性
以牛蛙为基质连续4 d做加标回收,以验证本方法稳定性,结果如表4。

表4 连续4 d牛蛙加标检测结果表(n=6)
结果表明,本方法在不同时间实验方法相关系数在0.998以上,回收率在96.1%~99.7%,精密度满足要求,相对目前已有检测方法,该方法定性定量准确、重复性好、检测结果可信、前处理快速,适合大批量水产品中地西泮快速筛查检测。
2.3.3 实际样品的测定
2020年10月运用本研究方法对郑州市金水区400批次动物源性进行检测。通过对实际样品的检测结果分析,其中3批鲫鱼和2批草鱼检出,检出浓度在1.3~3.8 μg·kg-1范围内,存在一定的食品安全风险。
3 结论
本研究通过内标法定量和优化提取溶液体系,有效提高动物源性食品基质中地西泮药物残留的回收率,再通过Cleanert LipoNo净化,具有较好回收率、灵敏度、重复性和稳定性,实现内标法快速筛查分析动物源性食品中地西泮药物残留。该检测方法前处理快速准确,为快速筛查动物源性食品中地西泮和食品安全监管部门提供了技术支撑。
