EGFR、ALK、ROS-1基因在肺癌组织中表达及对预后的评估价值
2021-09-01田田张志红崔亚云安徽省肿瘤医院呼吸肿瘤内科安徽合肥3003放疗科
田田 张志红 崔亚云 (安徽省肿瘤医院 呼吸肿瘤内科,安徽 合肥 3003;放疗科)
非小细胞肺癌(NSCLC)主要包括肺鳞癌、腺癌、大细胞未分化癌,目前临床治疗方式以手术治疗为主,并辅助放化疗。由于癌症早期无显著性病症,影像学表现也不显著,导致诊断、治疗不及时,一旦确诊大部分已步入中晚期,甚至已经发生脑部转移,严重影响患者预后〔1〕。针对激酶靶点的替尼类抑制剂(吉非替尼、厄洛替尼、克唑替尼等)已在临床广泛应用,通过检测患者基因突变类型,指导医生个体化用药,可有效提高晚期NSCLC的治疗效率〔2〕。与NSCLC相关的常见突变基因型有表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)、C-ros原癌基因1酪氨酸激酶(ROS-1)等,三种基因型的突变、融合可通过激活下游不同信号通路从而调控肿瘤细胞的生长、增殖、分化及转移等生物学行为〔3,4〕。尽管针对基因突变采用相应的治疗可有效提高治疗效率,可让患者生存获益,但尚缺乏相应的资料表明EGFR、ALK、ROS-1突变与NSCLC预后是否存在相关性〔3,5〕,研究旨在探讨EGFR、ALK、ROS-1在肺癌患者组织的表达情况及对预后的评估价值。
1 材料与方法
1.1基本资料 2017年1月至2018年9月收治的80例老年非小细胞肺癌患者,根据1年随访预后情况分为死亡组(28例)、存活组(52例)。纳入标准〔6〕:①经病理学、影像学检测确诊为肺癌,首诊无远处转移;②依从研究方案,病例资料完整;排除标准:①存在其他原发性恶性肿瘤或者肿瘤转移者;②合并心、肾、肝等重要脏器功能障碍,脑血管疾病者。患者及家属均签署知情同意书,本研究获得医院伦理委员会批准。
1.2临床资料收集 收集入组患者的临床资料,包括性别、年龄等一般资料及病理类型、临床分期等病理资料及随访1年患者的生存、死亡情况。
1.3EGFR、ALK、ROS-1基因检测 采用突变扩增系统(ARMS)检测EGFR基因,首先收集肺癌组织标本并进行石蜡切片,切片厚度6~8 μm,数量≥10张,然后经二甲苯脱蜡、无水乙醇漂洗、风干,并刮取装入1.5 ml EP管中,随后按照DNA提取试剂盒(德国QIAGEN)操作说明提取DNA,纯度(A260/A280比值)在1.8~2.2范围内则表明操作合格。随后将DNA稀释至2 ng/μl,于42.3 μl DNA模板中加入2.7 μl Taq酶液,混匀后分装到含有反应液的8联管中,5 μl/管,短暂离心后用荧光定量PCR仪(型号ABI7500)进行测定,反应条件如下:先在95℃条件下预变性5 min,接着95℃×25 s、64℃×20 s,72℃×20 s,15个循环,93℃×25 s、60℃×35 s、72℃×20 s,31个循环,60℃收集FAM和VIC信号并进行数据分析即可。
采用荧光原位杂交技术(FISH)检测ALK、ROS-1基因,具体操作如下:石蜡切片(厚度4 μm)后60℃烤片2 h,随后二甲苯脱蜡、无水乙醇漂洗、风干,并将切片浸入至93℃的超纯水中温孵30 min,取出切片后用超纯水清洗,置入酶消化液中(10~20 min)进行消化处理,取出后超纯水浸洗终止消化,风干切片并加入探针,盖上盖玻片并外封,接着放入杂交仪中变性80℃×5 min,杂交37℃×16 h。待杂交完成后清洗切片并置入柠檬酸钠缓冲液(SSC)溶液中3 min,去除盖玻片,再次于73℃ SSC溶液中温孵3 min,取出风干加入10 μl 4′,6-二脒基-2-苯基吲哚二盐酸盐(DAPI),盖好盖玻片,于荧光显微镜下观察染色结果。细胞阴性判定:产生1个橙色、绿色融合信号;细胞阳性判定:单独存在的1个橙色荧光信号,或者1组橙色和绿色荧光信号,其间隔距离超过两个信号半径大小,至少计数50个肿瘤细胞中,以15%为临界值,若超过15%的细胞表现为阳性则判断为阳性。
1.4统计学分析 采用SPSS19.0软件进行t检验、χ2检验、Kaplan-Meier 法、Log-rank检验。
2 结 果
2.1肺癌组织EGFR、ALK、ROS-1突变与临床病理特征的关系 ALK阳性患者8例(10.00%),ROS-1阳性患者2例(2.50%),EGFR阳性患者35例(43.75%)。肺癌组织EGFR、ALK均与淋巴结转移、分期、分化程度、预后相关(P<0.05,P<0.01),见表1。

表1 肺癌组织EGFR、ALK、ROS-1突变与临床病理特征的关系(n)
2.2肺癌组织EGFR、ALK、ROS-1突变与预后关系 80例老年NSCLC患者,通过Kaplan-Meier 生存分析,整体无进展生存期(PFS)中位时间为7.44个月。通过Log-rank 检验,肺癌组织EGFR、ALK、ROS-1呈现阳性时,患者PFS显著长于阴性(P<0.05)。Log-rank检验结果显示ALK、ROS1及EGFR突变与患者的PFS相关(均P<0.001),见表2。
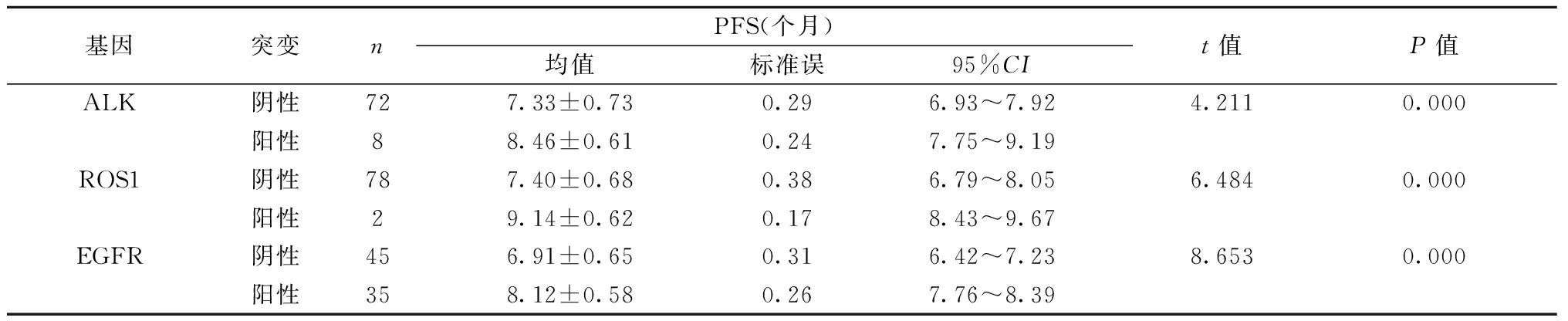
表2 肺癌组织EGFR、ALK、ROS-1突变与预后关系
2.3肺癌组织EGFR、ALK、ROS-1突变与NSCLC患者独立预后危险因素的相关分析 经对患者的癌组织EGFR、ALK、ROS-1突变及肿瘤分化程度、分期、淋巴结转移进行PFS的Cox回归多因素分析,结果显示EGFR、ALK、ROS-1突变及肿瘤分化程度、分期、淋巴结转移可作为影响NSCLS患者PFS的独立预后危险因素,见表3。

表3 患者生存影响多因素分析结果
3 讨 论
统计数据显示NSCLC患者5年生存率仅为15%,因此诊治过程中寻找可准确评估非小细胞肺癌生物学行为(如突变耐药性、转移性等)及准确预测预后的评价指标对于指导医师针对性的治疗方案至关重要,从而提高诊治效率,降低死亡风险〔7,8〕。目前评估NSCLC预后的指标众多,主要分为血清学指标(癌胚抗原、癌抗原125细胞角质素片段抗原、神经元异性烯醇化酶等)〔9〕、组织学指标(EGFR、ALK、ROS-1、VEGF等)〔4〕,其中血清标志物容易受到多种因素的干扰(吸烟、饮食、感染、生理状态等),导致出现假阴性或者假阳性,组织病理学检测是众多疾病诊断的金标准,可鉴别正常和病理组织的形态结构,组织学诊断价值较高,且EGFR、ALK、ROS-1均可在肺癌组织中高表达,可有效反映患者癌基因突变类型,从而指导靶向治疗方案的选择。
EGFR作为受体酪氨酸激酶家族成员,与NSCLC、卵巢癌、乳腺癌等癌症的发生、发展密切关联,EGFR酪氨酸激酶抑制剂(吉非替尼、厄洛替尼、阿法替尼等)已广泛用于NSCLC的一线、二线靶向治疗〔4〕,关于EGFR的表达情况与患者预后相关性尚存争议,而此次研究发现EGFR表达水平与预后存在相关性,其阳性患者死亡率显著低于阴性患者,PFS显著长于阴性患者。同时研究发现阳性患者具有更高的淋巴结转移风险,分析认为EGFR的过表达可大量激活下游ras/rsf/丝裂原活化蛋白激酶(MAPK)及磷酸肌醇激酶信号通路,从而调控有丝分裂信号,促进细胞的生长、增殖、分化等生物学行为,同时还能促进血管生成,促进肿瘤细胞侵袭、远处转移等,故而增加淋巴结转移风险。尽管EGFR突变与ALK融合基因在NSCLC患者中有很多共同之处,但两者相互排斥,合并突变发生率极低,使得ALK融合基因阳性可成为NSCLC患者一种独立亚型〔10〕。NSCLC中ALK基因常与EML4基因融合,从而促进ALK基因持续表达,进而激活下游磷脂酰肌醇激酶/蛋白激酶B(PI3K/AKT)、MAPK信号通路,促进肿瘤的发生〔11〕。本研究发现NSCLC患者ALK突变阳性率与病理特征(淋巴结转移、分期、分化程度)具有相关性,且阳性患者具有更高死亡率。Zhao等〔12〕通过meta分析发现ALK融合基因在Ⅲ期、Ⅳ期的NSCLC患者中的检出率明显高于Ⅰ期、Ⅱ期患者,高琼琼等〔3〕报道显示NSCLC患者ALK融合基因的阳性率可达9.0%,而早期患者阳性率在2.4%~8.6%,与本研究结果一致,即在晚期患者中具有更高的阳性率。ALK阳性患者淋巴结转移风险明显高于阴性患者,表明ALK患者具有淋巴结转移的生物学特点,也进一步说明晚期NSCLC患者阳性率高于阴性率。研究发现ALK阳性患者的总生存期为97.7个月,明显高于阴性患者(78.9个月)〔13〕,表明阳性患者具有更优的预后效果,与本研究一致,分析认为患者接受了替尼类药物的靶向治疗,可有效阻滞ALK下游信号通路,从而进一步阻滞肿瘤细胞的生长、侵袭,故而提高治疗效果。
ROS-1作为胰岛素受体家族中的一种酪氨酸激酶,在NSCLC中可与SLC34A、CD74融合,并激活下游PI3K/AKT、Janus激酶/信号转导与转导激活子(JAK/STAT)、RAS/MAPK等信号通路,从而调控肿瘤的发生发展。本研究发现ROS-1基因突变与病理类型、临床分期等有关,与杨三虎等〔14〕报道一致。ALK和ROS-1在激酶结构域在氨基酸序列、三磷酸腺苷结合位点上均具有同源性,分别为49%、77%,因此目前所有ALK抑制剂均可有效控制ROS-1融合患者(艾乐替尼除外)〔2〕。同时文献报道发现同一患者中ROS-1融合基因突变、EGFR突变共存率极低,各种基因型突变的共存情况下选中何种激酶抑制剂是临床尚需进一步论证的方向〔15〕。本研究发现EGFR、ALK、ROS-1突变均与患者的预后具有相关性,阳性患者采用标准化疗相对文献报道的靶向疗法具有更低得生存率,为靶向疗法及个体化治疗提供了理论依据。
