繁殖期4种淡水鱼类化学预警行为及其与性腺指数的关联
2021-09-01夏继刚
夏继刚,张 嫱,刘 香,张 宁
重庆师范大学生命科学学院, 重庆市动物生物学重点实验室,进化生理与行为学实验室,重庆 401331
化学通讯是水生动物最原始、最普遍和最主要的通讯方式之一[1-9]。与陆生动物相比,由于受到水环境透明度、浊度等生态因子的制约,鱼类等水生动物的视觉通讯往往受到很大限制,依赖于嗅觉系统的化学通讯成为水生动物生存的必要选择[4-8]。介导鱼类通讯的化学信息主要包括性信息素和一般环境化学信息,其中性信息素主要与鱼类的繁殖生理与繁殖活动有关,相关研究已日趋成熟;相较而言,食物或化学预警信息(Chemical alarm cues, CAC)则在鱼类捕食者-猎物种间关系中起重要作用,主要与生存适合度密切关联,近年来逐渐成为研究热点[10-13]。CAC能够引起同伴快速预警与反捕食响应,从而提高种群的整体适合度[2-3,6-10]。
在众多的鱼类化学预警信息中,鱼体受到来自捕食者攻击等外界的机械性损伤时由表皮棒状细胞破损释放的化学预警信息(Damage-released chemical alarm cues, DCAC)备受研究者关注。DCAC是一种次黄嘌呤-3-N-氧化物(Hypoxanthine-3-N-oxide)或一组功能相似的化合物,在实验条件下相对比较稳定[14]。DCAC的表达与释放无疑有助于提高鱼类的反捕食能力,但鱼类DCAC的产生及其行为应答本身是一种较为耗能的生理/生态过程[7,15-18]。值得注意的是,繁殖也是一种高能耗的生命活动[19-21]。因此,繁殖期鱼类对DCAC是否依然保留或多大程度上保留对DCAC的响应便是一个有意义的问题。Smith等[22-23]少量研究者曾报道了繁殖期某些硬骨鱼类DCAC的产生及其行为应答模式缺失并引起学界对繁殖期鱼类化学预警通讯研究的回避[5,16]。
生态学家认为反捕食能力是动物适合度的基础条件,适合度最大化必须同时依赖成功的生存和高效的繁衍。我们近期的一项研究发现,繁殖期高体鳑鲏(Rhodeusocellatus)依然对DCAC展现出一定程度的行为应答,并且其行为响应程度不受繁殖生理状态和性别的影响[5],表明Smith等的研究结果并不具有普遍性。不过,考虑到高体鳑鲏繁殖生理投入很低,这种现象是否存在于其它不同繁殖投入(繁殖对策)鱼类有必要进一步考证。为此,我们假定:(1)繁殖期鱼类的化学预警通讯是否缺失与不同物种的繁殖生理投入有关,高繁殖投入的物种化学预警通讯可能弱化甚至缺失,而低繁殖投入的物种或将保留显著的化学预警行为(假说一);(2)个体对DCAC的应答程度同时受到环境风险强度(例如DCAC浓度)的影响和自身繁殖-预警能量分配的限制(假说二)。为验证以上科学假说,本研究选取高体鳑鲏(卵生,繁殖投入较低)、斑马鱼(Daniorerio,卵生,繁殖投入较高)、孔雀鱼(Poeciliareticulata,卵胎生,繁殖投入较高)和皮球鱼(Poecilialatipinna,卵胎生,繁殖投入很高)4种淡水鱼类为实验对象(图1),测定了繁殖IV期实验鱼对不同浓度DCAC的行为响应模式,并探究了4种实验鱼的化学预警响应与其性腺指数(Gonadosomatic index, GSI)的关联。
1 材料与方法
1.1 实验动物
实验所用4种实验鱼种群均已在实验室长期驯养。这4种鱼均无亲体抚育行为,在实验室条件下也无寻觅适宜产卵生境或筑巢行为,因此繁殖生理投入基本上反映了繁殖投入总体状况。为保证实验驯养条件的一致性,实验前,将所有实验鱼饲养于12个24 L的玻璃质循环水槽(40 cm×23 cm×42 cm,实际水深约26 cm;每种实验鱼设3个平行),并于实验室条件下驯养适应2周。驯养期间,实验用水为曝气24 h以上的自来水,水温(24±1)℃,溶解氧大于6.5 mg/L,光周期14 L∶10 D。每日早晚(09:00和20:00)以冰冻水丝蚓(Tubifexspp.)各饱足投喂1次,投喂15 min后,吸去残饵及粪便并更换1/3水体。驯养结束后,选取健康活泼、大小相近且预估处于繁殖Ⅳ期的个体用于DCAC制备以及后来的行为学测试。繁殖Ⅳ的判断以实验测定结束后对性腺的解剖学特征为依据,非繁殖Ⅳ个体的相关测定不用于统计分析。
1.2 DCAC制备
将实验鱼钝击后断头处死,并在低温条件下(冰上操作)迅速剥离身体两侧皮肤组织并精确计算出面积大小,然后将所剥离的皮肤组织放入研磨棒中加入适量冰水充分研磨使表皮细胞破碎、内容物流出,过滤,并最终配制成10 mL/cm2含有DCAC的母液。将各种实验鱼的DCAC母液分别及时分装至若干10 mL的小袋中于-20℃冷冻保存,一周内用于实验研究。根据前期实验结果[5]和预实验研究,繁殖期几种实验鱼的DCAC是存在的。
1.3 实验方案
对每种实验鱼均设置10 mL自来水(对照组)、2.5 mL DCAC+7.5 mL自来水(低浓度DCAC组)、10 mL DCAC(高浓度DCAC组)3个化学信息处理组,对应的浓度分别为0、0.025、0.1 cm2/mL的皮肤组织研磨液。实验观测设备为自制的方形水槽(60 cm×11 cm×36 cm,实际水深26 cm)。将单尾实验鱼转移至实验水槽,并给予20 min的适应期(依据预实验研究结果,20 min后绝大多数实验鱼能够适应实验测试条件,恢复自发游泳状态)。在此期间解冻DCAC和冰冻自来水。适应结束后,用摄像头(Logitech Webcam Pro 9000,15帧/s)拍摄记录实验鱼的行为响应,拍摄时间为5 min(Pretest);之后,采用注射器分别将10 mL 的自来水或不同浓度的DCAC通过管道缓缓推入实验水槽(操作时间为20 s并给予20 s的加样操作恢复期);接着继续拍摄记录5 min(Posttest)。实验同时使用3个测试水槽(每个化学信息处理随机使用1个),每做完1个重复,将所有实验水槽冲洗3遍,确保无DCAC以及被试鱼化学信息残留。视频录制期间,水温水质条件与驯养期间保持一致。
行为测试结束后,将每一条与行为测试相对应的实验鱼用MS-222麻醉后解剖,检测其健康状况及性腺成熟程度,用分析天平和直尺测定体重、体长、性腺重,并依据以上参数计算出性腺指数(GSI,GSI=m′/m× 100,式中m′、m分别为性腺重和体重)。本研究中,仅将体质健康并处于繁殖Ⅳ期的个体用于统计分析。各个化学信息处理组,高体鳑鲏、斑马鱼、孔雀鱼和皮球鱼被用于统计分析的样本量分别为n=28、n=25、n=28、n=28。4种实验鱼的GSI差异显著(图1,表1)。

表1 4种实验鱼的形态参数与性腺指数

图1 4种实验鱼的形态与性腺指数示意图
1.4 数据分析
采用Noldus动物运动轨迹跟踪软件(EthoVision XT 9.0, Noldus, Netherlands)对所有录制视频进行分析。通过对实验鱼空间分布状态(以底栖时间表征,即在距离实验水槽底部5 cm范围内出现的时间)、活跃状态(以静止时间、运动距离、运动平均速度和身体不重合度表征,其中静止状态的判断标准为实验鱼的图心位移小于1 cm/s)、逃逸行为(以高速运动时间表征,即运动速度大于30 cm/s的时间)的解析来量化实验鱼的化学预警响应[5,7,16]。为了消除行为背景值对DCAC效应的影响,将DCAC加入前后行为参数的变化量(Posttest-Pretest)用于统计分析[2]。
应用SPSS 19.0对数据进行统计分析。首先对实验数据进行正态性和方差齐性检验。若数据满足正态性和方差齐性,采用单因素协方差分析(以GSI为协变量)和Tukey′s HSD多重比较检验差异显著性,Pearson相关分析检测实验鱼行为响应变化与GSI的关联;若数据不满足正态性和方差齐性,采用Scheirer-Ray-Hare分析[24]检验差异显著性,Spearman相关分析检测实验鱼行为响应变化与GSI的关联。数据均以平均值±标准误表示,显著性水平设在P<0.05。
2 结果
2.1 化学预警信息对4种实验鱼的行为响应的影响
DCAC对4种实验鱼的化学预警行为均有显著影响,不同鱼类对DCAC的行为应答不尽相同(表2,图2)。总体上,DCAC导致实验鱼底栖时间和静止时间增加(P<0.05)或有增加的趋势、运动距离和身体不重合度减少(P<0.05)或有减少的趋势。DCAC对运动平均速度无显著影响(P>0.05),除孔雀鱼外DCAC对高速运动时间也无显著影响(P>0.05)。此外,高浓度和低浓度DCAC处理对除身体不重合度以外的行为参数均无显著影响(P>0.05)。

图2 化学预警信息对4种实验鱼的行为响应的影响
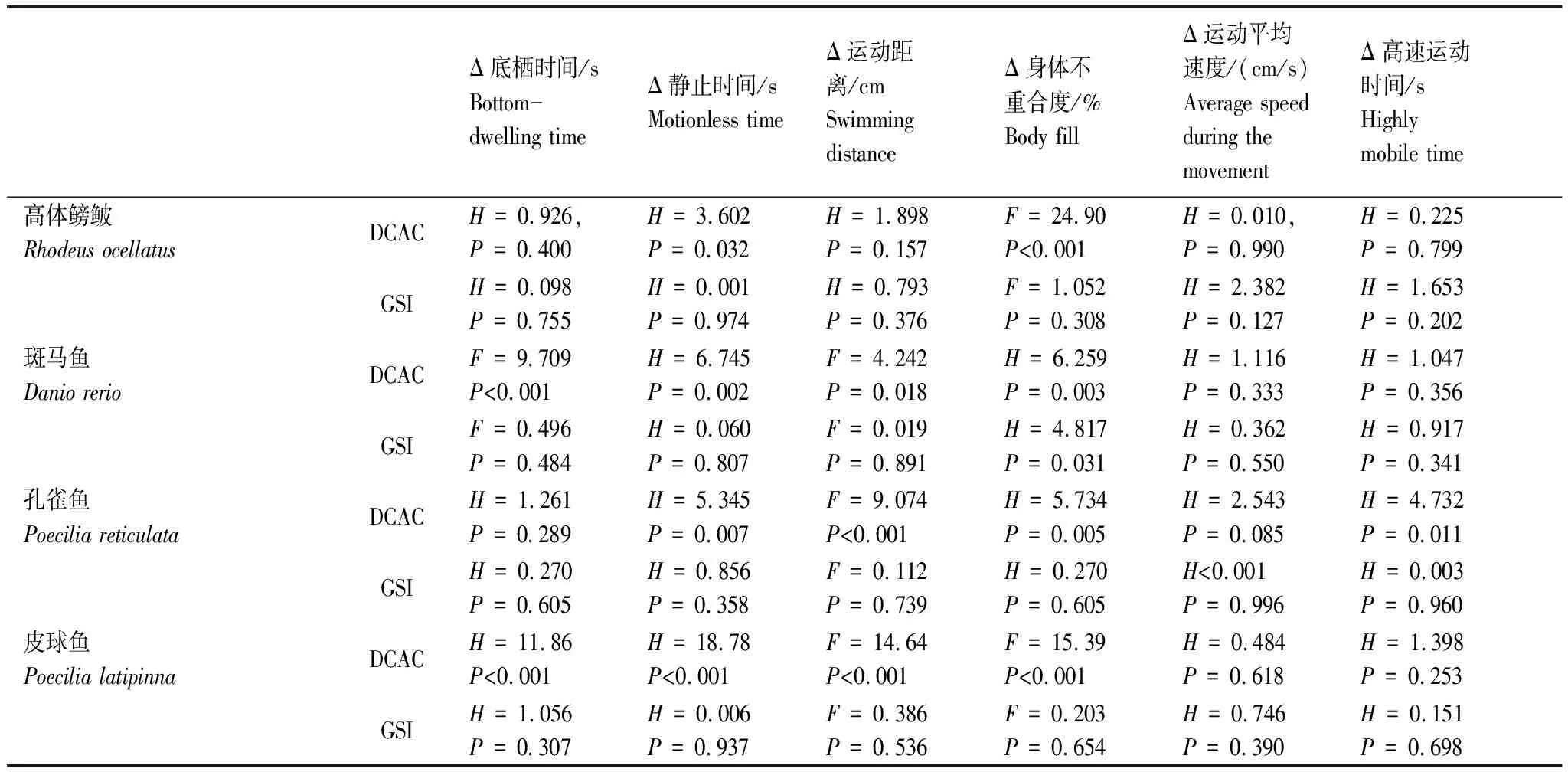
表2 化学信息和性腺指数对4种实验鱼的行为响应参数的影响
2.2 4种实验鱼化学预警响应与其GSI的关联
除了高浓度DCAC处理组皮球鱼的GSI与其底栖时间的变化显著负相关(r=-0.405,P<0.05,表3),在其它处理组以及其它鱼类中均未发现GSI与化学预警响应参数的变化有显著的相关性(P>0.05,表3)。

表3 4种实验鱼化学预警响应与性腺指数的关联
3 讨论
化学预警通讯是鱼类应对被捕食风险一种有效的生态策略,然而,鱼类DCAC的产生及其行为应答本身是一种较为耗能的生理/生态过程[7,15-18]。在不同生活史阶段或特定生理状态下,鱼类往往面临基于能量供需的“觅食-避敌”、“生存-发育”等权衡(Trade-offs)。例如,Brown等[16]发现,黑头呆鱼(Pimephalespromelas)被饥饿48 h后对DCAC的行为应答缺失,而饱食组和短时饥饿组(12 h以内)的实验鱼却展示出显著的化学预警行为(包括增加的隐匿时间、增加的爆发游泳以及僵直行为等);类似地,McCormick等[17]发现,来自被食物剥夺的星塘鳢(Asterropteryxsemipunctatus)的DCAC不能够引发同种个体的化学预警响应,而来自饱食投喂组动物的DCAC却能够导致同种个体产生显著的化学预警响应,提示食物剥夺或能量赤字将对鱼类DCAC的产生以及行为应答造成不利影响。此外,发育早期的孔雀鱼仔鱼并不表现出对同生群个体CAC的行为应答,但发育14 d后的仔鱼却表现出显著的行为回避响应,提示发育早期生长优先的策略可能更有益于种群适合度的提高[3]。
鱼类进入繁殖状态需要较高的能量成本,能量储备被认为是雌性能否进入繁殖期的限制条件之一,只有贮存了足够能量的个体才能进入繁殖状态[19-21]。GSI通常被作为鱼类繁殖生理投入的核心指标用于相关研究[19,25]。由于繁殖期增大的GSI往往导致鱼体腹部显著凸起,增加其运动能耗并限制其逃逸能力[26-27],因此,对环境风险信息的识别与应答就至关重要。鉴于繁殖期鱼类的繁殖生理投入和化学预警响应均具有较高的能量需求,二者可能存在基于能量供需的生存-繁殖的权衡。那么,繁殖期鱼类的化学预警行为表现到底如何呢?早期的一些研究者发现黑头呆鱼等一些硬骨鱼类繁殖期DCAC的产生及其行为应答模式缺失。例如,繁殖期雄性黑头呆鱼产生DCAC的表皮棒状细胞缺失,无法产生DCAC,但雌性仍可通过棒状细胞产生[22];繁殖期不同性别的曲口鱼(Campostomaanomalum)产生DCAC的表皮棒状细胞均大量缺失,无法产生足够量的DCAC[23];Pollock等[28]发现,黑头呆鱼对来自繁殖期和非繁殖期雌性个体的DCAC的行为响应无显著差异,繁殖生理状况与反捕食行为无统计学意义上显著相关性,但与反捕食行为存在负相关趋势[28]。本研究发现,DCAC对高体鳑鲏、斑马鱼、孔雀鱼、皮球鱼4种不同繁殖生理投入(繁殖对策)的实验鱼的化学预警行为均有显著影响,具有最高繁殖投入的皮球鱼的化学预警响应不仅没有缺失而且没有弱化,研究结果不支持“假说一”;不仅如此,除了高浓度DCAC处理组皮球鱼的GSI与其底栖时间的变化呈现显著负相关,在皮球鱼的其它处理组以及其它鱼类中均未发现GSI与化学预警响应参数的变化有显著的相关性,结果提示高繁殖投入物种种内个体的化学预警响应可能存在繁殖投入-避敌表现的权衡,但这种权衡也仅在高风险环境下(例如高浓度DCAC)显著存在,研究结果仅在少有的特定情况下支持“假说二”。
本研究回答了长期以来有关繁殖期鱼类化学预警通讯是否缺失的问题。主要研究发现包括:(1)证实了繁殖期不同繁殖生理投入的4种淡水鱼类均有显著的化学预警响应;(2)揭示了鱼类GSI与其化学预警响应程度的内在关联(普遍不相关,仅在高风险环境下繁殖生理投入很高的物种中可能呈现负相关)。尽管DCAC对4种实验鱼的空间分布、活跃状态、逃逸行为等大部分化学预警响应参数均有不同程度的影响,但不同鱼类对DCAC的行为应答程度不尽相同。特别是,从图2中静止时间的变化、身体不重合度的变化等参数可以看出,随GSI增加,化学预警响应程度有增大的趋势。因此,在种间水平上,繁殖生理投入高的物种可能具有更为显著的化学预警响应。在种内水平上,总体上,DCAC导致实验鱼静止时间增加、运动距离和身体不重合度减少或有减少的趋势。可见,运动状态是指示几种鱼化学预警响应有效的行为参数。此外,不同行为参数对环境风险强度(DCAC浓度)的敏感性可能不同,高浓度和低浓度DCAC处理对高体鳑鲏和斑马鱼的身体不重合度有显著影响,但对其它所测行为参数均无显著影响,提示未来鱼类化学预警行为研究中,对行为应答程度的分级是必要的。
本研究所涉及的4种实验鱼不仅繁殖生理投入差异显著,而且繁殖对策也体现了多样性(其中高体鳑鲏和斑马鱼为卵生,孔雀鱼和皮球鱼为卵胎生),研究结果具有一定的代表性,对于深入理解鱼类繁殖与生存对策的权衡有一定的生态学意义,亦可望为行为生态学、保护与恢复生态学相关研究提供启发。不过,考虑到繁殖期鱼类的化学预警通讯可能受到多种内在调节机制和外界环境的影响,在与相关研究进行比较时,必须谨慎对待。首先,本研究所用实验鱼为来自实验室驯养的较长期缺乏天然捕食者的种群,在与野生种群的相关研究进行比较时应格外注意[5,28];其次,“个性”与鱼类的化学预警响应有关并且可能掩盖繁殖生理状态的效应[4],进而影响化学预警行为与生理状态的关联;再次,本实验所用几种鱼的繁殖行为相对较为温和,然而某些鱼类由于在繁殖期具有十分剧烈的筑巢、求偶、交配等行为而容易导致皮肤破损,对于那些鱼类而言,其DCAC暂时性/季节性缺失则又是合理的,以避免给予配偶错误信号,有助于提高繁殖成功率[29-30]。
