禽网状内皮组织增生症病毒感染雏鸡血液T细胞数量和细胞因子含量变化
2021-08-31张国勍高海婷刘超男高雪丽吕晓萍郑世民
张国勍,边 洋,高海婷,刘超男,高雪丽,吕晓萍,郑世民
(东北农业大学动物医学学院黑龙江省实验动物与比较医学重点实验室,黑龙江哈尔滨 150030)
家禽的肿瘤性疾病,依据性质可分为传染性肿瘤性疾病和非传染性肿瘤性疾病,其中非传染性肿瘤由于通常呈散发性,其仅影响动物福利,并不会对养殖业经济造成重大影响,而由致瘤病毒引起的传染性肿瘤性疾病由于传播广泛,且多数可引发家禽的免疫抑制,对养殖业的影响十分显著,所以对禽类致瘤病毒致病机制的研究有重要的科学理论和生产实际意义。禽网状内皮组织增生症(Reticuloendotheliosis,RE)是由逆转录病毒网状内皮组织增生症病毒(Reticuloendotheliosis virus,REV)感染引起的家禽和野禽的一种免疫抑制性、肿瘤性病毒性传染病。REV分为完全复制型和不完全复制型两种,完全复制型REV在实验室主要在鸡胚成纤维细胞内增殖并保持毒力,不完全复制型T株病毒经体内传代或在感染的造血细胞中培养仍可保持其致瘤性,但在鸡胚成纤维细胞上传代则很快丧失致瘤性[1]。REV感染引发雏鸡矮小病综合征,其特征是:患禽不但体型矮小,而且法氏囊和胸腺等免疫器官萎缩,网状内皮组织增生,周围神经肿大、肠胃炎、贫血及肝脾细胞坏死,免疫功能下降。羽毛异常在接种了被REV污染疫苗的鸡群中常常见到[2]。 REV感染还可在法氏囊和其他器官中诱发慢性淋巴样肿瘤,这些肿瘤是B细胞起源的,由myc癌基因插入激活引起。还有经试验诱导了T细胞来源的非囊性淋巴瘤,潜伏期短至6周,涉及胸腺、肝脏、心脏和脾脏。REV既可通过与感染鸡和火鸡接触水平传播,也可通过感染耐受禽的卵垂直传播[3]。急性网状细胞瘤由携带v-rel癌基因的REV缺陷T株引起,REV-T株最初从患有白血病的火鸡中分离获得。当REV-T株侵入到雏鸡体内时,其能诱导间充质干细胞或网状内皮细胞的快速增殖,并在1周~3周内导致雏鸡死亡。有研究表明,切除胸腺的雏鸡感染REV后病死率明显升高,说明细胞免疫在REV感染时起到了重要的保护作用[2]。REV感染雏鸡的免疫抑制程度呈年龄相关性,其中7日龄内被病毒感染雏鸡的免疫抑制最为严重,REV感染引起的免疫抑制还会使雏鸡易于感染其他致病微生物,或增强其他致病微生物的致病性[4]。REV易于与其他病毒混合感染,并可污染其他禽病疫苗而进行传播[5],故对于REV的防控较为困难。REV感染后,受感染动物常常呈现亚临诊症状,不易被兽医工作者和养殖者发现,所以加强对REV免疫致病机制的研究,对于防控REV传播和感染至关重要。本研究通过检测REV感染SPF雏鸡后1 d~21 d,外周血CD4+、CD8+T淋巴细胞的数量及CD4+/CD8+T淋巴细胞比值变化,以及免疫相关细胞因子含量变化,探讨REV感染对SPF雏鸡外周血液细胞免疫的抑制作用,为研究REV的免疫致病机制和兽医临诊防控该病提供一定的科学试验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 1日龄SPF混合雏鸡60只,购自哈尔滨兽医研究所SPF实验动物中心。
1.1.2 REV毒株 禽网状内皮组织増生症病毒(REV-T株),购自中国兽医微生物菌种保藏管理中心(CVCC No.CACCAV107)。
1.1.3 主要试剂 淋巴细胞分离液,灏洋生物制品科技有限公司产品;RPMI 1640 及胎牛血清,Gibco公司产品;TNF-α、IL-2、IL-4、IL-10的ELISA 试剂盒,南京金益柏生物科技有限公司产品;Mouse Anti-Chicken CD4+-FITC-抗荧光染料、Mouse Anti-Chicken CD8+-PE -抗荧光染料,美国 Southern Biotech 公司产品。
1.1.4 主要仪器 酶标仪(ELx808),美国Bio-Tek仪器有限公司产品;流式细胞仪(BD Aira Ⅱ),美国BD公司产品。
1.2 方法
1.2.1 实验动物分组及处理 1日龄SPF雏鸡60只,随机分为对照组(C组)和REV感染组(Ⅰ组),每组各30只。Ⅰ组雏鸡经腹腔感染REV稀释液(TCID50为10-462/0.1 mL)0.4 mL/只;C组雏鸡以同样方法给予等量灭菌PBS后,分别严格遵守SPF条件进行隔离饲养。
1.2.2 待检材料采取及处理 两组SPF雏鸡分别于病毒感染后第1、3、7、14、21天,每组随机选取6只雏鸡分别称重并记录后,进行心脏采血。其中3只雏鸡血液用于分离血清,分装后置-80℃保存,用于IFN-γ、IL-2、IL-4和IL-10含量检测。另3只雏鸡血液用于提取其外周血淋巴细胞,检测血液CD4+和CD8+亚型T淋巴细胞数量及2种亚型细胞数量比值的变化。
1.2.3 检测指标及方法
1.2.3.1 REV感染雏鸡外周血T淋巴细胞数量及CD4+与CD8+T淋巴细胞比值变化 取分离好的淋巴细胞(2×106个/mL)50 μL,每个样品中分别加入2 μL鼠抗鸡CD4+-FITC和鼠抗鸡CD8+-PE荧光抗体,冰上孵育30 min;孵育结束后加入1 mL PBS,4℃低温离心机以1 000 r/min离心两次,每次10 min。 最终加入0.5 mL PBS重悬细胞,使用流式细胞仪分别测定外周血中CD4+及CD8+T淋巴细胞数量所占有效细胞数量的百分比,并计算CD4+/CD8+T淋巴细胞比值。
1.2.3.2 REV 感染雏鸡外周血IL-2、IL-4、IL-10 及 IFN-γ含量检测 将待测血清样品取出,按照ELISA试剂盒说明书进行操作,最后使用酶标仪在450 nm波长段进行OD值检测。
1.2.4 数据处理分析 试验数据采用Graphpad Prism 8.0软件处理,t检验分析组间差异,P<0.01为差异极显著(**),P<0.05为差异显著(*)。
2 结果
2.1 各组雏鸡不同时间点血液CD4+和CD8+ T淋巴细胞数量及其比值变化
2.1.1 CD4+和CD8+T淋巴细胞数量变化 结果见图1和图2。Ⅰ组雏鸡血液CD4+T淋巴细胞在第1天~第21天时,数量均显著低于对照雏鸡(P<0.05或P<0.01);CD8+T淋巴细胞在第7天时,数量明显增加(P<0.01),但其余时间点数量均显著低于对照雏鸡(P<0.05或P<0.01)。
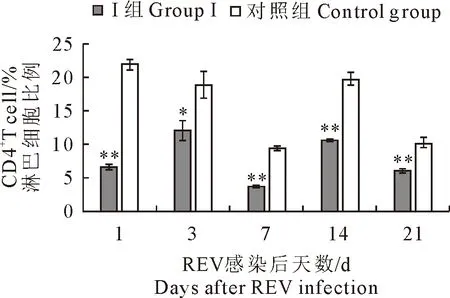
图1 各组雏鸡血液CD4+T淋巴细胞数量变化
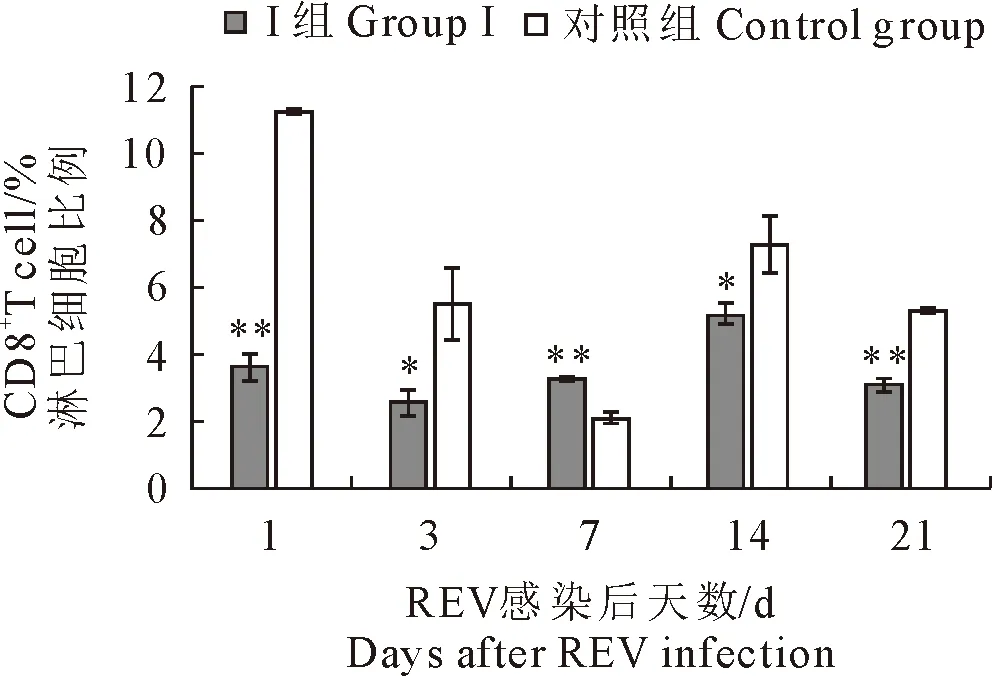
图2 各组雏鸡血液CD8+T淋巴细胞数量变化
2.1.2 CD4+与CD8+T淋巴细胞比值变化 结果见图3。与C组雏鸡相比较,Ⅰ组雏鸡血液CD4+与CD8+T淋巴细胞比值在第3天显著增加(P<0.05),在第7和第14天显著或极显著降低(P<0.05或P<0.01),其余差异不显著(P>0.05)。
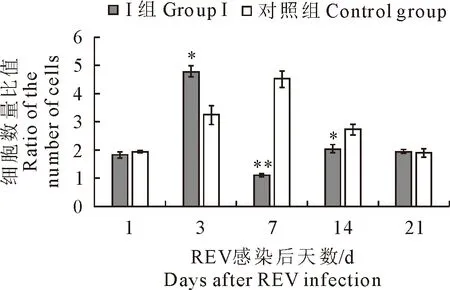
图3 各组雏鸡血液CD4+与CD8+T淋巴细胞比值变化
2.2 各组雏鸡血清免疫相关细胞因子含量变化
2.2.1 血清IFN-γ和IL-2含量变化 结果见图4和图5。与C组雏鸡相比,Ⅰ组雏鸡血清IFN-γ在第7天时含量极显著升高(P<0.01),第3天和第14天时含量极显著降低(P<0.01),其余被检时间点虽然Ⅰ组雏鸡低于相应对照雏鸡,但差异不显著(P>0.05);血清IL-2在第1、3、7、14天时含量显著或极显著减少(P<0.05或P<0.01),第21天差异不明显(P>0.05)。

图4 各组雏鸡血清IFN-γ含量变化

图5 各组雏鸡血清IL-2含量变化
2.2.2 血清IL-4和IL-10含量变化 结果见图6和图7。Ⅰ组雏鸡血清IL-4在第1天~第14天时含量均不同程度的高于对照雏鸡,其中在第3和第7天与对照比较差异极显著(P<0.01),其余差异不显著(P>0.05);Ⅰ组雏鸡血清IL-10在第1天~第14天时含量均不同程度高于对照雏鸡,其中第3天~第14天与对照比较差异显著(P<0.05),第21天时含量略低于对照雏鸡,但差异不显著(P>0.05)。

图6 各组雏鸡血清IL-4含量变化
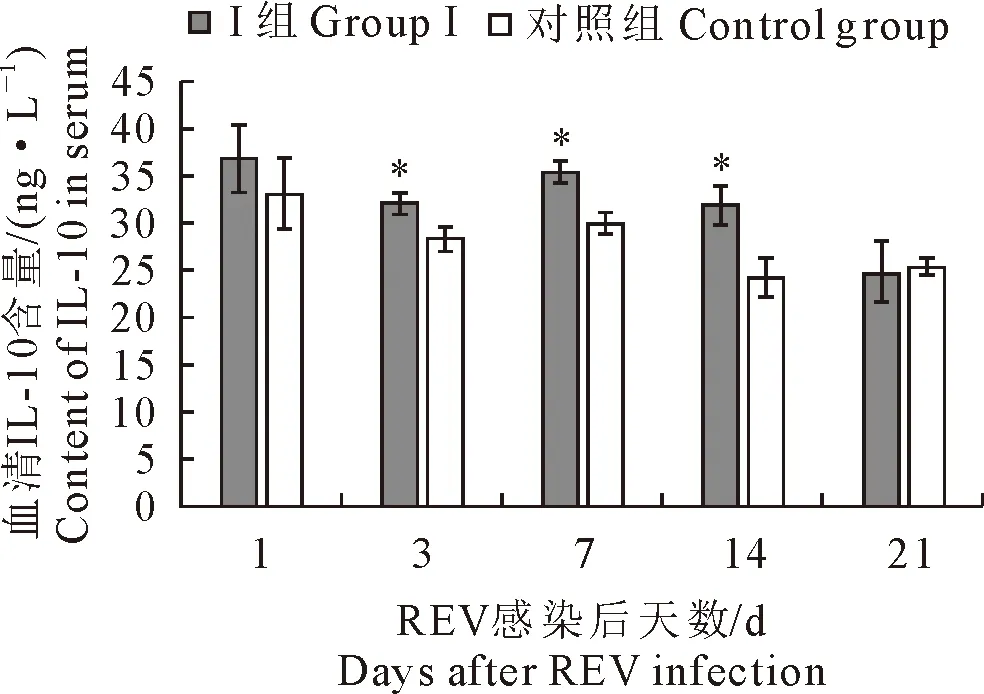
图7 各组雏鸡血清IL-10含量变化
3 讨论
T淋巴细胞在抵抗病原感染中,具有非常重要的作用,当机体的免疫功能异常(抑制或增强)时,T淋巴细胞及其亚群数量和比例会发生明显变化,从而降低或提升机体的抗感染能力。综合目前已有的研究资料,虽然对鸡T淋巴细胞的MHC限制性、CD4+辅助性T淋巴细胞和CD8+细胞毒性T淋巴细胞群体功能的研究尚未透彻,但已有大量证据表明,在哺乳动物研究中确立的概念也适用于鸡。例如,鸡感染传染性支气管炎病毒(Infectious bronchitis virus,IBV)后,其MHC限制性CD8+T淋巴细胞被鉴定为效应细胞[6]。另外,在REV感染靶细胞的体外实验研究中,也证明细胞毒性T淋巴细胞具有MHC限制性,且为CD8+T淋巴细胞;在利用单克隆抗体对CD4+和CD8+T淋巴细胞系进行功能分析后发现,上述2个细胞群体都参与了对REV的细胞毒性T淋巴细胞反应[7];对携带MDV基因的REV转化细胞系的分析,也为鸡T淋巴细胞的MHC限制性提供了有力证据[8]。本试验研究对象是效应性T淋巴细胞,即CD4+T淋巴细胞和CD8+T淋巴细胞,其中CD4+T淋巴细胞可分为Th1和Th2等不同亚型,通过分泌可执行各自功能的细胞因子,调控机体的免疫功能,分别参与机体的细胞免疫和体液免疫反应;CD8+T淋巴细胞主要通过细胞毒作用发挥其细胞免疫功能,杀伤细胞内感染微生物的靶细胞[9-10]。CD4+T淋巴细胞数量多少在一定范围内可反应其免疫调节能力的强弱; CD8+T淋巴细胞数量的增减代表其细胞免疫能力的高低,故通过检测CD4+T淋巴细胞和CD8+T淋巴细胞数量,并计算两者的比值变化,可判断机体的免疫功能的变化状况。有研究发现,传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)感染雏鸡后,其血液CD4+和CD8+T淋巴细胞数量均显著降低,REV感染雏鸡主要免疫器官的CD4+和CD8+T淋巴细胞数量也呈现一定程度的降低,说明IBDV和REV感染雏鸡后,都是通过减少机体CD4+和CD8+T淋巴细胞数量,产生免疫抑制效应,最终导致机体免疫功能低下[11-12]。本研究发现,REV感染SPF雏鸡血液CD4+T淋巴细胞在整个试验期间均明显低于对照雏鸡,CD8+T淋巴细胞数量除病毒感染后第7天外,而CD4+与CD8+T淋巴细胞比值呈现出先明显升高然后显著降低的变化,表明REV感染使雏鸡血液T淋巴细胞数量显著减少,造成雏鸡细胞免疫水平降低,免疫功能紊乱。其中,第7天时感染组雏鸡CD8+T淋巴细胞数量异常增加,可能是由于REV感染初期,雏鸡免疫系统受抑制较小,其胸腺仍可发挥正常的免疫功能,在REV感染刺激后,大量CD8+T淋巴细胞在胸腺中分化成熟并进入血液,以加强自身的免疫能力,本试验结果中血清IFN-γ含量在第7天时也显著高于对照雏鸡,与该结果相符,但随着感染的持续,REV造成的免疫抑制增强,故CD8+T淋巴细胞数量显著减少。一般情况下,CD4+/CD8+值代表动物机体免疫功能的情况,若其比值过高,表明动物机体免疫功能增强,而其比值过低,则表明机体发生了免疫抑制,本实验中CD4+/CD8+值呈现先升高后降低,可能是由于REV感染雏鸡初期,免疫抑制效应不强,仅作为病原体激活了机体的免疫应答,而感染中后期REV感染的免疫抑制作用增强,导致雏鸡发生了免疫抑制,故CD4+/CD8+值在中后期降低。
鸡的IL-2基因位于第4号染色体上[13],鸡体内高表达IL-2时,其外周血CD4+和CD8+T淋巴细胞的数量显著增加,且已被证实是由于细胞增殖所引起,故IL-2是影响鸡T淋巴细胞增殖的关键因子[14-15]。有研究发现,REV感染动物后可通过降低雏鸡免疫细胞IL-2R表达,引起雏鸡免疫抑制[16-17],本研究中REV感染雏鸡外周血中IL-2含量从病毒感染后第1天~第14天均低于对照雏鸡,表明REV通过减少IL-2含量使T淋巴细胞增殖能力减弱,从而造成雏鸡免疫功能降低。有研究表明,对细胞内病原体起主要作用的细胞因子是IFN-γ,对细胞外病原体起主要作用的细胞因子是IL-4和IL-13,例如,鸡对NDV和IBDV的免疫反应中IFN-γ起主要作用,对蛔虫病的免疫反应则IL-4和IL-13起主要作用[18],故认为IFN-γ不但是Th1控制免疫应答的关键性标志细胞因子,而且也是控制细胞内病原体感染的关键因子,IL-10在鸡体内的功能十分保守,仅作为一种抗炎细胞因子,下调了IFN-γ的作用[19-21]。本研究发现,REV感染SPF雏鸡外周血液IFN-γ除第7天外,其余被检时间点均低于对照雏鸡,说明REV感染抑制了IFN-γ表达以发挥减少巨噬细胞活化、抑制T淋巴细胞分化等免疫抑制作用[22]。李广兴等[23]研究也表明,REV感染可造成雏鸡胸腺和脾脏IL-2以IFN-γ含量降低。但刘丹华等[24]研究发现,REV感染雏鸡局部黏膜免疫组织IL-2和IFN-γ含量在病毒感染过程中均高于对照雏鸡,本试验血清中上述两种因子检测结果变化趋势与其有所不同,分析产生该差异的原因,可能是由于REV感染引起的免疫抑制并未波及其局部黏膜免疫组织。IL-4可提高B细胞MHC Ⅱ类抗原的表达,增强B淋巴细胞的抗原提呈能力,促进机体体液免疫水平,但同时也可抑制IL-1和TNF-α等的产生,抑制了细胞免疫水平,降低了机体对病毒等生物性致病因素的抵抗能力。本试验中REV感染SPF雏鸡外周血液中IL-4和IL-10含量在病毒感染后第1天~第14天均不同程度高于对照雏鸡,表明REV感染可抑制雏鸡细胞免疫功能。综上所述,REV可减少雏鸡血液各类型T淋巴细胞数量,显著降低雏鸡外周血细胞免疫水平和免疫调节能力,同时减少其免疫效应因子含量,增加其免疫抑制因子含量,造成雏鸡的免疫抑制。
REV感染可减少SPF雏鸡血液IFN-γ和IL-2等免疫增强因子,增加IL-4和IL-10等免疫抑制因子含量,降低雏鸡外周血液CD4+和CD8+T淋巴细胞数量,上述病理改变与REV感染雏鸡免疫抑制的发生密切相关。
