新疆某地区3个牧场布鲁氏菌病流行状况调查及分析
2021-08-31邓肖玉易继海陈创夫
杨 琴,邓肖玉,张 欢,易继海,王 勇,张 倩,王 震,陈创夫*
(1.石河子大学动物科技学院,新疆石河子 832000;2.人兽共患传染性疾病防治协同创新中心,新疆石河子 832000;3.新疆农垦科学院省部共建绵羊遗传改良与健康养殖国家重点实验室,新疆石河子 832000;4.动物疫病防控兵团重点实验室,新疆石河子 832000)
新疆是我国重要的畜牧基地,也是养殖反刍动物的重要省份。2017年,新疆的牛肉产量(43万吨)及羊肉产量(58万吨)分别占全国牛肉及羊肉总产量的6.8%和12.4%[1-2]。新疆肉牛、羊养殖业的主要产区往往在南疆、北疆部分偏远地区,畜牧业作为当地的支柱性产业,是农牧民收入的主要来源[3-4]。布鲁氏菌病(简称“布病”)是一种由布鲁氏菌感染引起的人兽共患传染病,家畜感染后常表现为流产及繁殖障碍,严重影响生产性能,对人类健康及畜牧经济造成极大危害[5-6]。新疆一直是传统的布病流行区[7-8]。自20世纪80年代,有效的防控策略已使布病疫情得到基本控制,但进入21世纪后,布病再次卷土重来[9],新疆布病疫情也出现抬头趋势[10-11],2013年,养殖人员及畜产品销售加工人员的布病感染率明显上升[12],而带菌动物是人类布病的主要传染源,人往往通过直接接触感染动物或食用未加工消毒的牛奶及奶制品而感染。人间布病疫情形势严峻。病原学监测显示,羊种布鲁氏菌是诱发人患布病的主要菌种[13]。
为了解新疆某地牛、羊感染布病的情况,为布病的预防、控制及净化提供科学依据,本研究通过布病血清学诊断(虎红平板凝集试验)、分子生物学检测及分子流行病学分析,2017年-2018年对新疆某偏远地区的牛、羊开展布鲁氏菌流行病学调查。
1 材料与方法
1.1 材料
1.1.1 样品来源及保存 2017年-2018年的春季,在新疆某偏远地区选择3个操作便利,且对当地牛、羊养殖具有代表性的牧场,采用简单随机抽样的方法对3个牧场的牛、羊进行颈静脉采血,采集对象为饲养2周龄以上且未经布鲁氏菌疫苗接种的牛、羊。共采集有效血液样本2 996份,其中牧场A采集血液样本为牛354份,羊351份;牧场B牛342份,羊361份;牧场C牛710份,羊878份,所有血样置4℃短暂保存,分离血清后置-20℃保存;收集疑似病例的流产胎儿样本141份,其中包括牛流产胎儿66份、羊流产胎儿75份,置-20℃保存;另收集生鲜乳样本85份,其中包括牛生鲜乳65份及羊生鲜乳23份,置4℃保存。
1.1.2 主要试剂 基因组提取试剂盒、TaqPCR聚合酶,北京天根生化科技有限公司产品;DNA Marker,TaKaRa公司产品;布鲁氏菌病虎红平板凝集试验抗原及布鲁氏菌标准阴、阳性血清由中国兽医药品监察所提供。
1.1.3 主要仪器设备 可调移液器,德国艾本德有限公司产品;DYY 6C型电泳仪,北京六一生物科技有限公司;高速冷冻离心机、PCR仪,美国赛默飞世尔科技有限公司产品;琼脂糖凝胶成像仪,美国伯乐生物科技有限公司产品。
1.2 方法
1.2.1 引物合成 布鲁氏菌PCR鉴定引物[14]由上海生工生物工程技术服务有限公司合成,引物序列见表1。

表1 引物
1.2.2 血清的制备、病料的处理及DNA提取 采集的血液样本置于室温环境下(18℃~25℃)静置4 h,使用5 000 r/min离心5 min后分离血清,保存于-20℃备检;按照试剂盒说明书提取流产胎儿的肝脏、脾脏(均各取一小片组织约0.5 g并充分研磨)及生鲜乳样本的DNA,样品置-20℃保存。
1.2.3 布鲁氏菌病血清学检测 在玻璃板上标记好待检血清号,分别加入30 μL相应血清和30 μL抗原,混匀后平铺约2 cm,3 min后肉眼观察凝集情况,同时设定阴、阳性对照。判定标准如下:出现肉眼可见凝集现象则初步判定为布鲁氏菌阳性,无凝集现象判定为阴性。
1.2.4 布鲁氏菌的PCR筛查 以上述提取的全基因组DNA为模板,用布鲁氏菌鉴定引物omp22进行PCR扩增。PCR反应体系(10 μL):TaqPCR聚合酶5 μL,上、下游引物各0.2 μL,高压灭菌水3.6 μL,模板1 μL。PCR反应条件:95℃ 5 min;94 ℃ 15 s,55 ℃ 40 s,72℃ 40 s,循环数35;72℃ 10 min。PCR产物通过琼脂糖凝胶电泳验证,筛选布鲁氏菌阳性样本。
1.2.5 布鲁氏菌的种属鉴定 以上述阳性样本的DNA为模板,用布鲁氏菌鉴定引物IS711进行PCR扩增,PCR反应体系(40 μL):TaqPCR 聚合酶20 μL,上、下游引物各0.8 μL,高压灭菌水14.4 μL,模板4 μL。PCR反应条件:95℃ 5 min;95℃ 2 min,55℃ 2 min,延伸72℃ 2 min,循环数30;72℃ 10 min。取10 μL PCR产物经琼脂糖凝胶电泳验证。
1.2.6 系统进化树分析 取上述IS711扩增的PCR产物约30 μL置于无菌EP管中,封口膜封闭后送上海生工生物工程技术服务有限公司进行纯化和测序。使用分子进化遗传分析软件(MEGA)对引物IS711扩增出的基因序列进行分析。
2 结果
2.1 布鲁氏菌病的血清学检测
结果见表2。从新疆某地牧场A、牧场B和牧场C共采集了2 996份血清样本,其中包括牛血清样本1 406份及羊血清样本1 590份,通过RBPT初步筛选。结果显示,3个牧场RBPT平均阳性率为牛6.8%,羊9.5%,其中牧场A阳性率为牛7.1%,羊9.1%;牧场B阳性率为牛11.7%,羊10.8%;牧场C阳性率为牛4.2%,羊9.1%。
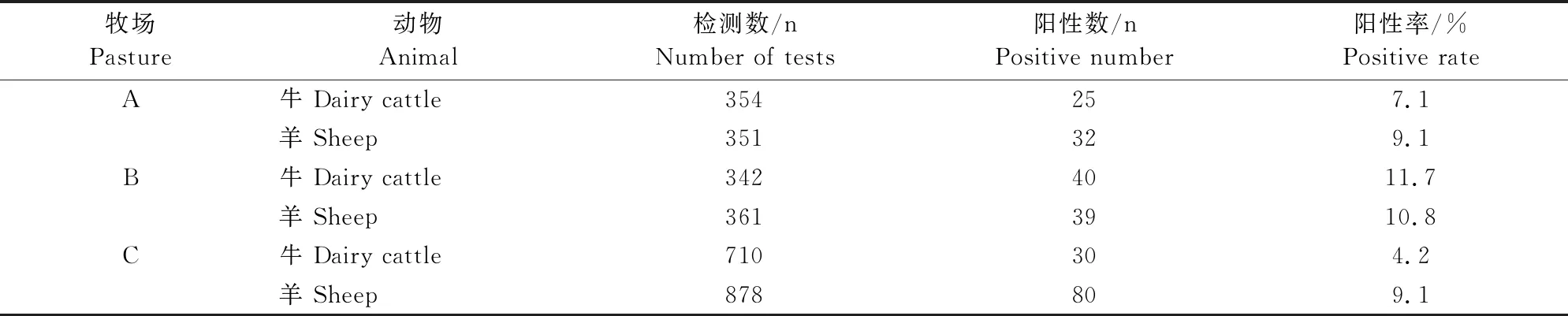
表2 虎红平板凝集检测结果
2.2 布鲁氏菌的PCR筛查
结果见表3。将牛流产胎儿66份、羊流产胎儿75份、牛生鲜乳42份及羊生鲜乳23份经DNA提取后以布鲁氏菌omp22为引物进行PCR扩增,结果显示,共检测出布鲁氏菌PCR阳性样本54份,其中包括牛流产胎儿22份、羊流产胎儿30份、牛生鲜乳1份以及羊生鲜乳1份。流产胎儿布鲁氏菌PCR检出率为牛33.3%,羊40%;生鲜乳检出率为牛2.4%,羊4.3%。

表3 布鲁氏菌的PCR鉴定结果
2.3 布鲁氏菌的种属鉴定
结果见图1(仅展示部分结果)。用IS711引物对上述PCR阳性样本进行进一步的PCR扩增,共检测出38份阳性样本,其中包括牛流产胎儿16份、羊流产胎儿20份、牛生鲜乳1份及羊生鲜乳1份。琼脂糖凝胶电泳结果显示,1~13和15~17均扩增出731 bp的条带,与羊种布鲁氏菌阳性对照条带大小一致,鉴定为羊种布鲁氏菌。

M.DNA标准DL 1 000;1~17.PCR扩增产物;18.羊种布鲁氏菌阳性对照;19.牛种布鲁氏菌阳性对照;20.阴性对照
2.4 系统进化树分析
结果见图2。取上述PCR产物进行纯化和测序,基于测序后的IS711基因序列构建系统进化树,已完成测序的IS711序列已存入GeneBank数据库(IS711:MK913893-MK913898)。进化树分析结果显示,本研究所鉴定出的羊种布鲁氏菌与内蒙古地区、挪威及印度等国分离出的羊种布鲁氏菌生物3型菌株关系最为密切。
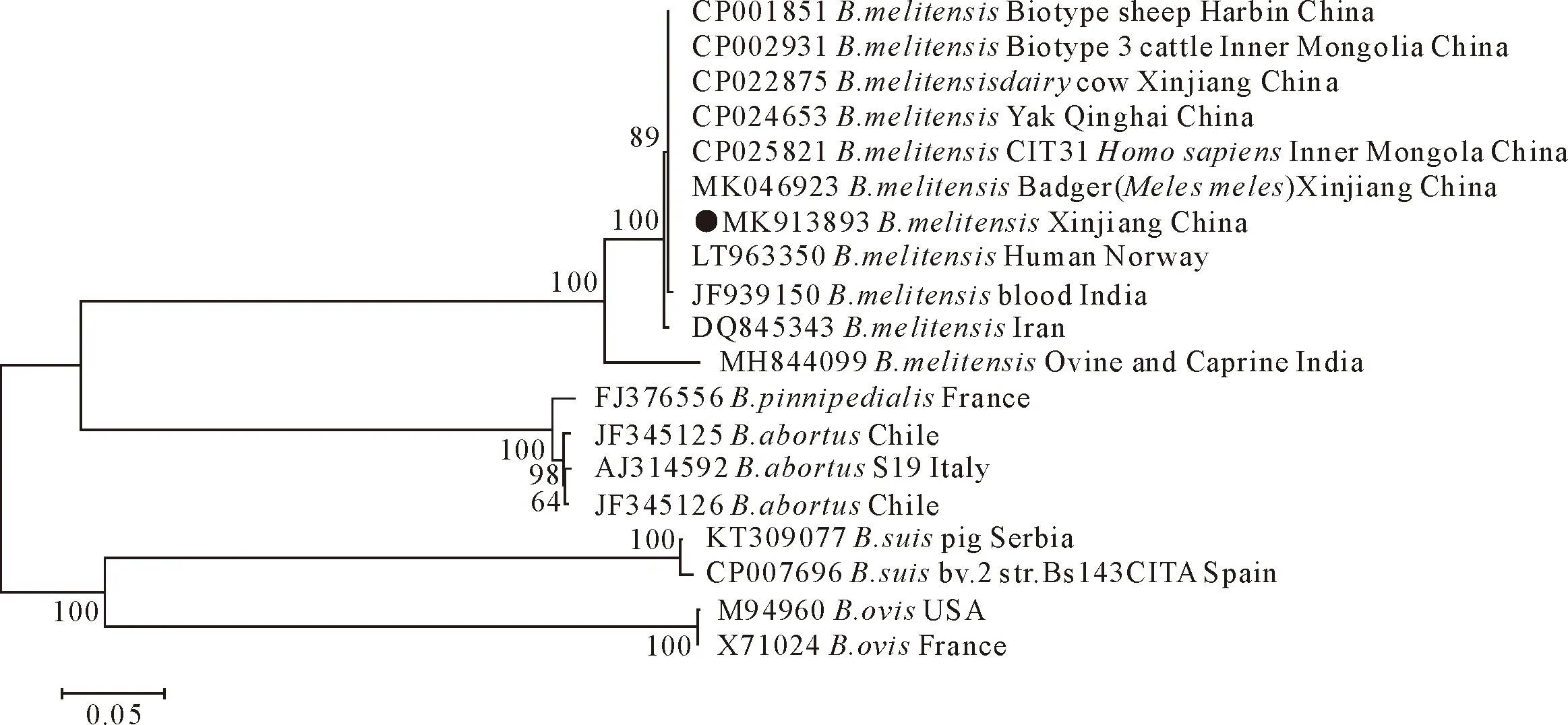
图2 布鲁氏菌IS711基因序列的系统进化树
3 讨论
畜牧业是新疆历史悠久的传统产业,也是当地农村经济的重要组成部分,尤其在新疆部分偏远地区,畜牧养殖往往是其经济增长的主要来源。然而,关于这些地区布病的流行病学调查及病原学研究较少。研究表明,2014年新疆伊犁地区的牛、羊布病阳性率分别为1.72%和1.95%[15]。据伊犁市动物疾病与预防控制中心提供的数据显示,2015年该地区的牛、羊布病阳性率分别为6.91%和4.21%,同样也有调查显示,2015年新疆阿勒泰地区的牛、羊布病阳性率分别为4.09%和3.45%[5]。由此可见,虽然国家已制定了畜群疫苗接种的布病防治规划,且将新疆划为重点布病防控区,但新疆部分地区畜群间布病疫情仍呈现上升趋势。本研究调查了新疆某偏远地区3个牧场牛、羊布病感染情况,采用RBPT对2 996份牛、羊血清进行初步筛选。结果表明,该地区3个牧场RBPT平均阳性率为牛6.8%,羊9.5%,其中牧场A阳性率为牛7.1%,羊9.1%;牧场B阳性率为牛11.7%,羊10.8%;牧场C阳性率为牛4.2%,羊9.1%。这些数据表明,布病极大可能已在该地区广泛流行,并可能已经感染了该地区的所有易感牲畜,应引起相关部门的高度重视。此外,本次筛查结果显示,牧场B的RBPT阳性率最高达到11.7%,牧场C最低阳性率为4.2%,出现这种现象的原因可能是由于本次试验的采样点不均匀,且3个牧场的检疫和淘汰力度不同,造成阳性率出现较大差异。
布病的主要传染源是患病及带菌家畜,患病的妊娠母畜是尤其危险,在流产或分娩的一系列过程中,胎儿、胎衣及羊水的排出常常掺杂着大量的布鲁氏菌[16],造成草场、畜舍等周边环境的污染,易感动物和人接触到以上污染物,就可通过消化道、呼吸道、生殖道以及损伤的皮肤、黏膜而感染[17]。PCR是常用的布病诊断方法[18-19]。本研究通过PCR检测从牛、羊流产胎儿中筛选出大量布病阳性样本,一方面提示布鲁氏菌感染是造成该地区牛、羊流产的一个重要因素,带菌的妊娠母畜及其流产胎儿是污染源和传染源;另一方面也提示养殖人员在进行家畜的接产时要格外注意做好自身防护,以防感染。除带病家畜的分泌物、排泄物及流产胎儿中含有大量的布鲁氏菌外,其生鲜乳中同样带有相当数量的布鲁氏菌,是极其危险的传染源之一[20]。陕西发生多起因饮用未经消毒的生鲜羊乳而发生布病感染的事件[21],更进一步说明生鲜乳作为布病的重要传染源,给人类的健康带来了严重隐患。本研究在牛生鲜乳及羊生鲜乳中均鉴定出了羊种布鲁氏菌,表明牛、羊感染羊种布鲁氏菌已成为我国一个重大的公共卫生问题。患病的牛、羊作为传染源,可通过其污染性生鲜乳的流通传播疾病,严重威胁畜牧业的发展和人类健康。因此,当地相关部门应加强对生鲜乳及各类动物产品的布病检疫,坚决杜绝检疫不合格的产品流向市场。
不同种的布鲁氏菌有其一定的寄生宿主,比如羊种菌多寄生在羊只,牛种菌多寄生于牛。但也常发现有宿主转移现象,即羊种菌可能转移到牛、猪,或相反[22-23]。有研究表明,新疆伊犁某地牛流产胎儿中可分离出羊种布鲁氏菌[24]。本研究通过PCR检测从16份牛流产胎儿、20份羊流产胎儿、1份牛生鲜乳以及1份羊生鲜乳样本中共鉴定出38份羊种布鲁氏菌。有趣的是,16份牛流产胎儿样本中均扩增出了羊种布鲁氏菌,而这16份牛流产胎儿样本中有10份取自牛、羊混养牧场,表明混合饲养的养殖方式可能造成了布鲁氏菌寄生宿主的转移,提示当地牧民应适当改变传统饲养方式,加强对科学饲养管理模式的学习。此外,本研究基于PCR阳性样本基因序列构建系统进化树进行分析,发现羊种布鲁氏菌是该地区牛、羊感染布病的优势菌种,且与内蒙古地区、印度和挪威等国分离的羊种布鲁氏菌生物3型序列相似度极高,这一方面说明羊种布鲁氏菌的致病力和侵袭力很强,可能成为世界范围内的流行菌种;另一方面也提示,若需引进种畜或补充畜群时,要避免来自这些国家或地区的家畜。总之,本研究通过调查新疆某偏远地区的牛、羊布病流行情况,发现该地区畜间布病疫情形式严峻,羊种布鲁氏菌是引起该地区牛、羊布病的主要菌种。因此,加强该地区的布病监测及检疫力度,高效实施特定疫苗接种计划,鼓励当地农牧民学习并采用科学的管理制度是当务之急。