二烯丙基二硫化物诱导MDCC-MSB-1细胞的凋亡及Fas/FasL信号通路调控作用
2021-08-31王宜平周鹏飞叶正钦李真诚唐清秀纪春晓
王宜平,周鹏飞,叶正钦,李真诚,唐清秀,纪春晓,2*
(1.湖南农业大学动物医学院,湖南长沙 410128;2.湖南省兽药工程技术研究中心,湖南长沙 410128)
马立克氏病(Marek's disease,MD)是由致瘤性马立克氏病病毒(Marek's disease virus,MDV)Ⅰ型毒株引起,其致瘤相关的基因有meq基因、抑瘤基因P53、细胞周期抑制蛋白P21、端粒酶、双向启动子pp38/pp24基因与1.8 kb基因家族、Vil-8基因及miRNA[1]等。MDV野毒株在疫苗的防御机制下已逐渐出现点突变和多态性变化,导致疫苗不能有效地抵抗MDV的攻击从而引起免疫失败,给国内外的养鸡行业造成了严重的经济损失[2]。研究表明,MD发病机理分为4个阶段,即早细胞溶解期、潜伏期、晚细胞溶解期和增生期。首先,MDV将自身VP23蛋白编码为一种新型免疫调节剂,阻断环GMP-AMP合成酶和干扰素基因刺激物诱导的β干扰素(interferon-β,IFN-β)的活化,并且选择性抑制IFN调节因子7(interferon regulator factor 7,IRF7),阻断其与TANK结合激酶1(TANK binding kinase-1,TBK1)的结合,进而抑制IRF7磷酸化和核易位,从而降低IFN-β的产生,攻克宿主先天免疫防御的第一道防线I型干扰素反应[3]。其次操纵宿主细胞的新陈代谢,劫持宿主细胞的糖酵解和谷氨酰胺分解无反应性底物,以提供MDV复制所需的能量和大分子[4]。然后在感染MDV的6 d(dpi)进入早细胞溶解期,即B细胞溶解期,胸腺中大多数感染的细胞发生凋亡,而法氏囊中是大多数未感染的细胞发生凋亡造成原发性淋巴器官萎缩,引起严重的B淋巴细胞减少[5]。再次是潜伏期,当细胞不依赖于线粒体β-氧化时,最佳的MDV复制就会重新启动激活[6],进入晚细胞溶解期,病毒已被逐渐放大并转移至T细胞,机体免疫力受到抑制[7]。最后是增生期,MDV作用于CD4+T淋巴细胞,从而诱导致命的淋巴瘤[8]。
二烯丙基二硫化物(diallyl disulfide,DADS)对多种恶性肿瘤细胞有抑制增殖、侵袭、转移和诱导分化凋亡等作用,如人骨肉瘤[9]、白血病[10]、宫颈癌[11]、胃癌[12]、结直肠癌[13]、卵巢癌[14]、肺癌[15]、乳腺癌[16]。我国药典上称大蒜素为二烯丙基三硫化物(diallyl trisulfide,DATS)是不准确的,首先大蒜素中有效成分有很多,DADS为其中之一;然后DADS与DATS活性相当;接着暴露在空气中,DADS稳定性强,而DATS易分解;最后DADS毒性小于DATS[17]。为了阐释DADS诱导马立克氏病肿瘤细胞(Marek's lymphoma cell line,MDCC-MSB-1)凋亡的作用机制,试验通过检测DADS对MDCC-MSB-1细胞的活力、形态学、caspase-8蛋白酶活性增加比、Fas/FasL信号通路相关因子mRNA转录水平变化,以探究其诱导凋亡机制,为病毒性肿瘤病的治疗提供比较医学基础。
1 材料与方法
1.1 材料
1.1.1 试验用细胞 马立克氏病肿瘤细胞系MDCC-MSB-1细胞为哈尔滨兽医研究所惠赠。
1.1.2 药品与试剂 二烯丙基二硫化物(DADS),Fluka公司产品;吐温-80,天津恒兴化学试剂有限公司产品;RPMI 1640培养基,美国HyClone公司产品;胎牛血清(FBS),四季青生物工程材料有限公司产品;青霉素、链霉素,赛因百奥生物技术有限公司产品;二甲基亚砜(DMSO)、PBS缓冲液、Hoechst 33342染色液、caspase-8活性测定试剂盒、Bradford蛋白浓度测定试剂盒,北京索莱宝生物科技有限公司产品;CCK-8试剂盒,美国GenView公司产品;总RNA提取试剂,Takara公司产品;氯仿、异丙醇、无水乙醇,国药集团化学试剂有限公司产品;RT-PCR SuperMix、qPCR SuperMix,北京全式金生物技术有限公司产品。
1.1.3 仪器设备 二氧化碳培养箱,赛默飞世尔科技公司产品;OptiClean 1300超净工作台,力康生物医疗科技控股有限公司产品;AE2000倒置荧光显微镜,Olymopus公司产品;318C+酶标仪,上海沛欧分析仪器有限公司产品;Neofuge 13R高速冷冻离心机,力康生物医疗科技控股有限公司产品;核酸测定仪,德国 IMPLEN产品;DYY-2C 琼脂糖凝胶电泳仪,北京六一生物科技有限公司产品;Tanon-3500凝胶成像分析仪,上海天能科技有限公司产品;PCR仪器、CFX ConnectTM荧光定量PCR仪,美国伯乐公司产品。
1.2 方法
1.2.1 二烯丙基二硫化物的制备 DADS试剂与Tween-80以1∶2的比例配制成母液,试验母液浓度为18 230 μmol/L,用无菌生理盐水稀释成400、800、1 600、2 400 μmol/L不同浓度的溶液,置-20℃条件下冻存备用。
1.2.2 不同浓度二烯丙基二硫化物作用MDCC-MSB-1细胞不同时间的抑制率 取对数生长期MDCC-MSB-1细胞,完全培养基调整细胞浓度为1.2×105个/mL,设置空白组(90 μL完全培养基+10 μL生理盐水),对照组(90 μL细胞悬液+10 μL生理盐水)和试验组(90 μL细胞悬液+10 μL不同浓度的DADS(使得DADS终浓度为40、80、160、240 μmol/L)),于96孔细胞培养板中,每组设置3个复孔,置于37℃、体积分数为5% CO2恒温培养箱,分别培养24、48、72 h,在到达培养时间时每孔加入10 μL CCK-8溶液再放入培养箱内孵育4 h,于酶标仪上检测OD450 nm值,根据OD值计算抑制率。
抑制率=[OD(对照组)-OD(试验组)]/[OD(对照组)-OD(空白组)]×100%
1.2.3 不同浓度二烯丙基二硫化物作用MDCC-MSB-1细胞24 h后形态学观察 取对数生长期MDCC-MSB-1细胞,完全培养基调整细胞浓度为6×105个/mL,设置对照组(1.8 mL细胞悬液+200 μL生理盐水)和试验组(1.8 mL细胞悬液+200 μL不同浓度的DADS(使得DADS终浓度为80、160、240 μmol/L)),于6孔细胞培养板中,置于37℃、体积分数为5% CO2恒温培养箱培养24 h后,置于显微镜下观察细胞形态并拍照。然后2 000 r/min离心5 min,弃掉上清液,用1 mL的Hoechst 33342染色工作液吹匀细胞沉淀,置于37℃、体积分数为5% CO2恒温培养箱再孵育20 min,PBS清洗细胞1遍后,置于荧光显微镜下观察细胞形态并拍照。
1.2.4 不同浓度DADS作用MDCC-MSB-1细胞24 h后caspase-8蛋白酶活性检测 根据Bradford蛋白浓度测定试剂盒和caspase-8活性测定试剂盒说明书测出BSA标准蛋白和ρNA底物的标准曲线。取对数生长期MDCC-MSB-1细胞,完全培养基调整细胞浓度为6×105个/mL,设置对照组(2.7 mL细胞悬液+300 μL生理盐水)和试验组(2.7 mL细胞悬液+300 μL不同浓度的DADS(使得DADS终浓度为80、160、240 μmol/L)),于6孔细胞培养板中,置于37℃、体积分数为5% CO2恒温培养箱培养24 h后,将细胞裂解根据BSA标准蛋白曲线检测提取的细胞蛋白浓度,达到1 mg/mL~3 mg/mL后采用低酶反应体系(60 μL反应缓冲液,35 μL待测样品,5 μL IETD-ρNA底物),加入96孔板中,每组3个复孔。盖紧96孔板并用封口膜密封,置于37℃、体积分数为5% CO2恒温培养箱培养2 h,于酶标仪上检测OD405 nm值,根据OD值计算caspase-8活性增加的百分比。
活性增加的百分比=[OD(试验组)/OD(对照组)]×100%
1.2.5 不同浓度二烯丙基二硫化物作用MDCC-MSB-1细胞24 h后Fas/FasL信号通路因子mRNA的转录水平检测 登录GenBank,根据已有的鸡Fas、FADD、caspase-8、Bid、caspase-3和内参基因β-actin mRNA核苷酸序列,利用Premier 5.0软件设计相对应的引物,由擎科生物有限公司合成,所用引物序列(表1)。取对数生长期MSB-1细胞,完全培养基调整细胞浓度为6×105个/mL,设置对照组(2.7 mL细胞悬液+300 μL生理盐水)和试验组(2.7 mL细胞悬液+300 μL不同浓度的DADS(使得DADS终浓度为80、160、240 μmol/L)),于6孔细胞培养板中,置于37℃、体积分数为5% CO2恒温培养箱培养24 h后,将细胞裂解提取总RNA,逆转录,普通PCR验证cDNA是否转录成功,凝胶电泳拍照以及荧光定量PCR仪上扩增,共40个循环,每个样品3个重复。

表1 引物信息
1.2.6 数据统计分析 试验数据均采用SPSS 22.0软件进行统计,以单因素多重比较分析差异性,其中P<0.05差异显著,P<0.01差异极显著。采用Excel和GraphPad Prism 7.0软件作图。
2 结果
2.1 不同浓度二烯丙基二硫化物作用MDCC-MSB-1细胞不同时间的抑制率
通过不同浓度的DADS作用MDCC-MSB-1细胞不同时间,于酶标仪上检测其OD450 nm值,并根据公式计算出抑制率。结果显示,随着DADS浓度的升高或者作用时间的延长,抑制率均呈升高趋势,呈时间剂量依赖性(图1)。说明MDCC-MSB-1细胞对DADS具有较高的敏感性。并由图1结果决定后续试验低、中、高剂量组,分别为80、160、240 μmol/L。

图1 DADS作用MDCC-MSB-1细胞的抑制率
2.2 不同浓度二烯丙基二硫化物作用MDCC-MSB-1细胞24 h对形态的影响
通过不同浓度的DADS作用MDCC-MSB-1细胞24 h,分别直接置于光学显微镜下(400×)和核酸染色后置于荧光显微镜下(400×)观察细胞的形态变化。结果显示,光学显微镜下细胞呈圆形或者类圆形,细胞膜完整,胞体较大,胞浆量较多(图2A),细胞的形态不规则,细胞膜完整但呈长条状和出泡状(图2C),细胞体积缩小,胞内有小泡生成,细胞数量减少(图2D)。荧光显微镜下细胞染色质致密深染,细胞核位于细胞中央(图3A),细胞的细胞质密度增加,核膜消失(图3B),细胞染色体DNA降解为多个片段,片段边缘化(图3C),右下侧细胞细胞膜完整,细胞残骸被包裹为凋亡小体(图3D)。说明DADS可从凋亡方向抑制MDCC-MSB-1细胞的增殖。

A.对照组;B.80 μmol/L;C.160 μmol/L;D.240 μmol/LA.Control group;B.80 μmol/L;C.160 μmol/L;D.240 μmol/L

A.对照组;B.80 μmol/L;C.160 μmol/L;D.240 μmol/LA.Control group;B.80 μmol/L;C.160 μmol/L;D.240 μmol/L
2.3 不同浓度二烯丙基二硫化物作用MDCC-MSB-1细胞24 h对caspase-8蛋白酶活性的影响
根据Bradford蛋白浓度测定试剂盒说明书测出盒内BSA标准蛋白OD570 nm对浓度的标准曲线(图4)。根据caspase-8活性测定试剂盒说明书测出盒内ρNA底物产物OD405 nm对浓度的标准曲线(图5)。之后通过BSA标准蛋白曲线计算不同浓度的DADS作用MDCC-MSB-1细胞24 h后提取的蛋白浓度,达到1 mg/mL~3 mg/mL后采用低酶反应体系试验,通过ρNA底物产物标准曲线计算caspase-8蛋白酶活性,最终通过上述公式计算caspase-8蛋白活性增加的百分比。结果显示,试验组中、高剂量组均相对对照组差异极显著(P<0.01)(图6)。说明DADS可诱导MDCC-MSB-1细胞的凋亡启动酶caspase-8蛋白的活性增强。

图4 BSA蛋白标准曲线
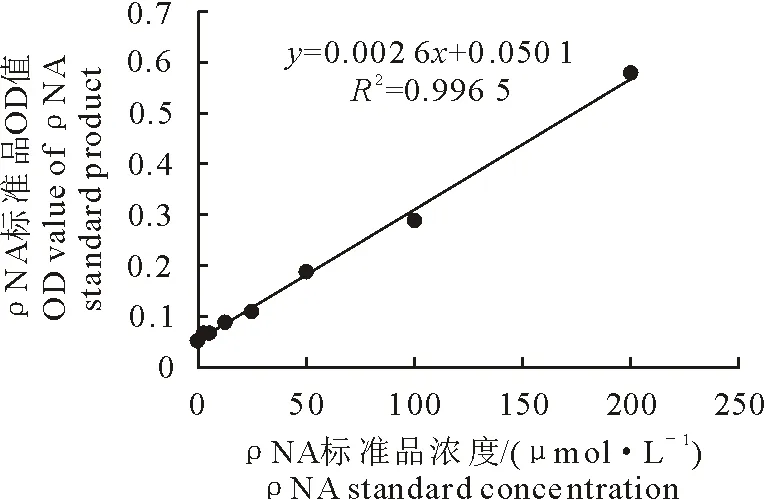
图5 ρNA底物产物标准曲线

**P<0.01
2.4 不同浓度二烯丙基二硫化物作用MDCC-MSB-1细胞24 h对Fas/FasL信号通路相关因子mRNA的转录水平的影响
通过提取总RNA,确保0、80、160、240 μmol/L试验组OD260/OD280在正常范围内且核酸浓度达标,反转录成cDNA。之后选取80 μmol/L试验组经普通PCR扩增,琼脂糖凝胶电泳检测产物大小以及引物的特异性。结果显示引物特异性高,符合要求(图7)。

M.DNA标准DL 2 000;1.β-actin;2.Fas;3.FADD;4.Caspase-8;5.Caspase-3;6.Bid
通过荧光定量PCR检测Fas/FasL凋亡通路相关因子mRNA转录水平的变化,低、中、高剂量组的DADS均能够诱导MDCC-MSB-1细胞中Fas/FasL凋亡通路相关因子mRNA转录水平增加。其中caspase-3 mRNA的相对表达量在低剂量组(80 μmol/L)时呈减少,与对照组相比,Fas/FasL凋亡通路相关因子的mRNA转录水平在高剂量组均显示差异极显著(P<0.01),FADD mRNA的转录水平在低中高剂量组均显示差异极显著(P<0.01),Bid mRNA的转录水平在中剂量组(160 μmol/L)显示差异显著(P<0.05)。另外,caspase-3 mRNA的转录水平在低剂量组(80 μmol/L)时呈减少现象,但其与中剂量组存在差异极显著(P<0.01)(图8)。说明DADS可通过Fas/FasL凋亡通路诱导MDCC-MSB-1细胞的凋亡。
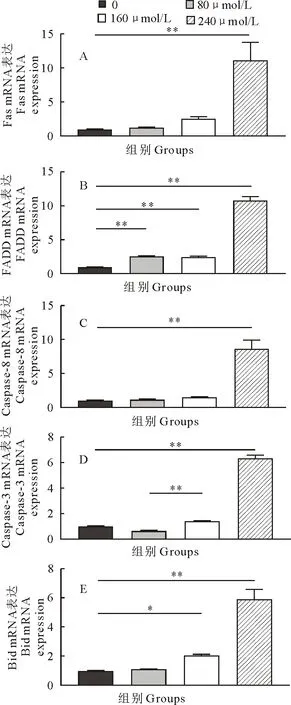
A.Fas mRNA;B.FADD mRNA;C.Caspase-8 mRNA;D.Caspase-3 mRNA;E.Bid mRNA;*P<0.05,**P<0.01
3 讨论
马立克氏病(MD)是一种引起鸡淋巴组织增生性的免疫抑制性的高度传染性的肿瘤病[18],传染源是病鸡和带毒鸡,传播方式是带毒鸡羽毛囊上皮内携带的完整的病毒,经皮肤代谢脱落扩散到环境中和带毒的设备、饲料、人员经空气传播[19],传播途径是经呼吸道吸入体内感染,雌性肉鸡易感性高,其中刚出壳的雏鸡易感性最强。临床上常见神经型(多见于侵害一侧臂神经或坐骨神经横纹消失,灰黄色,增粗至正常的2倍~3倍)和内脏型(多见于内脏器官呈结节状肿瘤)。同时,马立克氏病病毒是唯一的一种可以用疫苗防控的肿瘤性疱疹病毒,疫苗的免疫程序根据所选的疫苗的不同有所差异,疫苗的保存和应用根据所选的疫苗类型(即冻干苗和液氮苗)的不同也有所差异[20]。此外,马立克氏病病毒的毒力在不断地增强,这都给马立克氏病的免疫失败带来了高风险。
CCK-8试剂盒中,主要的化学药品是WST-8,化学成分与MTT相同,但具有毒性小、灵敏度高、直接使用检测时间短的特点[21]。WST-8进入到活细胞中,可以被MSB-1细胞中的NAD氧化还原成为水溶性的黄色甲瓒产物(Formazan)。产生的Formazan越多,颜色会越深,OD值也就越高,活细胞数量也就越多。可以反映DADS处理MSB-1细胞24、48、72 h后对细胞抑制率的变化。在该试验研究中,发现抑制率呈时间剂量依赖性,同时,40 μmol/L和80 μmol/L二烯丙基二硫化物抑制率无差异性,为使低、中、高剂量组呈等梯度浓度,选择了0、80、160、240 μmol/L作为二烯丙基二硫化物的空白、低、中、高摩尔浓度进行后续研究。
在作用24 h后,放置在光学显微镜和核酸染色后放置在荧光显微镜下观察,能较为直观的发现MSB-1细胞发生了凋亡所特有的形态学特征,提供了DADS可诱导MSB-1细胞发生凋亡的依据,为后续的作用机制探究做铺垫。
Caspase属于半胱氨酸蛋白酶家族成员,直接参与并执行凋亡程序,是白细胞介素1β转化酶(interleukin-1βconverting enzyme,ICE)系列的总称[22]。根据其在凋亡过程中功能的不同可再细分为凋亡启动者(caspase-2、-8、-9、-10)和凋亡执行者(caspase-3、-6、-7)。其功能不同与caspase蛋白酶的结构息息相关。procaspase蛋白是由一个前端结构域(Pro)和活性域(大、小亚基及其连接区)组成,其中凋亡启动者在细胞中以procaspase蛋白无活性的单体存在,procaspase-8前端结构域为死亡效应区(death effector domain,DED),当接收到凋亡刺激信号时,procaspase-8依赖于死亡受体诱导凋亡信号复合体(death-inducing signaling complex,DISC)得以募集,caspase-8蛋白酶以DED-DED方式结合,使得凋亡启动者高浓度聚集[23],之后以同源二聚体形势自我活化并作用下游效应蛋白[24]。因此,caspase-8蛋白酶活性在外源性Fas/FasL死亡受体凋亡通路有着启动的关键作用。
在本研究结果表明,二烯丙基二硫化物可诱导MSB-1细胞caspase-8蛋白酶活性增强,这说明二烯丙基二硫化物可有效诱导MSB-1细胞发生Fas/FasL死亡受体通路的启动。
Fas/FasL属于肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)超家族,二者均为跨膜蛋白(由胞膜外区,跨膜区和胞内区组成)。其中Fas为Ⅰ型跨膜蛋白,胞外区为富含半胱氨酸重复序列的信号序列,胞内区为称为死亡结构域(death domain,DD)的蛋白结合域,在体内大部分细胞表达。FasL则为Ⅱ型跨膜蛋白,胞外区为疏水氨基酸结构,具有从细胞膜表面脱落下来,形成可溶性配体分子,通过自分泌和旁分泌的方式影响全身细胞的能力[25],只表达于活化的T细胞和鼠睾丸细胞中[26-27]。当两者结合被激活,Fas的DD相互作用,募集Fas 相关死亡结构域蛋白(fas-associating protein with a novel death domain,FADD),而FADD具有DED死亡效应区,募集procaspase-8形成DISC并活化[28]。随后直接效应下游蛋白caspase-3,形成Fas/FasL死亡受体通路;或者切割Bid成tBid,tBid在其N端被豆蔻酰基化(N-myristoylation)修饰后[29],作用线粒体表面Bax/Bcl-2,形成死亡受体通路与线粒体凋亡通路并存。
本研究表明,DADS可诱导MSB-1细胞Fas、FADD、caspase-8、caspase-3及Bid mRNA表达水平升高,在高剂量组最明显,都呈极显著升高。其中FADD mRNA在低剂量组表现为极显著,说明诱导Fas/FasL所形成的死亡效应区作用明显,但是在低剂量组并没有显著性升高caspase-8 mRNA的表达水平,反倒降低了caspase-3 mRNA的表达水平,这可能的原因有好几种,可能是细胞自身存在负反馈调节作用,减缓了药物的作用;可能活化的caspase-8蛋白酶更多的作用于Bid,开启线粒体凋亡通路,这和中剂量组Bid mRNA表达水平显著升高,而caspase-3 mRNA表达水平无显著变化相应证;还可能存在其他调节。因此,二烯丙基二硫化物可诱导马立克氏肿瘤细胞MSB-1的凋亡及发生Fas/FasL信号通路调控作用,但尚需就其诱导凋亡作用及机制进行深入研究,以便阐释二烯丙基二硫化物在病毒性肿瘤疾病中的作用机制。
