新型银基低共熔溶剂制备及其在1-己烯/正己烷分离中的应用
2021-08-31李虎张自生陈久洲石好亮石永杰李洪李鑫钢高鑫
李虎,张自生,陈久洲,石好亮,石永杰,李洪,李鑫钢,高鑫
(1天津大学化工学院,精馏技术国家工程研究中心,天津 300072;2国家能源集团宁夏煤业有限责任公司,宁夏银川 750011)
引 言
α-烯烃是一类重要的化工原料,常用作聚乙烯的共聚单体、卤代烃的合成及聚α-烯烃(PAO)润滑油的制备等[1]。目前长链α-烯烃的生产主要是通过乙烯的齐聚反应得到,该过程虽然流程简单,但是副产物较多,操作成本较高,安全问题突出[2]。费托合成油品作为分离α-烯烃的一种重要原料[3-4],其中富含烯烃,且多为α-烯烃,分离路线是先得到各碳数窄馏分,再进一步分离烯烃和烷烃,但是由于相同碳数的烯烃和烷烃其结构相似、沸点相近、相对挥发度较低,传统分离工艺如精馏等存在着高能耗、高成本等问题导致其分离难度巨大[5]。因此,开发低能耗、低成本、烯烃选择性高、环境友好的α-烯烃分离替代工艺,是改善α-烯烃生产和市场供应及实现费托油品增值利用的重要途径。
目前已有相当一部分研究人员在长链α-烯烃分离方面做了很多的实验和模拟工作,常见的分离工艺如直接精馏,对设备和操作条件的要求很高,需要多塔多理论板且高回流比,是个高能耗、高成本的过程,而且得到的α-烯烃纯度不能满足聚合级产品要求[6];萃取精馏是个相对低能耗的过程,通过加入合适的萃取剂改变组分间的相对挥发度从而实现精馏分离,但是合适萃取剂的选择比较困难,李阳等[5]、杨正伟等[7]以N-甲基-2-吡咯烷酮(NMP)为萃取剂做了在C6窄馏分中分离α-烯烃的实验和模拟工作,但所得到的1-己烯产品纯度最高只能达到95%。吸附分离近年来也被广泛研究,Wang等[8-9]选用沸石和分子筛作为吸附剂从C6~C10烯烃烷烃混合物中选择性吸附α-烯烃,但吸附容量较低,而且目前难以直接通过实验来测定液相的实际吸附容量。基于过渡金属阳离子(如银离子和亚铜离子等)与烯烃双键之间产生稳定的π-键络合[10-11],银基离子液体(ILs)和亚铜基促进传输膜用于C6烯烃分离也被广泛研究[12-13],虽然银离子与烯烃双键之间的络合能力较亚铜离子更强,但是银基离子液体制备过程比较烦琐,大规模应用成本高昂,而亚铜离子在常规条件下不稳定,容易发生歧化反应导致络合效果减弱,作为烯烃分离传输液膜时传输容量较低。考虑到以上存在的各类问题,本文考虑设计一种新型的α-烯烃分离替代溶剂,用银盐作为氢键受体合成银基低共熔溶剂(Ag-DES),低共熔溶剂(DESs)具有和离子液体类似的理化性质,而且还具有自身独特的显著优势:易于设计、可生物降解、对环境无污染、易于大规模应用[14],目前已在气液混合物分离[15-16]、电化学[17]和材料化学[18]中广泛应用。
本文选用N,N-二甲基苯甲酰胺(DMBA)和三氟甲磺酸银(AgCF3SO3)分别作为氢键供体和氢键受体按照一定的摩尔比混合制得新型银基低共熔溶剂(Ag-DES),通 过FT-IR、FT-Raman、1H NMR、ESI-MS对其结构进行表征证明该溶剂被成功制备,然后将其应用于1-己烯/正己烷混合烃体系,系统地探究原料中烯烃浓度、银离子与烯烃摩尔比、操作温度及Ag-DES循环稳定性对1-己烯分配系数及选择性的影响。此外,通过FT-Raman光谱和DFT量化计算探究Ag-DES与烯烃、烷烃之间相互作用机理,以此说明Ag-DES对烯烃选择性分离的作用机制。
1 实验材料和方法
1.1 原料及试剂
本实验中所使用的试剂主要有:1-己烯[98%(质量分数,下同),上海麦克林生化科技有限公司],正己烷(99%,天津江天化工科技有限公司),N,N-二甲基苯甲酰胺(99.9%,上海阿拉丁生化科技股份有限公司),三氟甲磺酸银(99.8%,上海皓鸿生物医药科技有限公司)。
1.2 Ag-DES的合成实验
将一定量的三氟甲磺酸银在65℃光保护下真空干燥24 h后取出,与一定量的N,N-二甲基苯甲酰胺按摩尔比1∶2混合,然后避光置于60℃恒温油浴中以200 r/min的转速搅拌1 h形成淡黄色均匀液体,将其存储在棕色试剂瓶中置于真空干燥器内备用,接着对其理化性质进行分析。本课题组前期成果表明,该溶剂具有很好的热稳定性,工作温度范围为-5~160℃,常温常压下的运动黏度为170.25 mPa·s,密度为1.395 g/ml。FT-IR、FT-Raman、ESIMS、1H NMR等一系列表征结果显示,在溶剂合成中除了伴有DMBA分子中N-甲基氢与三氟甲磺酸根阴离子中氧、氟原子之间氢键的生成,还有Ag+与DMBA分子中羰基氧之间化学络合作用的产生,共同决定了该溶剂可以稳定存在,表明新型银基低共熔溶剂被成功制备[19]。
1.3 反应萃取实验
反应萃取实验装置如图1所示,先按照一定的浓度梯度配制相同质量的1-己烯、正己烷混合溶液加入100 ml结晶器中,为避免Ag-DES见光分解导致分离性能降低,在避光条件下向结晶器中加入相同体积和组成的Ag-DES溶剂,打开匀速程序控温槽,使体系温度维持在25℃,打开数显电动搅拌器以200 r/min的转速搅拌1 h使其达到热力学平衡,然后在该温度下继续静置1 h使其相分离,将上层有机相液体用滴管小心取出称重,并用气相色谱分析其组成。原料中烯烃浓度、银离子与烯烃摩尔比、分离温度及循环稳定性对1-己烯分离性能探究实验操作条件如表1所示,循环实验中Ag-DES与1-己烯络合物的解络条件是在50℃恒温油浴中减压至10 kPa左右,以250 r/min转速旋蒸12 h后回收Ag-DES[20],重复用于反应萃取分离实验,实验步骤和上述反应萃取实验一致。
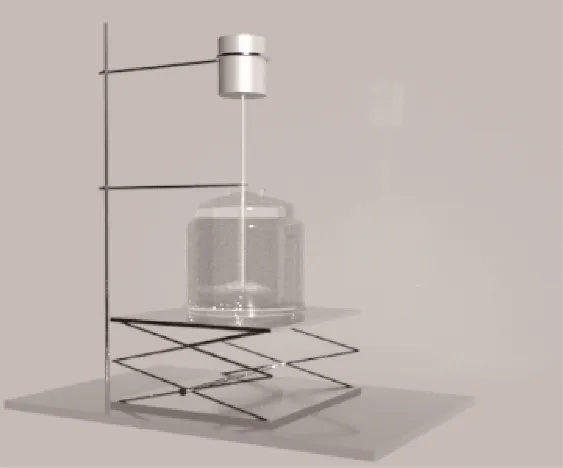
图1 反应萃取实验装置Fig.1 Experimental apparatus for reactive extraction
1.4 气相色谱(GC)分析
本实验采用PE Auto System XL气相色谱仪,HP-5(0.32 mm×30 m×0.25μm,Agilent)非极性柱对上清液有机相中的各组分含量进行分析,并通过质量衡算得到两相中三元混合物的组成,计算过程如下。
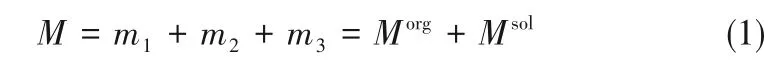
式中,M为进料总质量;m1,m2,m3分别为1-己烯、正己烷、Ag-DES进料质量;Morg和Msol分别为有机相和溶剂相的质量,二者可以通过式(2)、式(3)分别求得。
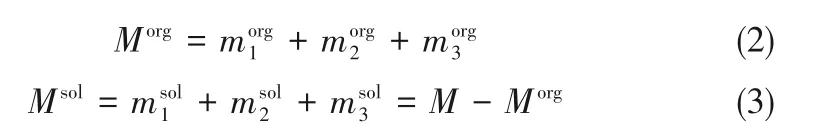
Morg由分液称重可知,有机相中各组分的质量分数(x1org,x2org,x3org=1-x1org-x2org)由色谱分析得到,两相中各组分的质量及质量分数可以通过式(4)~式(6)求得。
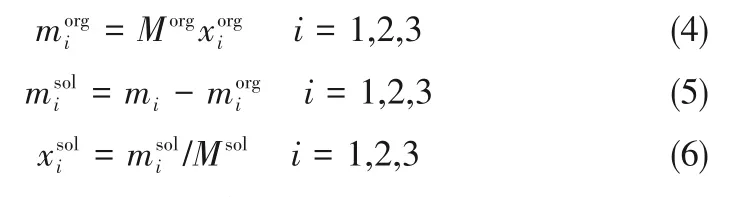
其中,i=1、2、3分别代表1-己烯、正己烷、Ag-DES;上角标org和sol分别代表有机相和溶剂相。
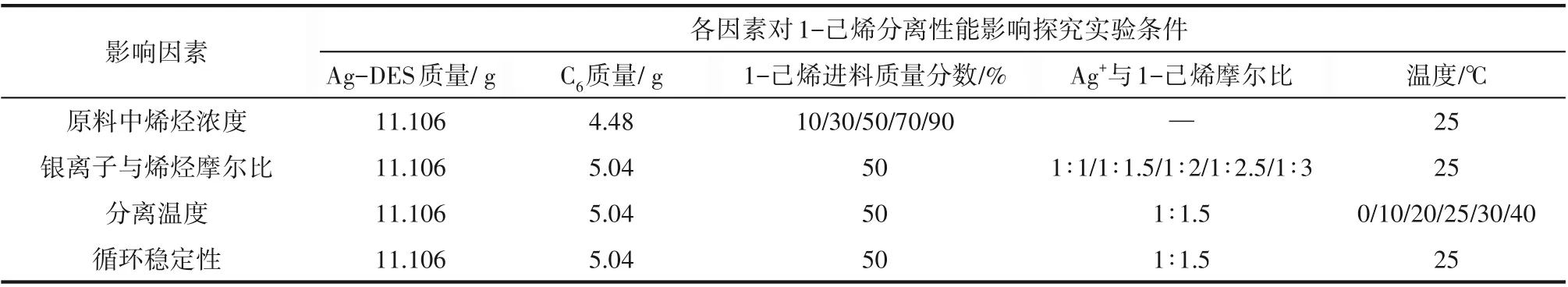
表1 1-己烯分离性能探究实验条件Table 1 The experimental conditions for the separation performance of 1-hexene
1.5 FT-Raman分析及量化计算
采用FT-Raman光谱和量子化学计算结合来分析Ag-DES与1-己烯、正己烷之间的相互作用机理,将Ag-DES、1-己烯、正己烷及其络合物分别注射进石英毛细管后两端封口,在785 nm激光光源下进行拉曼光谱分析。基于密度泛函理论(DFT)的量化计算采用Gaussian 09程序,泛函选用M062X[21],基组选用def2tzvp[22],分别对1-己烯、正己烷、Ag-DES及其络合物的结构进行优化并计算单点能,在溶剂模型下得到Ag-DES与1-己烯及正己烷之间相互作用能的差异,并通过分子中原子(AIM)理论分析了Ag-DES与1-己烯、正己烷形成络合物中分子间所成键临界点(BCPs)处的拓扑参数[23],从而反映不同原子对间共价和非共价相互作用的差异,从分子水平上解释了烯烃选择性分离的原因。
2 反应萃取实验结果与讨论
Ag-DES被用作反应萃取剂分离1-己烯和正己烷,分离性能的主要评价指标是各组分的分配系数Di及选择性Si,j,二者分别计算如下。

2.1 原料中烯烃浓度对分配系数及选择性的影响
原料中烯烃浓度对分离性能的影响如图2所示,1-己烯的分配系数随着原料中烯烃浓度的增大而减小,而正己烷的分配系数随烯烃浓度增大略微上升,二者共同决定了1-己烯相对正己烷的选择性随烯烃浓度的增大而减小,当烯烃浓度为10%(质量分数)时,1-己烯的选择性最高可达17.97。这主要是因为1-己烯在Ag-DES中的化学络合作用相比其物理溶解对选择性的影响更占主导作用[24],随着烯烃浓度的增大,化学络合逐渐达饱和,所以烯烃的分配系数逐渐降低。此外,1-己烯的极性强于正己烷[偶极矩:1-己烯(μ=0.45)>正己烷(μ=0.06)],所以在Ag-DES极性溶剂中1-己烯的溶解能力更大,这就导致1-己烯在溶剂相中的含量要远远高于正己烷,从而实现对1-己烯的选择性分离;正己烷的分配系数略微升高,是因为越到烯烃的高浓度区,就越是烷烃的低浓度区,此时烷烃在有机相中的含量也就逐渐下降导致其分配系数上升。由此可见,在烯烃的低浓度区,1-己烯对正己烷的选择性越高,分离难度越小,越到高浓度区,越不易分离。
将上述实验数据进行质量守恒计算即可得到如表2所示的三元液液萃取相平衡数据,绘制如图3所示的三元液液平衡相图,从图3中可以看出,这是两对部分互溶,一对完全互溶的体系,1-己烯在Ag-DES中的溶解度更大,正己烷的很小,这也正是实现二者选择性分离的基础。此外,从表2中可以看出,随着原料中烯烃浓度的增大,1-己烯的收率从68%提升到了73%,说明在烯烃的高浓度区收率高。但是,单级分离过程的收率仍然较低,所以,进一步优化操作条件和分离过程设计对Ag-DES的应用具有重要意义。
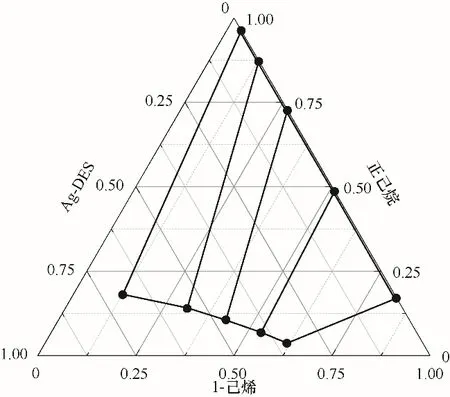
图3 1-己烯-正己烷-Ag-DES三元相图[T=(298.15±0.50)K]Fig.3 The ternary phase diagramof 1-hexene-n-hexane-Ag-DES[T=(298.15±0.50)K]
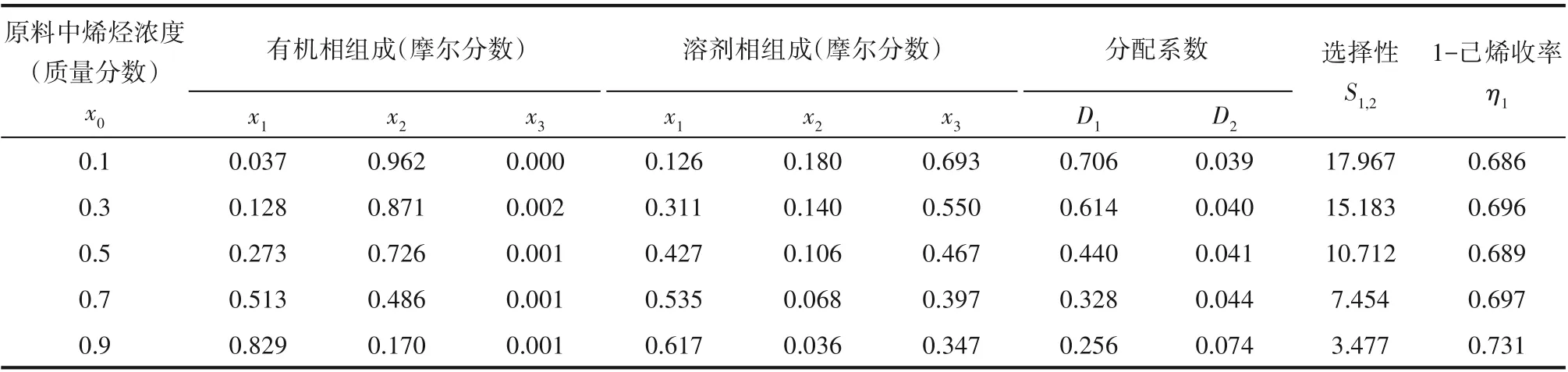
表2 1-己烯(1)-正己烷(2)-Ag-DES(3)三元两相体系在298.15 K时的相平衡数据Table 2 Phase equilibrium data of 1-hexene(1)-n-hexane(2)-Ag-DES(3)in the ternary biphasic system at 298.15 K
2.2 银离子与烯烃摩尔比对分配系数及选择性的影响
银离子与烯烃摩尔比对1-己烯分离性能的影响如图4所示,银离子与烯烃摩尔比越大,1-己烯的分配系数和选择性也就越大。随着二者摩尔比的降低,银离子络合位点逐渐达到饱和,此时1-己烯的分配系数随之降低,由于正己烷在Ag-DES中受物理溶解的限制,其分配系数基本保持不变,所以整体上1-己烯对正己烷的选择性随银离子与烯烃摩尔比的减小而降低,银离子浓度越高对烯烃分离越有利。
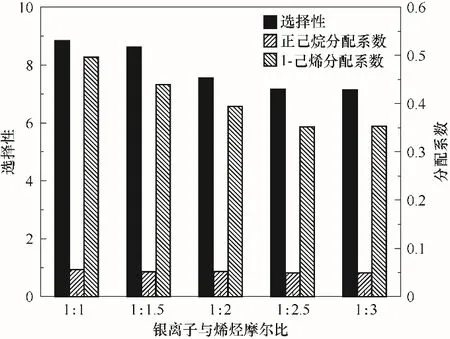
图4 银离子与烯烃摩尔比对1-己烯、正己烷分配系数及其选择性的影响(在25℃下,将11.106 g Ag-DES含烯烃浓度50%的C6混合物按摩尔比(1∶1)~(1∶3)混合)Fig.4 Effect of molar ratio of silver ion to olefin on the distribution coefficient and selectivity of 1-hexene to n-hexane(Including 11.106 g Ag-DESand C6 mixture with 50%olefin and the molar ratio of Ag-DESto 1-hexene rangingfrom 1∶1 to 1∶3 at 25℃)
2.3 分离温度对分配系数及选择性的影响
分离温度对1-己烯分离性能的影响如图5所示,从10℃开始随着温度的升高,1-己烯的分配系数及选择性逐渐呈现下降趋势,这个主要可以归因于两个方面。其一,升温对1-己烯在Ag-DES中的物理溶解具有促进作用,会增大溶剂相中1-己烯的含量;其二,由于银离子与烯烃双键之间的化学络合作用是一个放热过程[25],升温会抑制烯烃与溶剂相中银离子之间的化学络合,进而导致溶剂相中烯烃含量降低。对比以上两个方面,由于1-己烯的分配系数随温度升高逐渐下降,所以升温对化学络合的影响要比物理溶解更加明显。另外,升温使得正己烷的分配系数略有增大,所以整体上1-己烯对正己烷的分离选择性随温度升高而降低。但并非温度越低越好,当操作温度降至0℃时,1-己烯和正己烷的分配系数及选择性大幅度降低,这可能主要是因为在该温度下,相比于化学络合,物理溶解更占主导作用,故而二者的分配系数及选择性急剧降低。综上,相对而言低温对α-烯烃分离更有利,10℃时1-己烯分配系数及选择性最高。
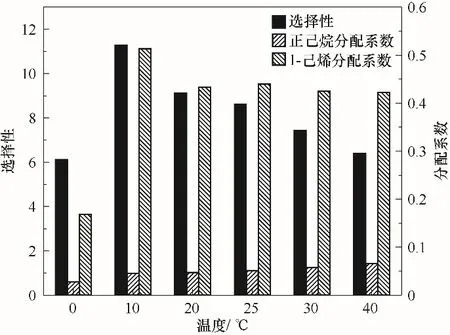
图5 温度对1-己烯、正己烷分配系数及其选择性的影响(将11.106 g Ag-DES与5.04 g烯烃浓度50%的C6混合物分别于0~40℃各温度下混合)Fig.5 Effect of temperature on the distribution coefficient and selectivity of 1-hexene to n-hexane(Including 11.106 g Ag-DESand 5.04 g C6 mixture with 50%olefin and the operating temperature ranging from 0 to 40℃)
2.4 循环稳定性
循环稳定性是Ag-DES用于α-烯烃分离的重要特征之一。由于该溶剂的成本高于普通溶剂,所以回收和重复利用尤为重要。同一溶剂的五次循环反应萃取分离实验结果如图6所示,1-己烯和正己烷的分配系数及选择性均没有较大的变化,与五组分配系数及选择性的平均值相比,变化幅度在±6%范围内,说明该Ag-DES对C6α-烯烃分离的循环稳定性较好,在长链烯烃的分离中具有很好的应用前景。而在实际工业应用中可考虑使用闪蒸的方式进行Ag-DES的回收,通过模拟计算对解络过程中操作条件进行设计优化[19]。
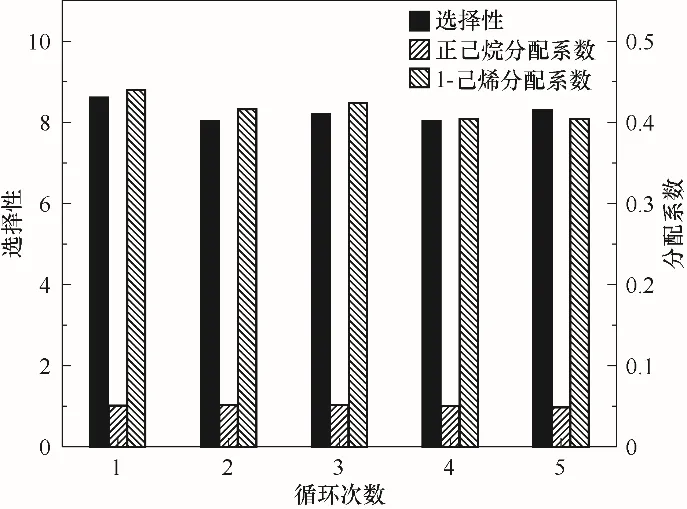
图6 循环次数对1-己烯、正己烷分配系数及其选择性的影响(在25℃下,将11.106 g Ag-DES与5.04 g烯烃浓度50%的C6混合物混合)Fig.6 Effect of recycle times on the distribution coefficient and selectivity of 1-hexene to n-hexane(Including 11.106 g Ag-DESand 5.04 g C6 mixture with 50%olefin at 25℃)
2.5 与其他分离剂比较
相比文献报道的其他分离剂,如有机溶剂和离子液体等,本文合成的Ag-DES在1-己烯和正己烷的分离中具有明显的优势。Zhu等[26]选用N-甲酰基吗啉(NFM)、N-甲基-2-吡咯烷酮(NMP)、γ-丁内酯(GBL)和1-甲基咪唑(1-MEI)等有机溶剂液液萃取1-己烯,选择性范围为1.7~3.8。李如龙[27]合成了一系列常规离子液体和银基离子液体并将其应用于1-己烯/正己烷混合烃体系,1-己烯分离选择性结果如图7所示,常规不含银的[CONmim][NTf2]、[Bmim][BF4]、[Bmim][PF6]、[Bmim][NTf2]等咪唑类离子液体中1-己烯的分离选择性只有2~3,而银基离子液体[Ag(Bmim)][NTf2]及Wang等[28]合成的[Ag(DMBA)2][NTf2],当烯烃浓度为10%(质量分数)时,1-己烯对正己烷的分离选择性分别为10.30和13.30,而在该条件下,Ag-DES中1-己烯对正己烷的选择性达到了17.97,较银基离子液体高出35%以上,在C6α-烯烃的分离中极具应用潜力。

图7 各分离剂对1-己烯/正己烷的分离选择性Fig.7 The separation selectivity of 1-hexene to n-hexane in different separating agents
3 Ag-DES与烯烃/烷烃相互作用机理
3.1 FT-Raman光谱分析
Ag-DES、1-己烯、正己烷及其二元络合物、解络1-己烯后的Ag-DES拉曼光谱分析结果如图8所示。在图8(a)中,Ag-DES-1-己烯络合物与两纯组分的谱线相比发现,1-己烯1295.66 cm-1处的峰比较明显地出现在了络合物谱线中,这就说明1-己烯进入了Ag-DES中。1641.95 cm-1处为1-己烯碳碳双键的伸缩振动峰,在Ag-DES-1-己烯络合物谱图中1636.34 cm-1的位置也出现了一个轻微的碳碳双键峰,据此可推断1-己烯在Ag-DES中是存在少量物理溶解的,而且此处的双键峰发生了轻微的红移,可能与双键上发生的化学络合作用相关,其化学环境受银离子影响,双键峰强度降低,向低能量方向偏移。此时,再对比络合物与Ag-DES的谱图,发现Ag-DES中银离子与羰基络合基团在1576.82 cm-1处的峰面积大幅增加,而且络合物在1579.33 cm-1处出现了一个更高的新峰,已有文献报道银离子与烯烃双键的化学络合基团在1585 cm-1处出峰[29],据此可判断新峰1579.33 cm-1为银离子与碳碳双键络合基团的峰。由于1579.33 cm-1和1576.82 cm-1非常近,不易明显区分,此处为了进一步说明新的络合基团的生成,对A、B(A峰:1576.82~1579.33 cm-1处银离子与双键络合基团伸缩振动峰;B峰:1512.77 cm-1处苯环的伸缩振动峰)两处峰面积之比进行前后比较,未结合1-己烯之前,峰面积比(A/B)为0.5552,结合1-己烯后A/B增大至0.7069,接着再将1-己烯解络,A/B减小至0.5589,这表明A峰处确实有银离子与烯烃双键络合基团对应新峰的叠加出现。在图8(b)中,对比Ag-DES-正己烷络合物与纯组分谱图,1145.62、1307.41 cm-1等烷烃特征峰均未出现在Ag-DES-正己烷络合物谱图中,说明正己烷几乎不溶于Ag-DES,二者间弱相互作用微弱。综上,1-己烯与Ag-DES间的化学络合作用和较强的物理溶解作用是实现烯烃烷烃分离的主要原因。
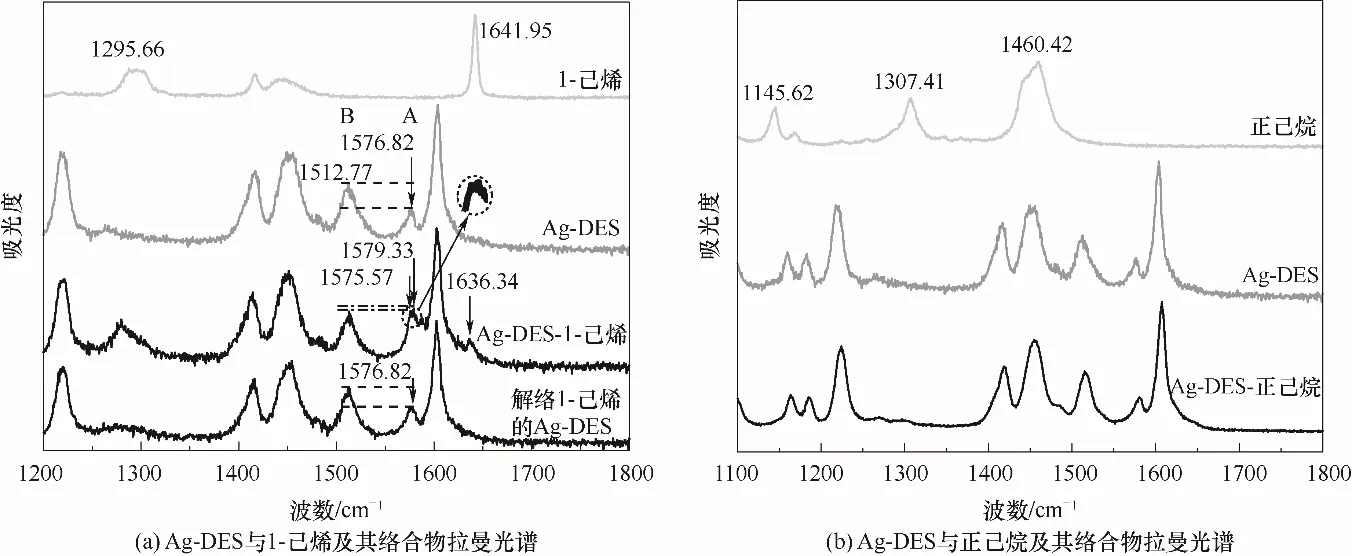
图8 Ag-DES与1-己烯/正己烷及其络合物拉曼光谱图Fig.8 Raman spectra of Ag-DESand 1-hexene/n-hexane and their complexes
3.2 量化计算分析
3.2.1 构型优化 为从分子水平解释Ag-DES对烯烃的选择性分离,在M062X/def2tzvp级别下对Ag-DES及其与烯烃烷烃络合物基态结构进行优化,优化构型如图9所示。其中图9(a)、(b)分别为AgCF3SO3和DMBA的稳定构型,Ag-DES是将AgCF3SO3插入到两个相邻的DMBA分子间即得到如图9(c)所示的优化构型,此时银离子与DMBA羰基氧之间形成了化学络合作用,阴离子上氧原子、氟原子等与DMBA分子中的氢原子间形成了稳定的氢键作用,这与Ag-DES的表征结果一致[19]。接着对比如图9(d)、(e)所示的Ag-DES与1-己烯、正己烷络合后的稳定构型,发现在Ag-DES-1-己烯络合物结构中,C C…Ag原子间距为2.502Å(1Å=0.1 nm)和2.567Å,属于银离子与不饱和键之间的共价相互作用,然而在Ag-DES-正己烷络合物构型中,C—C…Ag原子间距为10.518Å,由于Ag-DES与正己烷之间原子间距太大,二者间几乎不存在较强的弱相互作用。此外,将Ag-DES-1-己烯络合物构型与Ag-DES相比,Ag-DES中C O…Ag原子间距从初始的2.263Å和2.294Å增大到了2.325Å和2.358Å,O…Ag…O键角也从原来的158.7°增大到了249.7°,C O…Ag键角也从102.9°和109.5°增大到了109.7°和121.5°,这主要是因为Ag-DES与1-己烯之间形成了化学络合作用使得Ag-DES内部作用力减弱进而构型参数发生变化;而在Ag-DES-正己烷络合物构型中,由于Ag-DES与正己烷之间相互作用强度微弱,所以结合正己烷前后,Ag-DES的结构参数基本不变。综上,构型优化结果说明Ag-DES与1-己烯之间的相互作用强度远大于其与正己烷之间的。
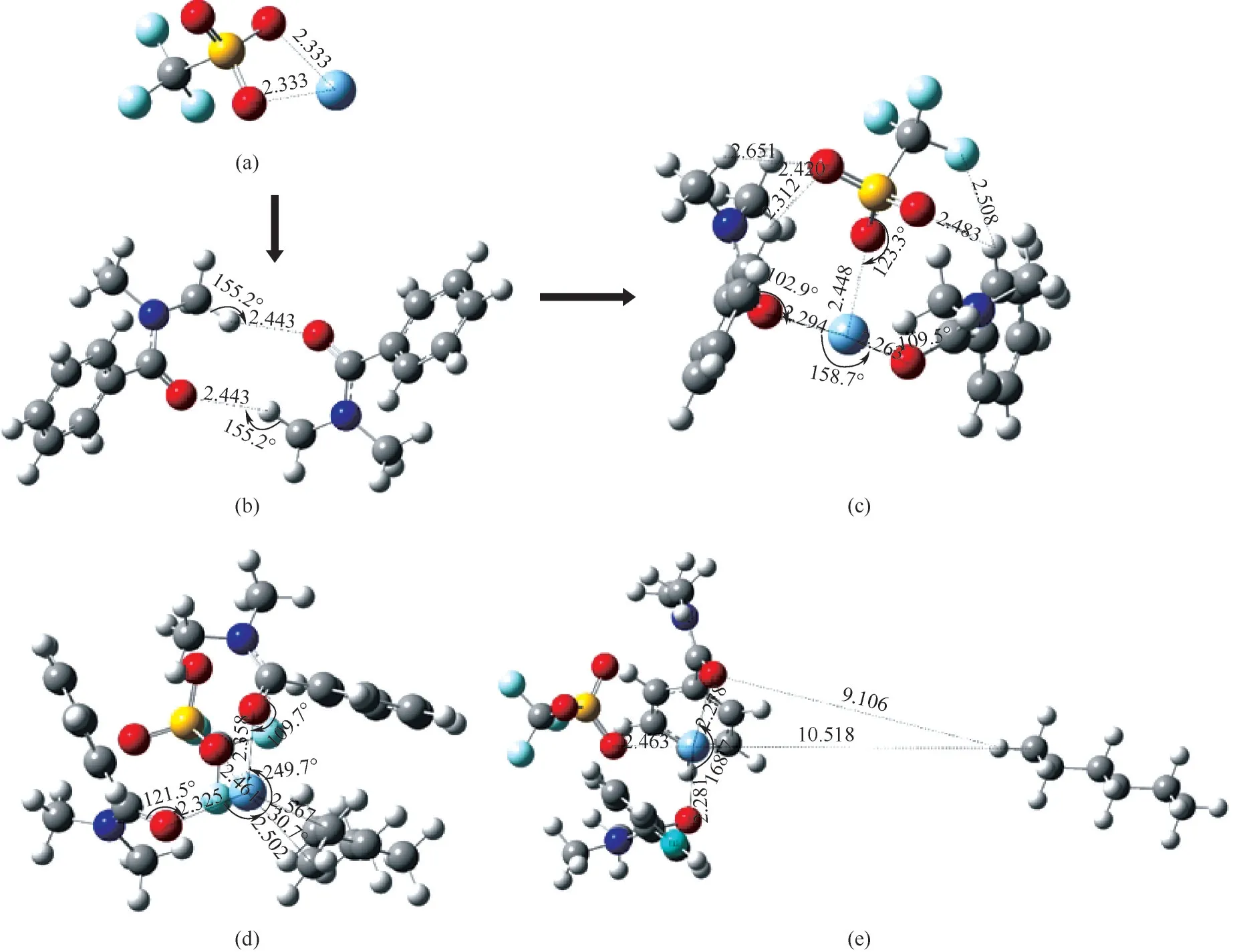
图9 AgCF3SO3(a)、DMBA(b)、Ag-DES(c)、Ag-DES-1-己烯(d)、Ag-DES-正己烷(e)在M062X/def2tzvp级别下的优化构型Fig.9 The optimized geometry structures for AgCF3SO3(a),DMBA(b),Ag-DES(c),Ag-DES-1-hexene(d),Ag-DES-n-hexane(e)at the M062X/def2tzvp level
3.2.2 相互作用能 相互作用能是定量描述分子间相互作用强弱的物理量[30],可以通过各组分优化构型的单点能计算得到,AB分子间的相互作用能通常用式(9)来计算:
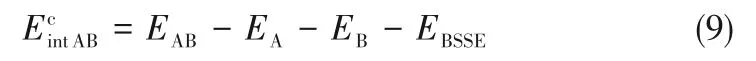
式中,EA、EB、EAB分别为A、B、AB单独存在时的单点能;EBSSE为基组叠加校正能量,计算结果如表3所示。Ag-DES与1-己烯之间的相互作用能为-130.75 kJ/mol,远大于Ag-DES和正己烷之间的相互作用能-76.47 kJ/mol,二者之间较大的相互作用能差异,决定了1-己烯在Ag-DES中具有更高的溶解性,有利于对其选择性分离。
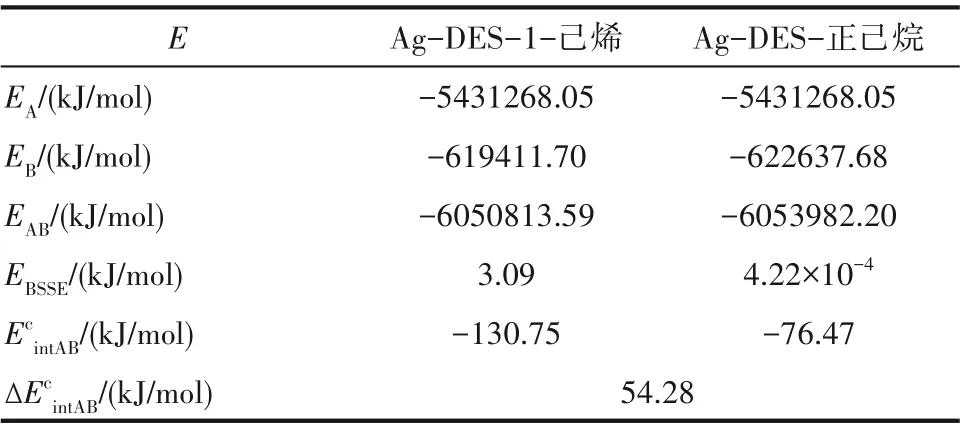
表3 Ag-DES(A)-1-己烯/正己烷(B)在M062X/def2tzvp级别下的相互作用能Table 3 The interaction energiesof the complexes Ag-DES(A)-1-hexene/n-hexane(B)at M062X/def2tzvp level
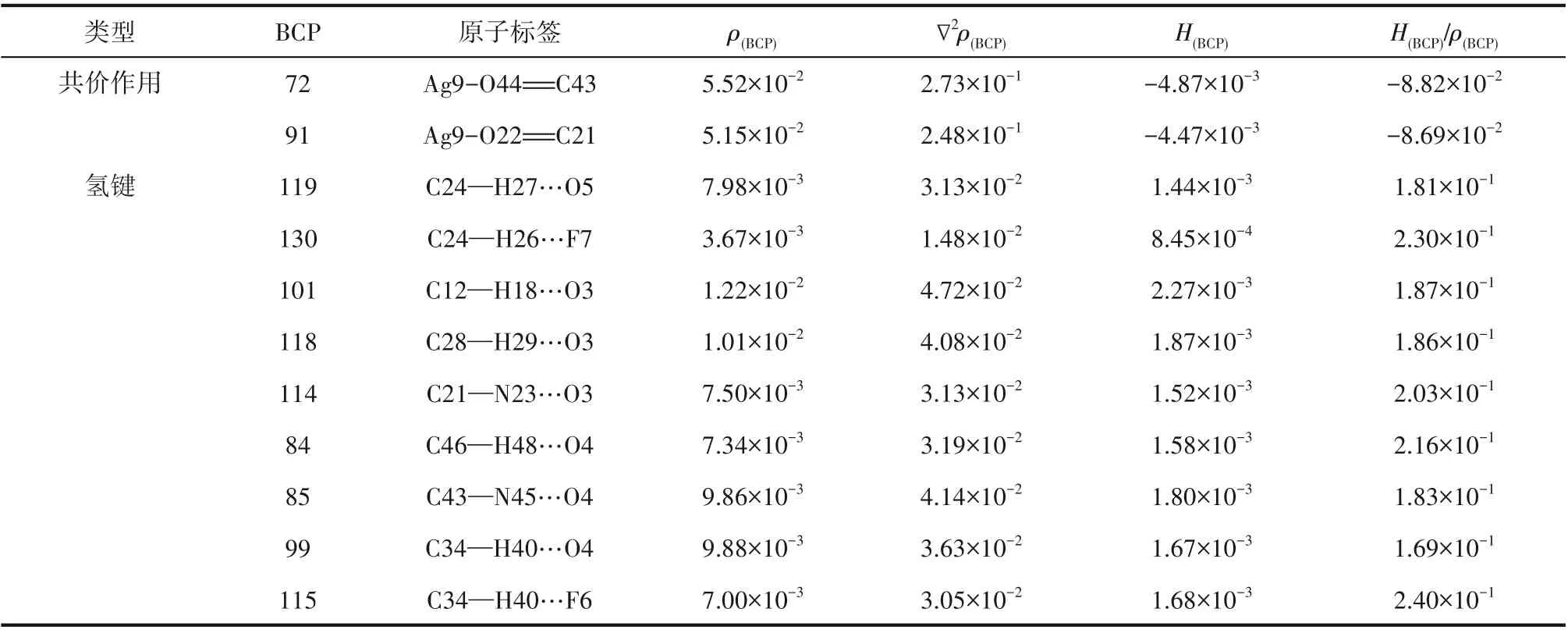
表4 Ag-DES在BCPs处的拓扑参数Table 4 Topological parameters of BCPs in Ag-DES
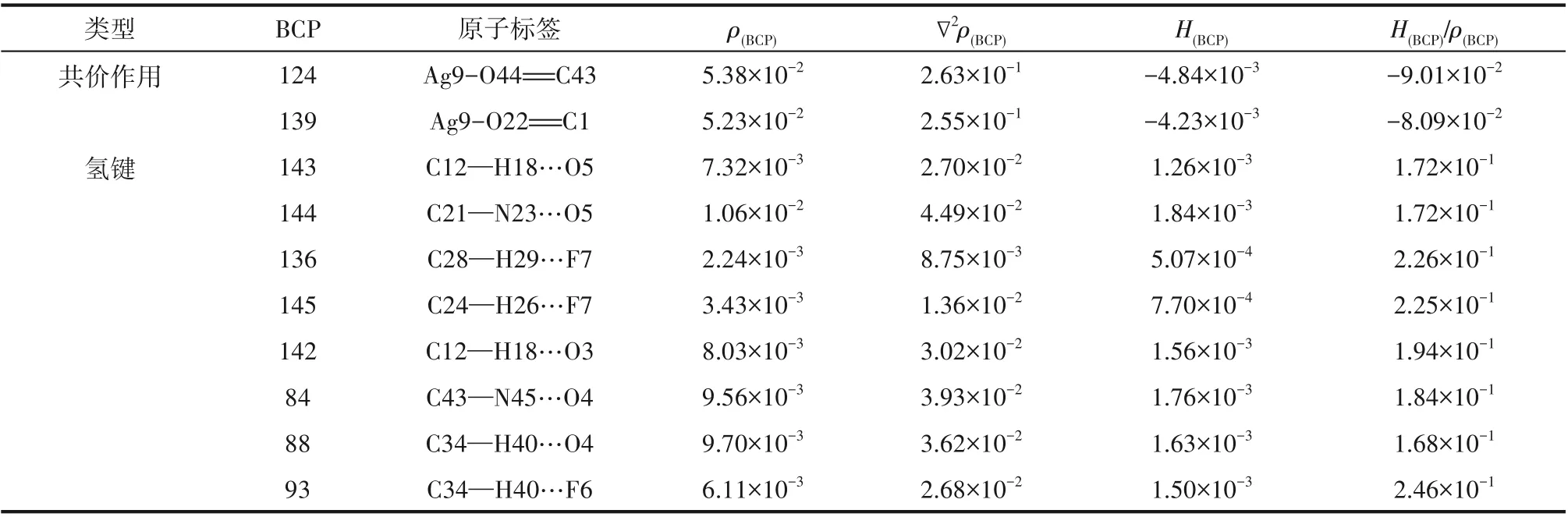
表6 Ag-DES-正己烷在BCPs处的拓扑参数Table 6 Topological parameters of BCPs in Ag-DES-n-hexane
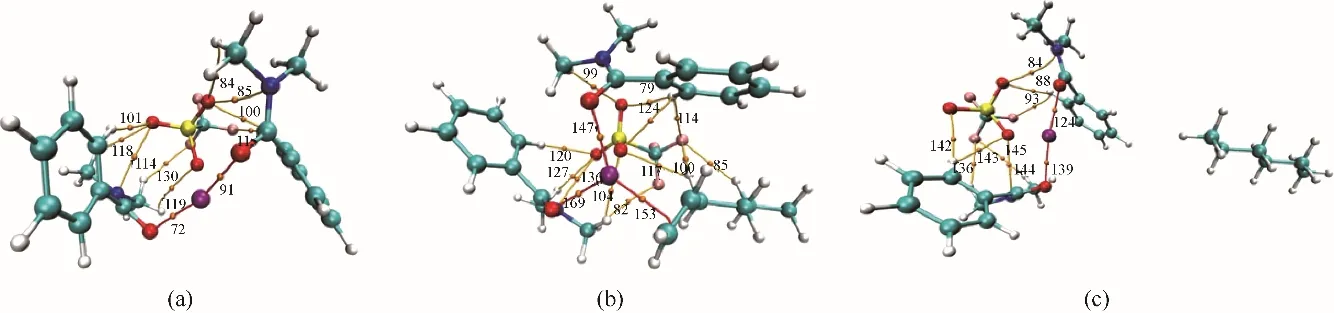
图10 Ag-DES(a)、Ag-DES-1-己烯(b)、Ag-DES-正己烷(c)的AIM分析橘点:BCPs;红线:共价相互作用;橘线:非共价相互作用Fig.10 The AIM analysis for Ag-DES(a),Ag-DES-1-hexene(b),Ag-DES-n-hexane(c)The BCPs aremarked asorangedots,thecoordination covalent bondsarelinked by red linesand thehydrogen bondsarelinked by orangelines
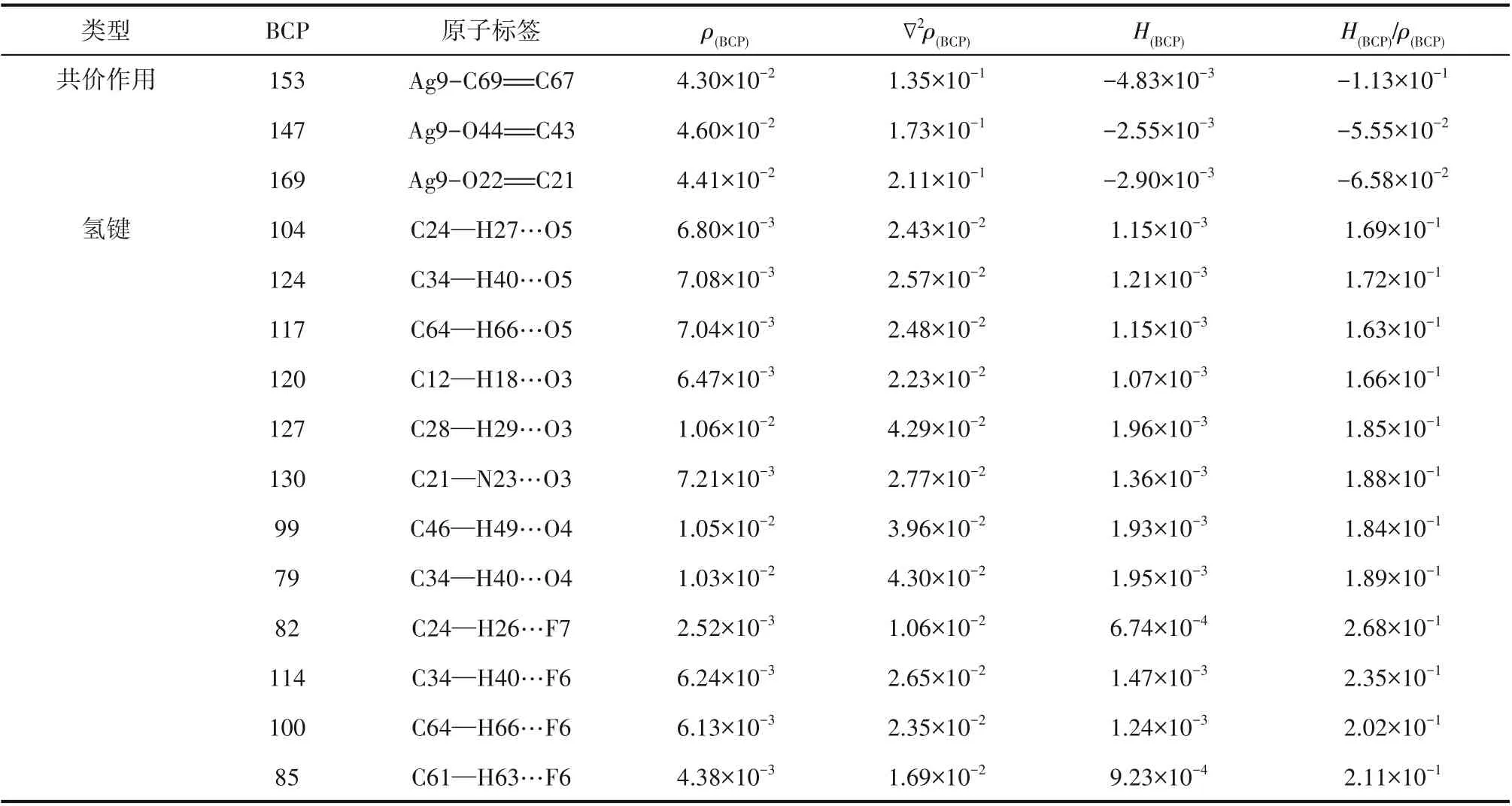
表5 Ag-DES-1-己烯在BCPs处的拓扑参数Table 5 Topological parameters of BCPs in Ag-DES-1-hexene
4 结 论
在本研究中成功合成了一种新型银基低共熔溶剂,并将其应用于1-己烯和正己烷的反应萃取分离研究,结果显示,在较低的烯烃进料浓度、分离温度及较高的银离子浓度下,1-己烯对正己烷的分离选择性较高,当1-己烯进料浓度为10%(质量分数)时,选择性可达17.97,相比文献中的银基离子液体高出35%以上。多次循环实验结果也证明了该Ag-DES具有非常好的循环稳定性。在此基础上,通过对Ag-DES与1-己烯/正己烷络合体系的FT-Raman表征和量化计算,包括构型优化、相互作用能计算及AIM理论分析,共同说明了Ag-DES与1-己烯之间存在着共价化学络合作用和非共价氢键作用,而与正己烷之间相互作用微弱,二者巨大的相互作用差异,是实现1-己烯选择性分离的主要原因。
银基低共熔溶剂作为一种新型可设计的绿色分离介质,在烯烃分离中有着极大的应用潜力。在今后的研究中还可以对其构型进行优化,通过引入更高极性的阴离子或功能性基团,或者改善氢键供体和受体之间的结合比例来进一步调控Ag-DES的结构特性,降低黏度,降低成本,可用作反应萃取剂或促进传输的液膜材料来提高α-烯烃的分离性能;基于基础的实验研究,开发α-烯烃分离的新工艺,建立相应的理论模型,优化工艺参数,为Ag-DES的工业化应用提供可能。
