HIF-3在骨肉瘤组织中的表达及低氧状态对MG-63细胞侵袭能力的影响
2021-08-31盛奇智阮锋魏优秀李广磊刘平
盛奇智 阮锋 魏优秀 李广磊 刘平*
骨肉瘤是骨组织最常见的原发性实体恶性肿瘤,也是骨肿瘤患者的主要死亡原因之一[1-2]。骨肉瘤的恶性程度高、转移早,治疗后容易复发和转移,患者预后差,5年生存率相对较低。骨肉瘤的侵袭转移机制目前尚未完全阐明,仍然是当前研究的热点和难点。
目前大量研究表明,低氧微环境与人类恶性实体肿瘤关系非常密切[3-4],肿瘤低氧环境是引起其侵袭转移的关键因素[5-6]。检测低氧微环境诱导的骨肉瘤细胞内相关基因的表达对阐明其侵袭转移的分子机制具有重要作用。肿瘤对低氧引起的反应主要是由转录因子低氧诱导因子(hypoxiainducible factor,HIF)家族介导的,HIF由功能性的 亚基和结构组成性的 亚基[7]2个亚基组成,亚基对氧敏感,对HIF功能的发挥起关键作用[8]。有研究报道在人体内发现HIF-3,在胰腺癌中,低氧诱导的HIF-3表达增强了胰腺癌细胞的侵袭转移能力[9-10]。本文以骨肉瘤组织和细胞株为研究对象,从细胞学实验角度确立HIF-3在骨肉瘤中的表达与侵袭转移的关系,探讨HIF-3在此关系中的作用。
1 材料与方法
1.1 主要试剂
DMEM培养基(Gibco公司,美国);胎牛血清(Gibco公司,美国);-actin抗体(Proteintech公司,中国);HIF-3抗体(Proteintech公司,中国);HRP标记羊抗兔IgG(H+L)(Proteintech公司,中国);FLAG-HIF-3质粒(ViGene公司,中国);HIF-3及-actin引物合成(GENE公司,中国);HiPerFect Transfection Reagent(Qiagen公司,美国);Effectene Transfection Reagent(Qiagen公司,美国);Oligofectamine Reagen(Invitrogen公司,美国);HIF-3 siRNA(广州瑞博生物科技有限公司)。
1.2 一般资料
选择武汉大学人民医院和华中科技大学同济医学院附属梨园医院2017年1月~2019年12月骨科骨肉瘤患者手术切除送检的骨肉瘤标本15例,选择同期骨软骨瘤患者手术切除的骨软骨瘤组织15例作为对照。其中骨肉瘤组织标本来源患者年龄12~45岁,平均(30.3±14.7)岁,对照组骨软骨瘤组织来源患者年龄13~48岁,平均(32.2±15.9)岁。两组标本来源患者年龄比较差异无统计学意义。标本组织入选标准:具备完整的临床资料;具备详细的诊疗记录,病历记录详细、规范,手术资料及影像学资料完备;组织标本排除标准:既往曾患恶性肿瘤或合并其他器官系统肿瘤患者;合并其他系统慢性器官功能衰竭患者;患有其他内分泌系统疾病;长期应用糖皮质激素或免疫抑制剂患者;合并慢性呼吸系统疾病可能导致慢性低氧性疾病患者。
1.3 RT-PCR法检测骨肉瘤MG-63细胞中HIF-3 mRNA的表达
提取细胞总RNA,逆转录合成cDNA,再进行qRT-PCR扩增检测,应用SYBRGreenⅠ荧光染料技术进行实时定量PCR反应,获取各组标本的标准曲线,计算并分析结果值。本实验所用到的引物均由上海生工生物有限公司设计并合成:管家基因(GAPDH)的引物序列为:H-GAPDHForward primer:5'TGGGTGTGAACCATGAGAAGT3';H-GAPDH Reverse primer:5'TGAGTCCTTCCACGATACCAA 3';目的基因引物序列:H-HIF3 Forward primer:5'CAGGCTACAGTGGTGTCAGG 3';H-HIF3 Reverse primer:5'TGCGAGTATGTTGCTCCGTT 3'。
1.4 Western Blot法检测骨肉瘤MG-63细胞中HIF-3蛋白表达
提取细胞总蛋白,BCA法测定蛋白浓度,Western Blot检测相关蛋白表达情况,Image J软件对Western Blot图像进行统计分析。
1.5 HIF-3 siRNA的转染
HIF-3 siRNA靶序列:#1:ACAGCAGCTTGCACATT;#2:GCAGGAGCATCCACACT;#3:CCAGCTGCATCGACAGT。
细胞按照转染步骤进行siRNA转染后提取RNA或蛋白,分别用RT-PCR和Western Blot方法检测HIF-3的mRNA和蛋白的表达情况。
1.6 细胞过表达FLAG-HIF-3质粒转染
细胞按照转染步骤进行质粒转染,转染后提取RNA或蛋白,分别用RT-PCR和Western Blot方法检测HIF-3的mRNA和蛋白的表达情况。
1.7 骨肉瘤MG-63细胞黏附实验
向96孔培养板内细胞中加入100 L/孔的100 g/mL的Fn作用2 h,黏附细胞用Promega公司的Cyto Tox96R Non2Radioactive Cytotoxicity Assay Kit定量。用酶联仪测定OD490的值;黏附细胞百分比等于黏附细胞OD490和加入总细胞OD490的比。
1.8 骨肉瘤MG-63细胞迁移实验
将MG-63细胞接种于24孔培养板里Millicell上室,下室加入400 L完全培养液,培养24 h后,取出Millicell小室,收集运动至下室的细胞,MTT法测穿膜细胞数。迁移率=[(实验组值-空白组值)/(正常对照组值-空白组值)]×100%。
1.9 骨肉瘤MG-63细胞体外侵袭实验
用50 L Matrigel包被Millicell小室,将Millicell小室放入24孔培养板,上室为含1%FBS的培养液,将MG-63细胞接种于已用Matrigel包被好的24孔培养板Millicell小室上室中培养48 h,取出Millicell小室,用棉签擦去微孔滤膜上层的细胞,固定、染色穿过微孔滤膜侵袭至下室的细胞,在400倍倒置显微镜下计数侵袭穿膜细胞数,每张膜选取8个视野。以对照组侵袭细胞数为参照,按以下公式计算各组细胞侵袭率:侵袭率=(实验组侵袭穿膜细胞数/正常对照组侵袭穿膜细胞数)×100%。
1.10 免疫组织化学染色
对全部30例标本进行石蜡切片免疫组织化学染色,实验大致步骤为:石蜡切片脱蜡至水,抗原修复,阻断内源性过氧化物酶,血清封闭,加一抗,加二抗,DAB显色,脱水封片,最后显微镜镜检,图像采集分析。
1.11 统计学方法
采用SPSS 19.0统计学软件对实验数据进行统计学分析。计量资料用均数±标准差表示,多组间比较采用单因素方差分析,两组间比较采用 检验。<0.05表示差异有统计学意义。
2 结果
2.1 免疫组化检测HIF-3在骨肉瘤组织中的表达
通过对临床上收集的15例骨肉瘤组织和15例骨软骨瘤组织进行HIF-3免疫组化染色,观察骨肉瘤和骨软骨瘤组织中HIF-3的表达情况,如图1所示,骨软骨瘤组织作为对照,发现在骨肉瘤组织中HIF-3显著表达(棕黄色颗粒)(见图1B),而骨软骨瘤组织中未见表达(见图1A)。
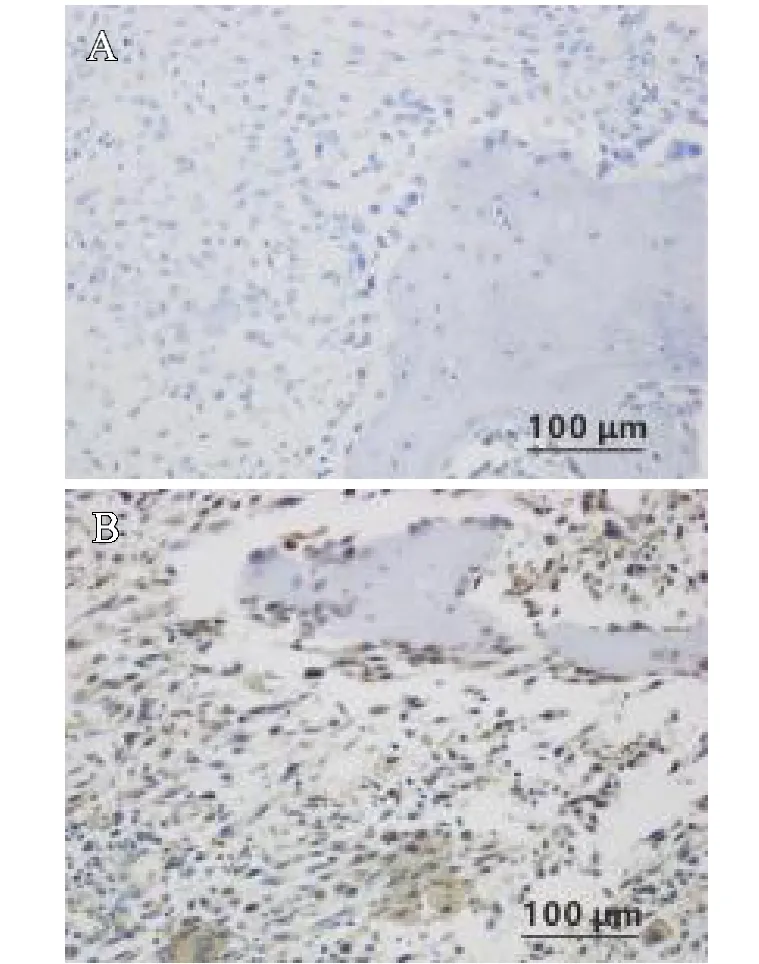
图1 组织中HIF-3的表达情况(标尺为100 m):A.免疫组化染色骨软骨瘤组织HIF-3的表达;B.免疫组化染色骨肉瘤组织HIF-3的表达
2.2 检测低氧对HIF-3表达的影响
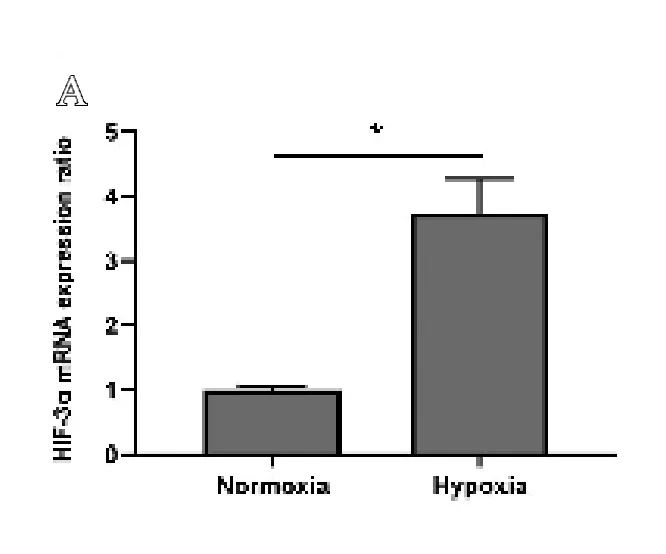
用常氧和低氧条件下培养MG-63细胞48 h后分别用定量RT-PCR和Western Blot方法检测HIF-3在转录mRNA水平和蛋白水平的表达情况,如图2所示,在低氧刺激下,HIF-3 mRNA和蛋白都明显升高,表明低氧促进了HIF-3的表达。
2.3 检测低氧对骨肉瘤MG-63细胞的黏附、迁移和侵袭能力的影响
在常氧和低氧条件下检测了MG-63细胞的黏附、迁移和侵袭能力,如表1所示,和常氧组相比低氧组骨肉瘤MG-63细胞的黏附率、迁移率和侵袭率都明显增加,差异具有统计学意义(<0.05)。

表1 低氧对MG-63骨肉瘤细胞黏附、迁移和侵袭的影响(%)
2.4 HIF-3 siRNA的筛选
笔者从广州锐博生物科技有限公司订购了3条HIF-3 siRNA,靶序列为:#1:ACAGCAGCTTGCACATT;#2:GCAGGAGCATCCACA;#3:CCAGCTGCATCGACAGT;在MG-63细胞中转染HIF-3 siRNA 72 h收集细胞,用定量RT-PCR和Western Blot方法检测HIF-3在转录组和蛋白组上的表达情况,以筛选出沉默有效的HIF-3 siRNA。如图3所示,3条HIF-3 siRNA中HIF-3 siRNA#1沉默效率最高,后续的敲降实验中用此条。
2.5 敲降HIF-3后检测骨肉瘤MG-63细胞低氧诱导的HIF-3表达情况
通过在MG-63细胞中转染HIF-3 siRNA#1后,观察常氧和低氧条件下HIF-3的表达情况,如图4所示,低氧引起的HIF-3的表达升高可以被HIF-3小干扰RNA抑制。

2.6 敲降HIF-3后检测骨肉瘤MG-63细胞低氧诱导的黏附、迁移和侵袭能力的情况
在MG-63细胞中转染HIF-3 siRNA后,检测常氧和低氧条件下MG-63细胞的黏附率、迁移率和侵袭率,如表2所示,HIF-3敲降后可以使MG-63细胞的黏附率、迁移率和侵袭率都减小,差异具有统计学意义(<0.05)。
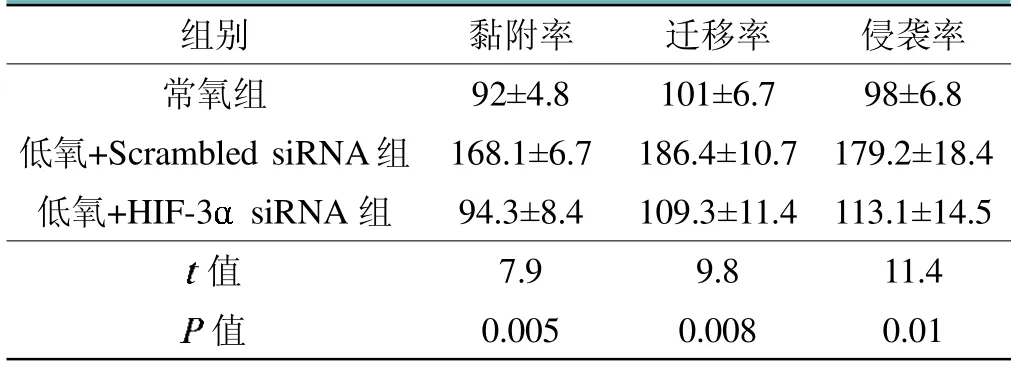
表2 敲降HIF-3后检测骨肉瘤MG-63细胞黏附、迁移和侵袭能力的情况(%)
2.7 过表达HIF-3后检测骨肉瘤MG-63细胞低氧诱导的黏附、迁移和侵袭能力的情况
HIF-3-FLAG质粒带有FLAG标签蛋白,转染过后,Western Blot检测FLAG标签蛋白,如图5所示,检测到FLAG蛋白,说明MG-63细胞HIF-3过表达成功。接着,过表达之后,检测MG-63细胞的黏附率、迁移率和侵袭率,如表3所示,HIF-3过表达后可以使得MG-63细胞的黏附率、迁移率和侵袭率都增加,差异具有统计学意义。
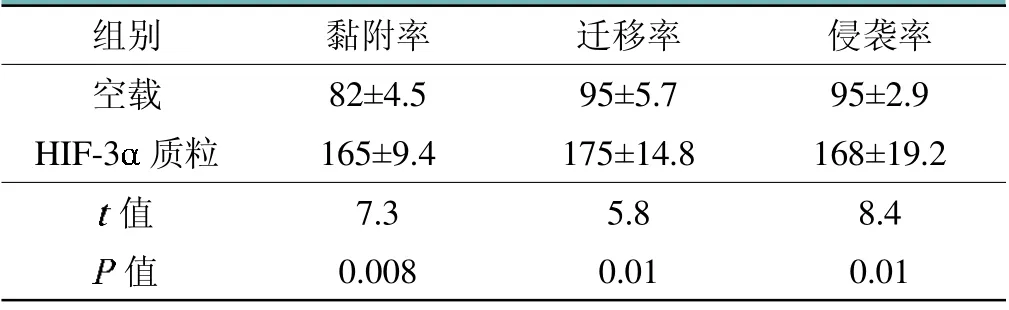
表3 过表达HIF-3后检测骨肉瘤MG-63细胞黏附、迁移和侵袭能力的情况(%)
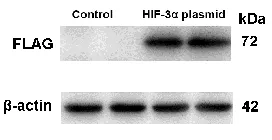
图5 MG-63细胞HIF-3质粒转染24 h后,检测标签蛋白FLAG表达情况
3 讨论
骨肉瘤是儿童和65岁以上老年人中常见的原发性恶性骨肿瘤,其病理学特征是容易复发和转移,并且对化疗的耐受性强,预后差[3]。研究表明,当肿瘤体积超过1 mm3时,氧不能完全扩散到整个肿瘤中[11]。几乎所有实体瘤都因其快速生长与营养和血液供应之间的不平衡而存在低氧,因此肿瘤细胞对低氧的适应性尤为重要。低氧诱导因子HIF既包含低氧诱导型 亚基,又包含组成型表达的 亚基,在低氧对骨肉瘤影响过程中起关键作用。HIF不仅与骨肉瘤抗药性和生存不良有关,而且与临床中的疾病等级、分期和复发有关[12-14]。有研究报道,HIF可通过直接和间接机制诱导细胞凋亡,HIF通过直接诱导促凋亡基因(如BNIP3和NIX)的表达来促进低氧条件下肿瘤细胞的存活[15]。BNIP3的表达受到HIF-2的抑制,HIF-2通过使p53泛素连接酶Mdm2失活来稳定p53,或在其与HIF-1上的氧依赖性降解域结合后诱导p53激活p53介导的细胞周期停滞并导致细胞凋亡[16]。HIF-1还可以通过激活抗凋亡基因,如Bcl-2基因家族和凋亡抑制剂(IAPs),或通过增加葡萄糖摄取和糖酵解来间接诱导凋亡并促进肿瘤细胞存活[17],在低氧条件下,HIF通过与HRE区结合来调节下游基因(如Glut-1和VEGF)的表达。有研究表明,HIF-1沉默可下调Akt的磷酸化,从而通过阻断促凋亡因子Bad和Caspase-9的活性来抑制细胞凋亡,从而通过增加IKK的磷酸化最终促进细胞存活,进而激活核因子(NF-kb)[18]。
在肿瘤领域的研究中,相比HIF-1和HIF-2,HIF-3研究相对较少,特别是在骨肉瘤的相关研究中,HIF-1和HIF-2研究的比较多,与骨肉瘤的侵袭转移相关机制做的比较深,而HIF-3的作用尚未可知,所以笔者选择HIF-3作为研究对象。有研究报道HIF-3的表达上调加速了卵巢癌进程[19],在低氧条件下,胰腺癌细胞中HIF-3表达的刺激程度高于HIF-1和HIF-2表达。HIF-3蛋白水平在胰腺癌组织中也升高,与存活率降低、局部浸润和远处转移相关,而HIF-3的敲低在低氧条件下抑制了胰腺癌细胞的侵袭和迁移。在常氧下,HIF-3的过度表达促进胰腺癌细胞的侵袭和迁移,并刺激F-肌动蛋白的聚合。总之,HIF-3通过转录激活RhoC-ROCK1信号通路促进体内胰腺癌细胞的侵袭和转移[20]。笔者通过在临床上收集骨肉瘤组织并对其做免疫组化查看HIF-3的表达情况,发现与正常组织相比,骨肉瘤组织高表达HIF-3,初步说明HIF-3与骨肉瘤关系密切,所以笔者紧接着通过细胞实验探讨HIF-3与骨肉瘤的关系。
大量文献报道低氧会促进肿瘤的侵袭转移[21],但HIF-3在其中的作用不得而知。笔者首先检测了低氧对骨肿瘤MG-63细胞中HIF-3的表达情况,发现低氧促进了HIF-3 mRNA和蛋白的表达,并且低氧促进了MG-63细胞的侵袭转移能力,紧接着通过敲降和过表达方面对HIF-3和MG-63细胞的侵袭转移关系进行研究,发现敲降HIF-3后抑制了低氧对MG-63细胞侵袭转移的诱导,过表达HIF-3后增强了低氧对MG-63细胞侵袭转移的诱导作用,说明HIF-3与MG-63细胞侵袭转移直接相关。氧气供应不足会导致低氧诱导因子(HIF)的表达,从而导致促血管生成因子的积累和肿瘤侵袭性[22-23]。笔者猜想HIF-3的升高可能会影响肿瘤侵袭相关的多种信号通路,这需要通过后续实验来探讨。
目前,预防骨肿瘤进展和骨转移发展方面取得了长足的进步。当前,临床上已经采用了几种方法来治疗骨肿瘤和骨转移。其中大多数强调预防刺激破骨细胞和阻断骨吸收或降低血液中PTHrP的浓度。应用的药物包括骨保护素、RANKFc[24]、双膦酸盐[25]、PTHrP抗体[26]和维生素D类似物。其他药物的重点是通过靶向储存在骨头中的细胞因子,如TGF-。笔者发现对肿瘤低氧的适应在肿瘤的发展和转移中都很重要。HIF-1主要在低氧条件下发挥作用,在肿瘤细胞的迁移和侵袭中起关键作用。通过药理学抑制HIF靶VEGF产生的抗血管生成作用也强调了该蛋白对于肿瘤血管生成的重要性。此外,HIFs在耐药性和抗辐射性中起着重要作用[27],这在癌症的治疗中具有重要作用。HIF途径的阻断可能为肿瘤患者提供一种新的诊疗策略。低氧是所有实体瘤所共有的特点,肿瘤低氧在临床研究中具有重要意义。低氧诱导因子1(HIF-1)是细胞对低氧反应的主要参与者,HIF-1在低氧条件下对调节肿瘤存活和生长起着至关重要的作用,因此已被列为癌症治疗目标的首位。近年来,已经发现了几种可以特异性靶向HIF途径的小分子[28-29],目前已经开发了几种针对肿瘤低氧的基因治疗策略[29-30],笔者对HIF-3的研究为开发用于临床癌症治疗的抗肿瘤药物提供了一种可行性,通过下调蛋白HIF-3来抑制肿瘤的侵袭转移,为治疗骨肉瘤提供新的治疗思路。
