聚醚醚酮基骨科植入物的改性技术研究*
2021-08-31梁新宇马静唐斌刘正伟
梁新宇# 马静# 唐斌* 刘正伟,3
聚醚醚酮(polyetheretherketone,PEEK)由于其优异的力学性能、耐化学性、良好的生物相容性和可重复灭菌处理,使其被开发为骨科应用中的新型生物材料。与金属骨替代物相比,具有低弹性模量(3~4 GPa)的PEEK植入物避免了应力屏蔽,从而提高了其长期稳定性[1]。由于其射线的可透性和非磁性,PEEK还避免了CT或MRI中的伪影,从而提高了外科医师的术后诊断准确率[2]。PEEK生物材料具有优异的耐磨性,有效避免了磨损颗粒引起的炎症和骨质溶解。然而,PEEK的生物惰性阻碍了植入后的骨整合,限制了其临床应用,因此需通过各种技术改性PEEK,以提高其生物活性。已报道的技术有3D打印[3]、表面引入孔隙[4]、羟基磷灰石(hydroxyapatite,HA)掺杂[5]和生物活性颗粒涂层[6]等,且均在一定程度上提高了PEEK材料的生物活性。但这些技术需使用98%的浓硫酸或在高温(360℃以上)条件下进行,因此仍需要探索一种新型的、无需浓硫酸或高温条件下的改性方法。
聚乳酸(polylactic acid,PLA)由于其易加工性、优异的生物相容性和可降解性已被用于多孔支架、手术缝合线、药物递送颗粒等[7]。但PLA的脆性(断裂伸长率不到10%)限制了其在需要高应力和塑性变形的植入物中的应用。鉴于具有编织结构的PEEK良好的韧性(延展性可达10%~60%)[8-9],故将PEEK编织物与PLA相结合以利用各自优势,实现PEEK基复合材料在保持原有优异力学性能前提条件下易加工改性的需求。
硫酸锶软骨素(strontium chondroitin sulfate,SrCS)是一种新型的多糖金属离子化合物,通过用锶离子代替硫酸软骨素(chondroitin sulfate,CS)上的钠离子而合成[10]。其中的CS是所有结缔组织的基本成分,是一种异质多糖,有助于抗炎、抑制细胞凋亡和形成胶原蛋白[11]。锶(Sr)是一种主要存在于骨骼中的微量元素,具有促进骨质形成、改善骨结构及治疗骨质疏松的作用[12]。故将SrCS引入具有优异力学性能的PEEK基复合材料中以提高其生物活性。因此,本研究将熔融的PLA充分填充于PEEK二维编织物中,之后在PLA/PEEK复合材料的表面上引入SrCS,以期获得易加工且兼具仿生骨力学性能和生物活性的聚醚醚酮基生物材料,提供一种新型的、无需浓硫酸或高温条件下的改性方法。
1 材料与方法
1.1 主要材料及仪器
PEEK细丝(0.3 mm,中国江苏骏华PEEK有限公司);PEEK二维编织物(深圳市精细纺织有限公司);聚乳酸颗粒(中国浙江海正生物材料有限公司);乙醇和二甲基亚砜(北京化工厂);氯仿(上海凌峰化学试剂有限公司);-MEM培养基、10%牛血清(Gibco公司,美国);噻唑蓝(MTT)(Sigma公司,美国);L929成纤维细胞(ATCC,Rockville,MD,美国);电恒温干燥箱(DHG-9140A,中国),超景深三维显微镜(VHX-5000),附有能量色散光谱(EDS)的扫描电子显微镜SEM(ZEISS Merlin,德国),X射线衍射仪(XRD)(Rigaku-Smartlab,日本);纳米压痕仪G200(Keysight Technologies,美国);万能试验机(CMT5205,中国),全自动酶标仪(BIO-RAD,美国)。
1.2 PEEK基复合材料的制备
在通风橱中,将5 g PLA颗粒溶于100 mL氯仿溶液中,磁力搅拌3 h,以确保PLA颗粒完全溶解。然后将2 g PEEK二维编织物浸入已完全溶解的PLA溶液中,真空中保持12 h,以促进PLA充分地填充于PEEK二维编织物的孔隙中和氯仿完全蒸发。再将含有PLA的PEEK二维编织物置于铜制模具中,加热至设定温度(分别为145℃、155℃和165℃)并在10 MPa压力下保持30 min。随后,采集PLA/PEEK复合材料样品并按照样品测试尺寸标准进行切割待用。在上述PLA溶液中加入100 mg SrCS粉末,再重复上述流程即可获得SrCS/PLA/PEEK复合材料。
1.3 PEEK基复合材料的表征
1.3.1 表面形貌和结构检测
PEEK基复合材料表面的结构和主要元素组成分别通过超景深三维显微镜和附有能量色散X射线光谱(energy-dispersive X-ray spedctroscopy,EDS)的SEM进行表征。
1.3.2 结晶度检测
以9 kW铜靶为辐射源,用X射线衍射仪检测了PEEK基复合材料的晶相。衍射角(2)设定在3°~30°之间,管电流和管电压分别为200 mA和45 kV。
1.3.3 宏观力学检测
使用万能试验机测量样品的宏观力学性能。根据GB 13022-1991塑料-薄膜拉伸性能试验方法[9],在环境温度和65%相对湿度下,对样品加载以5 mm/min的速度进行单轴拉伸的试验。
1.3.4 微观力学检测
通过纳米压痕仪测量样品的微观力学性能。所使用的压头尖端金刚石Berkovich探针(具有1 140 GPa的杨氏模量和0.07的泊松比)。对所有样品在随机选择的位置进行25个压痕实验,将以20 mN/min的恒定速率至峰值载荷(分别为50、100、200、300和400 mN)并保持30 s,然后卸载。
1.3.5 体外细胞增殖实验
L929成纤维细胞培养于混有-MEM培养基和10%牛血清的培养基中。样品分别为PLA/PEEK和SrCS/PLA/PEEK复合材料,每组样品设立6个平行样本。在24孔培养板中,所有样品分别经75%的乙醇溶液(浸泡2 h)和12 h的紫外线照射进行消毒灭菌处理。随后,将样品放置于加有1 mL细胞培养基的洁净24孔板中,分别在37℃、5%CO2环境下预处理12 h,再将L929成纤维细胞以每孔2×104个细胞的密度接种于24孔板中分别共培养1、3和5 d后,每孔中加入100 L 5 mg/mL MTT溶液,放回培养箱中孵育4 h。随后吸去培养基,每孔中加入1 mL DMSO(二甲基亚砜)溶液,再将24孔板用锡箔包裹以避光,并在脱色振荡器上振荡15 min。最后每孔取100 L转移到96孔板中。使用全自动酶标仪在490 nm处测定各孔吸光度值,分析各样品的细胞增殖情况。
1.4 统计学方法
使用Origin8.0统计学分析软件进行数据分析。计量数据以均数±标准差表示,组间比较采用单因素方差分析处理。<0.05为差异有统计学意义。
2 结果
2.1 PLA/PEEK复合材料的表面形貌和结构
不同热压温度(145℃、155℃和165℃)下PLA/PEEK复合材料表面的超景深图像如图1所示。结果显示,与145℃(见图1A)和165℃(见图1C)热压后复合材料相比,155℃(见图1B)热压PLA/PEEK复合材料中PEEK细丝被透明的PLA膜均匀地包裹着。不同热压温度下PLA/PEEK复合材料的横切面超景深和SEM图像如图2、图3所示。结果表明,在考察的3个热压温度下,PLA/PEEK复合材料中的PEEK细丝均被PLA包裹。

图1 不同热压温度下PLA/PEEK复合材料表面超景深图:A.145℃;B.155℃;C.165℃

图2 不同热压温度下PLA/PEEK复合材料横切面超景深图:A.145℃;B.155℃;C.165℃

图3 不同热压温度下PLA/PEEK复合材料横切面SEM图:A.145℃;B.155℃;C.165℃
2.2 PLA/PEEK复合材料的宏观力学性能
不同热压温度下PLA/PEEK复合材料的拉伸性能如图4所示。从图4中可看出,PLA/PEEK复合材料的拉伸模量和拉伸强度随着热压温度的升高呈现先增加后降低的趋势。不同热压温度下PLA/PEEK复合材料的XRD图谱如图5所示,显示了PLA衍射峰的两个位置在热压前后没有明显变化,但其强度随热压温度的增加而增强。155℃热压后的PLA/PEEK复合材料的衍射峰强度达到最大。
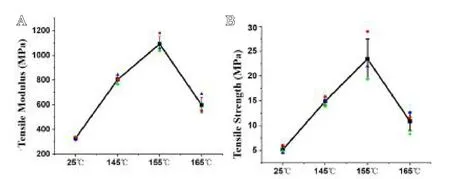
图4 不同热压温度下PLA/PEEK复合材料的拉伸性能:A.拉伸模量;B.拉伸强度
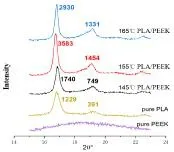
图5 不同热压温度下不同材料的XRD图谱
由于155℃热压后的PLA/PEEK复合材料具有优异的拉伸模量和强度,因此通过积分拉伸应力-应变曲线面积可获得该热压温度下复合材料的韧性(见图6)。结果表明,与单独的PLA(0.356 J/m3)或PEEK二维编织物(16.93 J/m3)相比,PLA/PEEK复合材料的韧性显著增加(54.27 J/m3)。从图6中还可以看出,PLA/PEEK复合材料的断裂伸长率(400%,见图6B)分别比PLA(1.5%,见图6A)和PEEK二维编织物的(168.56%,见图6C)提高了267倍和1.7倍。与此同时,PLA/PEEK复合材料在局部受到应力发生多个区域性断裂时仍可极大程度地保持其整体结构(见图7)。
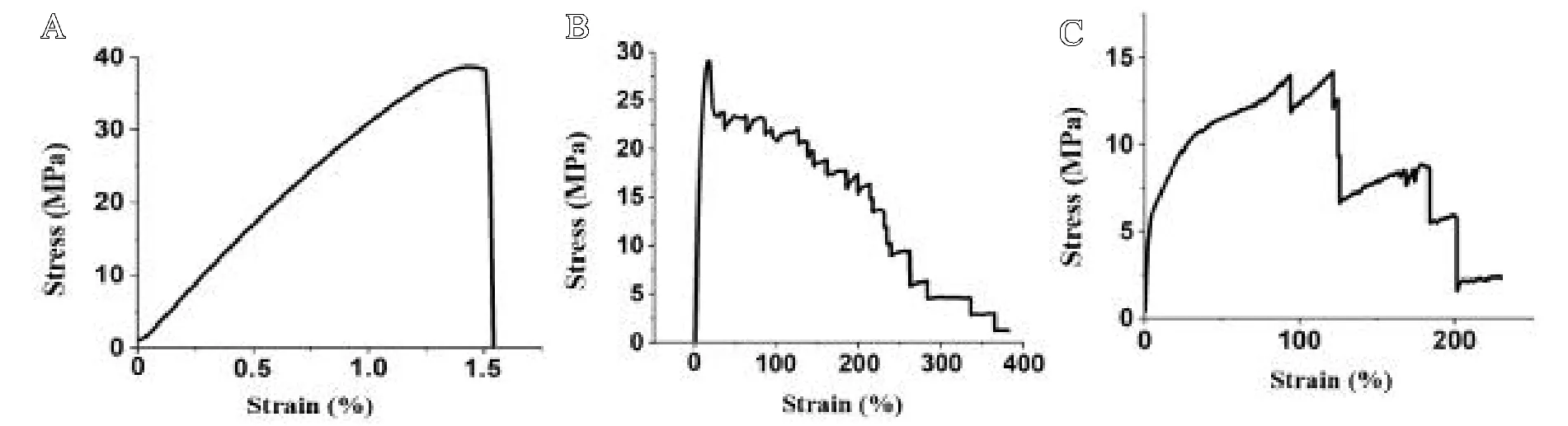
图6 材料的拉伸应力-应变曲线:A.PLA;B.PLA/PEEK复合材料;C.PEEK二维编织物

图7 PLA/PEEK复合材料拉伸测试图
2.3 PLA/PEEK复合材料的微观力学性能
不同热压温度下复合材料的微观弹性模量如图8所示。结果表明,在50 mN载荷作用下,155°C热压后的PLA/PEEK复合材料的弹性模量可达到3.5 GPa,远高于145°C和165°C热压后复合材料的。此外,155°C热压后PLA/PEEK复合材料的弹性模量随载荷的增加而下降。对于145°C和165°C热压后复合材料,其弹性模量随载荷的增加出现了先下降后升高的趋势。
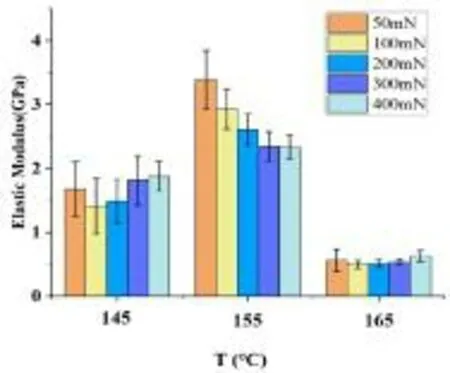
图8 PLA/PEEK复合材料多尺度弹性模量
2.4 SrCS/PLA/PEEK复合材料的力学性能
为了提高PLA/PEEK复合材料的生物活性,将SrCS引入优异力学性能的PLA/PEEK复合材料中,以获得SrCS/PLA/PEEK复合材料。从SrCS/PLA/PEEK复合材料表面的EDS图谱(见图9)中可看出Sr的峰位(2.64keV)且其质量分数约为4.57%,这说明SrCS成功地被掺杂在PLA/PEEK复合材料中。SrCS/PLA/PEEK复合材料的超景深图像如图10所示,从中可观察到SrCS相对均匀地分布在复合材料的表面上(见图10A)且与PLA/PEEK复合基体之间不存在缝隙或缺陷(见图10B),这说明SrCS的引入对PLA/PEEK复合材料的力学性能不会产生负面影响。PLA/PEEK和SrCS/PLA/PEEK复合材料的力学性能如图11所示,结果显示,与PLA/PEEK复合材料相比,SrCS/PLA/PEEK复合材料的拉伸模量提高了,而拉伸强度降低了。
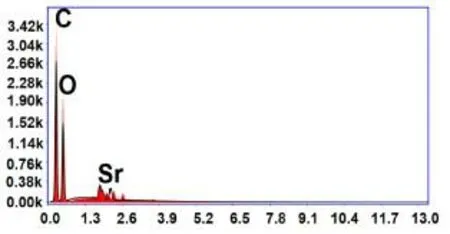
图9 SrCS/PLA/PEEK复合材料表面的EDS图谱

图10 SrCS/PLA/PEEK复合材料的超景深图片:A.SrCS/PLA/PEEK复合材料的表面形貌,其中白色颗粒是SrCS;B.SrCS/PLA/PEEK复合材料的横切面形貌

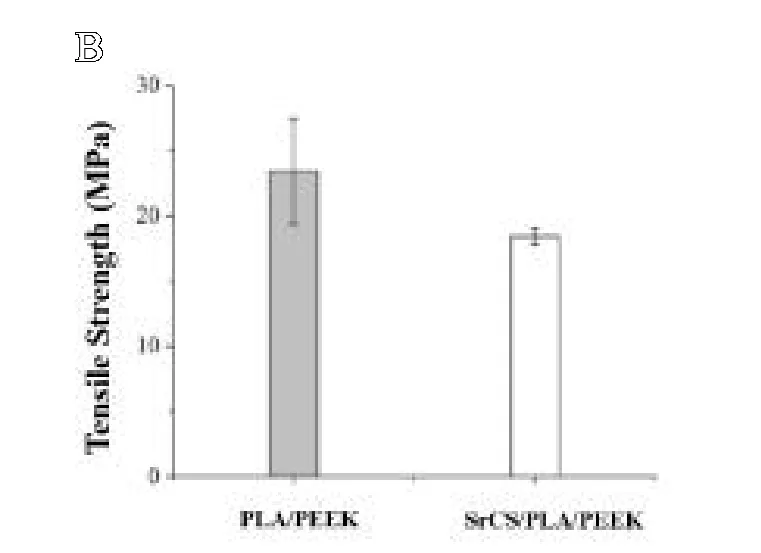
图11 PLA/PEEK和SrCS/PLA/PEEK复合材料的力学性能:A.拉伸模量;B.拉伸强度
2.5 L929细胞在SrCS/PLA/PEEK复合材料表面上的增殖
PLA/PEEK和SrCS/PLA/PEEK复合材料薄片与L929细胞分别共培养1、3、5 d后,利用MTT法检测细胞增殖情况。结果显示,共培养1、3 d时,两组细胞增殖情况未见明显差异;而共培养5 d时,可发现加入SrCS组可有效促进细胞增殖(见图12),这表明SrCS具有促进L929细胞增殖的作用。因此,SrCS的引入可提高PLA/PEEK复合材料的生物活性。
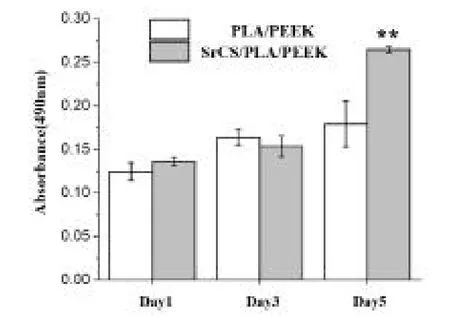
图12 不同PEEK材料分组与L929共培养细胞增殖性能测定(MTT法):**表示与L929细胞共培养5 d后,PLA/PEEK和SrCS/PLA/PEEK复合材料各自表面上的细胞增殖量比较,差异有统计学意义(<0.01)
3 讨论
松质骨多存在于骨骼远端,是由大量不规则排列的骨小梁连接组合而成的多孔网格结构。与软骨一起协同吸收和缓冲由外界力学冲击带来的能量,以维持骨骼力学稳态和保证骨骼系统的稳定性。因此,松质骨的缺损一方面因对抗外界力学冲击能力减弱使得骨骼稳定性下降,另一方面因骨骼力学稳态的失衡从而加剧了组织局部炎症反应,进而诱发包括骨关节炎和血栓等各类并发症。尤其是对于大块松质骨缺失而言,由于自体愈合速度差强人意,故需研发与松质骨力学性能匹配且具有生物活性的植入物,以解决松质骨缺损修复这一临床问题。
本研究将具有优异力学性能的聚醚醚酮(PEEK)、易加工且可降解的聚乳酸(PLA)和促进骨质形成的硫酸软骨素锶(SrCS)相结合,利用各自优势以制备出易加工、与松质骨力学性能匹配且兼具生物活性的聚醚醚酮基生物材料,从而为探索一种新型的、无需浓硫酸或高温条件下的聚醚醚酮表面改性方法提供依据。通过将溶剂浇铸和热压相结合的方法成功地复合了两种热力学性能差异较大的高分子材料(PLA和PEEK),并从3个方面展示了其力学仿生性能:①PLA/PEEK复合材料负载后的区域性断裂行为(见图6、图7)与骨骼损伤时孤立性负荷行为相似[13];②PLA/P EEK复合材料的微观弹性模量(2.3~3.5 GPa,见图8)可达到松质骨的弹性模量(2.09~26.6 GPa)下限[14];③PLA/PEEK复合材料的多尺度力学特性,即PLA/PEEK复合材料(见图8)的弹性模量随负载的增加而降低,这一趋势与松质骨的相似[14]。这些结果证实,PLA/PEEK复合材料不仅在微观和宏观层面上都获得了力学性能的改善,而且赋予了材料优异韧性和多尺度力学,这将满足骨移植材料在力学性能仿生的要求。
在155℃和10 MPa的热压条件下,PEEK细丝与PLA的结合最为紧密,形成了稳定的互锁结构。这主要是因为145℃热压条件下熔融的PLA流动性较低,在相同的热压条件下不足以覆盖PEEK纤维的表面。在155℃时,熔融的PLA能够充分地填充到二维编织PEEK的孔中。而在165℃热压条件下,PLA分子因温度升高而拥有更高的能量,其粘度降低,流动性增加[15],使得PLA/PEEK复合材料表面存在明显的空隙。因此,PLA和PEEK的复合效果主要取决于在不同热压温度下PLA的流动性。此外,与145℃和165℃热压后的复合材料相比,155℃热压后的PLA/PEEK复合材料显示了较高的结晶度,较优的拉伸模量、拉伸强度和微观弹性模量。这可能是由以下两个因素造成的:一是在加热-缓慢冷却过程中,PLA分子链进行了重新排列,使得其结晶度增加,从而使得PLA的弹性模量显著提高[16]。二是PLA和PEEK二维编织物之间的互锁程度。由于165℃热压后复合材料中存在间隙(见图1C),使得拉伸过程中应力集中从而降低了其拉伸性能[17]。Sahoo等[18]已报道纳米压痕的结果与材料的致密性密切相关,且材料的致密性随温度而变化。与此同时,与纯PLA和PEEK二维编织物相比,PLA/PEEK复合材料的韧性和断裂伸长率显著提高,并且在局部受到应力发生断裂时可保持整体结构。这表明复合材料在塑性变形和断裂过程中的能量吸收能力变强,发生脆性断裂的可能性变小[19]。这很可能是由于PLA/PEEK复合材料中的互锁结构增强了其抗断裂性。在拉伸过程中,能量通过每个互锁结构分散,小区域的断裂不会引起整体材料抗拉失效[20]。PLA/PEEK复合材料这些优异的力学性能在一定程度上将可满足高应力和塑性变形的植入物要求。由于SrCS粉末与熔融的PLA可以完全混合,因此无需浓硫酸对PEEK进行磺化或者高温(360℃以上)熔融PEEK而获得SrCS/PLA/PEEK复合材料。一方面,SrCS的引入提高了复合材料的拉伸模量,这可能归因于SrCS颗粒进一步填补了PLA和PEEK之间的微小缝隙,从而使PEEK和PLA之间的相互作用得以均匀分散和改善。Ma等[21]指出,SrCS作为增强填料,可以显著改善丝素蛋白膜的机械性能。另一方面,SrCS的引入提高了L929细胞在复合材料表面上的增殖,改善了PLA/PEEK复合材料的生物活性。综上,PLA的填充能有效提高PEEK材料的可加工性,通过机械互锁形成的PLA/PEEK复合材料具有与松质骨类似的力学特性,而SrCS的引入能有效提高其表面生物活性,因此SrCS/PLA/PEEK复合材料有潜力作为新型的骨科修复材料。
