孙氏手术治疗头臂血管严重受损的A型主动脉夹层过程中血液动力学参数的意义
2021-08-31陈磊孙江滨
陈磊,孙江滨
桂林市人民医院心脏中心三病区,广西桂林541002
前言
主动脉夹层(Aortic Dissection,AD)为临床严重心血管急症之一,可由头臂血管严重受损引起,其主要是指机体主动脉腔中的血液由主动脉的内膜破裂处流入中膜,导致中膜分离,并顺着主动脉的长轴方向进行扩展,最终使主动脉壁呈真假两腔的分离状态[1]。AD在临床中主要表现为撕裂样、刀割样疼痛,可累及肾脏、消化道、心脏等多个器官,严重威胁患者生命[2]。A 型AD 是较为严重的一种类型,其致残率、致死率极高[3]。手术是目前临床治疗A 型主动脉夹层首选方法,特别是由孙立忠教授于1998年提出的孙氏手术[4],其不仅能够明显降低手术死亡率,而且还能够降低动脉瘤、血栓等术后并发症的发生风险[5-6]。目前A 型AD 的发病机制尚不完全清楚。有研究发现机体发生该病后可引起假腔破裂和主动脉分肢动脉的供血,因此血液动力学参数在疾病的发生、发展及转归中发挥着重要作用[7-8]。本研究主要探讨孙氏手术对头臂血管严重受损的A 型AD 患者血液动力学参数的影响,旨在为临床治疗A 型AD 提供更多参考思路。
1 资料与方法
1.1 一般资料
选取2010年7月~2020年7月在桂林市人民医院就诊的125例头臂血管严重受损的A型AD患者作为研究对象,其中,男103例,女22例;年龄23~67岁,平均(51.24±3.62)岁;体质量48~76 kg,平均(56.57±2.45)kg;发病到入院时间40 min~3 d,平均(26.47±5.74)h;疾病类型:急性69例,慢性56例。
1.2 纳入和排除标准
纳入标准:①经胸腹主动脉电子计算机断层扫描(CT)血管造影及彩色多普勒超声电动图检查,所有患者确诊为A 型AD;②行孙氏手术治疗;③未合并神经系统疾病;④入院前未接受过相关治疗者;⑤患者或其家属均签订知情同意书。
排除标准:①孙氏手术禁忌证者;②凝血功能障碍者;③合并免疫系统疾病、肝肾功能不全、冠状动脉病变等患者;④有心脏手术史患者;⑤妊娠或哺乳期妇女。
1.3 手术方法
1.3.1 切皮前准备区别于常规的体外循环,在孙氏手术中需同时穿刺以及侧压左侧的上下肢,将中心静脉管置于右侧的颈内静脉。使患者仰卧、垫高上胸、颈部伸展,按照冠状动脉搭桥术对皮肤进行消毒铺巾,注意将股动脉和腋动脉的游离插管范围留出。
1.3.2 右侧腋动脉游离在右侧锁骨下方的锁骨内1/3交点处向外作1 条6~8 cm 与身体长轴垂直的切口,将胸大肌钝性分离,借助甲状腺拉钩将深部胸小肌拉至外侧,将腋静脉游离出后即进行套带,在必要情况下还应对静脉上缘1~2个分支进行结扎处理,将腋静脉拉至下方,即位于腋动脉的前下方。游离腋动脉3 cm 左右,结扎该段分肢,对近远端进行套带以备用。在游离时注意不要对周围臂丛神经造成损伤。
1.3.3 游离开胸、头臂血管按照常规体外循环对患者进行正中开胸,但上缘皮肤切口应至胸骨上窝亦或者向上偏于一侧,有时切口还应延伸到颈部。在劈胸骨时注意动作轻柔,待胸骨牵开即将残条胸腺切除,对左侧无名静脉游离。提起左侧无名静脉后向下拉使左锁骨的下动脉、左颈的总动脉以及下方无名动脉得以游离,且最好完成于肝素化前。
1.3.4 体外循环建立对主动脉弓的前后壁和头臂血管游离后即进行肝素化,采用单泵双管的动脉泵管,并使其中一根插管于腋动脉,进而建立体外循环,另一根则用于人工血管的灌注管或股动脉插管。将二阶插管插于心房,若右房需切开即插上下腔管,经主肺动脉或右上肺静脉左心引流。
1.3.5 处理主动脉近端降温处理直至心跳停止,在无名动脉近端将主动脉阻断,将近端主动脉剖开、假腔血栓清除,再将停跳液直接由左右冠状动脉开口灌入其中,按照主动脉近端病理改变对其进行处理。对直径>5.0 cm的主动脉窦患者应根据主动脉瓣的病变行主动脉瓣保留根部替换或主动脉根部替换;对直径4.0~5.0 cm 之间的主动脉窦患者,尽量先行主动脉瓣成形和窦成形,在必要情况下行主动脉窦部分替换和主动脉瓣替换;对直径<4.0 cm 的主动脉窦患者,将其主动脉窦保留,主动脉瓣替换或成形,若病变累及较为严重则行Bentall术-主动脉带瓣管道置换术。对术前即存在右冠状动脉缺血且右冠开口经术中探查受累明显患者,将其右冠开口缝闭,行右冠状动脉搭桥术。在主动脉近端处理过程中,待鼻温降到20 ℃则近端操作暂停,转而处理降主动脉和主动脉弓。
1.3.6 替换主动脉弓和植入支架象鼻待鼻温降到20 ℃,取患者头低位,将CO2吹入术野中,排空空气,对头臂血管进行分别阻断,并由右腋动脉选择性脑灌注,将主动脉弓剖开,使头臂血管横断,采用4/0 prolene 线将左锁骨下动脉近端缝闭,由主动脉弓远端口将合适型号支架象鼻植入到降主动脉真腔中,对多条主动脉弓组织进行修剪使其齐平于支架象鼻的近端人工血管。选择直径和支架象鼻差不多四分叉的人工血管,且支架象鼻降主动脉与其主血管远端吻合,采用3/0 prolene线进行连续、全周缝合,在人工血管灌注分支插入动脉泵管另一端使下半身循环恢复,并先使对应头臂血管的分支吻合于左颈总动脉,采用5/0 prolene 线进行连续缝合,开放排气后即进行复温,接着使主动脉近端与人工血管主血管吻合,采用4/0 prolene 线进行连续缝合,使心脏循环恢复,最终使左侧锁骨下动脉的分支与无名动脉吻合。
1.3.7 吻合主动脉近端对主动脉根部保留患者,在窦管交界上0.5~1.0 cm处将主动脉横断,并吻合四分叉的人工血管近端,采用3/0 prolene线进行连续缝合。若患者根部替换,则在根部手术完成后即吻合两人工血管的端端,采用4/0 prolene线进行连续缝合。
1.3.8 复苏和体外循环的脱离待全部血管吻合,充分排气使主动脉的阻断钳开放,心脏经点击复跳,肛温升至35 ℃、鼻温升至37.5 ℃后即将体外循环缓慢撤离。在复温过程中注意检查吻合是否缝闭以及出现活动性出血,停机后即回收血液。
1.3.9 中和及术后止血明确未出现活动性出血后,将鱼精蛋白和肝素按照1.5:1 比例进行快速中和,并迅速采用1个治疗单位血小板,若必要还可用新鲜血浆,使患者凝血功能快速恢复。通过补片包裹、纱布压迫对吻合口出血患者进行止血处理,若上述方法对近远端吻合口出血无效,则在右房行分流术。
1.3.10 注意事项和病例按照常规的体外循环进行关胸操作,但在胸骨闭合前注意将头臂血管放好,以免受压、打折、扭曲等,至此术毕。手术支架系统、象鼻支架及病例手术操作过程见图1和图2。
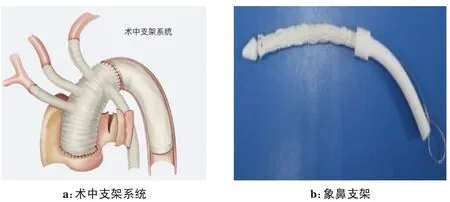
图1 孙氏手术支架系统和象鼻支架Fig.1 Stent system and elephant trunk stent in Sun's procedure

图2 孙氏手术操作过程Fig.2 Operation process of Sun's procedure
1.4 观察指标
①手术治疗情况:观察体外循环时间、主动脉阻断时间、低流量选择性脑灌时间以及同期合并手术情况;②观察并发症及30 d内死亡发生情况;③血液动力学参数:采用心脏彩超(南京世帝医疗科技股份有限公司,型号:SD60)分别对手术前后患者左室舒张末期内径(LVEDD)进行测量;对患者行锁骨下静脉或颈内静脉中心静脉置管,采用抗阻法记录手术前后患者心脏指数(CI)和中心静脉压(CVP)。
1.5 统计学方法
采用SPSS18.0统计学软件,计量资料用均数±标准差表示,手术前后血液动力学参数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 手术治疗情况
患者体外循环时间为162~234 min,平均(194.32±52.64)min;主动脉阻断时间为87~136 min,平均(103.66±33.07)min;低流量选择性脑灌时间为17~40 min,平均(23.15±7.29)min。同期44 例行Bentall手术、41例行升主动脉替换、19例行主动脉瓣成形、9例行冠状动脉旁路移植、3例行转流手术、3例行二尖瓣成形或置换、3 例行David 或Wheat 手术、1例改良Cabrol 手术、1 例三尖瓣置换、1 例主动脉瓣置换。
2.2 并发症发生情况
19例(15.20%)发生并发症,包括9例神经系统并发症,4 例脑部并发症:术后昏迷、精神症状、苏醒延迟等;3 例脊髓并发症:下肢活动功能障碍或截瘫;2例周围神经并发症:声音嘶哑。7 例多脏器功能不全甚至衰竭,且5例于围术期死亡;6例肾功能不全甚至衰竭,4 例因心包压塞或出血二次开胸;11 例胸骨哆开二次清创;1 例因心包积液开窗引流;1 例脑梗死。30 d内8例(6.40%)发生死亡,包括5例多脏器功能不全甚至衰竭、1例循环衰竭、1例肾脏功能衰竭、1例神经系统并发症。
2.3 手术前后患者血液动力学参数变化
手术后,患者LVEDD 显著降低,CVP、CI显著升高,差异有统计学意义(P<0.05,表1)。
表1 手术前后患者血液动力学参数变化(± s)Tab.1 Changes of hemodynamic parameters before and after surgery(Mean±SD)

表1 手术前后患者血液动力学参数变化(± s)Tab.1 Changes of hemodynamic parameters before and after surgery(Mean±SD)
LVEDD:左室舒张末期内径;CI:心脏指数;CVP:中心静脉压
参数手术前手术后t值P值LVEDD/mm CI/L·m-2·min-1 CVP/mmHg 47.61±3.41 4.42±1.15 6.25±1.04 41.31±2.62 6.82±1.27 9.21±0.59 7.015 6.515 6.634 0.009 0.020 0.016
3 讨论
A 型AD 具有发病急、病死率高、预后差等临床特点,多发于中老年男性群体[9]。机体发生A 型AD后,所形成的真假两腔可相通也可不通,血液在其间流动可能会形成血栓,对血液动力学参数产生影响[10]。孙氏手术作为临床治疗A 型AD 的主要治疗方法,一方面能够降低远端吻合口的出血发生风险,另一方面能提高远期假腔的闭合率,其治疗效果显著[11],但关于其对血液动力学参数影响的研究相对较少。
体外循环时间由外科手术操作时间决定,一般在3 h 内,时间越长,对机体影响越大[12];主动脉阻断时间过长,不仅可引起缺血组织缺血再灌注损伤,而且还可增加远隔器官损伤风险,并逐渐发展为全身炎性反应综合征以及多器官功能不全综合征等[13];同时有研究表明低流量选择性脑灌注存在安全时限,时间不可过长,否则会损伤机体肝、肾、脊髓等[14]。李洪荣等[15]研究显示孙氏手术可有效治疗复杂A型AD,其体外循环时间为(210.4±50.7)min、主动脉阻断时间为(92.7±28.1)min,低流量选择性脑灌注时间为(26.2±4.3)min,同期合并Bentall 手术、冠状动脉旁路移植、升主动脉替换等。本研究结果与李洪荣研究结果基本相符,表明孙氏手术可有效治疗头臂血管严重受损的A 型AD。孙氏手术的支架象鼻术综合介入和外科治疗优点,其支撑支架固定方式为吻合,不仅不需要特定主动脉锚定区,而且固定性较强、不移位;通过施压于封闭内膜的破口使血栓在假腔中形成;深低温停循环能够减轻甚至避免血流灌注时支架对机体主动脉壁造成损伤;真腔中的血流及分支血管血流灌注能够得到有效恢复,通过挤压假腔加快残余夹层中血栓形成,使主动脉壁重塑、动脉直径缩小[16-17]。
相关研究表明,A 型AD 病情紧急、病情发展迅速、预后差,若未接受手术治疗,其48 h 死亡率可达50%,且随着时间推移,其死亡率不断升高,严重威胁患者生命安全[18]。庞广辉等[19]研究显示经孙氏手术治疗后,患者预后明显改善,未见明显并发症,随访情况良好。1996年孙立忠教授从国外引入主动脉象鼻术,并于2003年在其基础上创立了孙氏手术,通过设计支架人工血管、输送装置,以及利用支架的自我膨胀特性使血管内膜口封闭,重建血管,达到治疗A型AD 的目的[20]。与国外象鼻手术相比,孙氏手术横断了左锁骨下动脉和左颈总动脉远端,上移了吻合口,改变了降主动脉远端缝合,不仅使术野更清晰、操作更简便,而且减少了体外循环时间、神经系统并发症,孙氏手术一并切除了原发破口,避免病变血管的扩张与复发[21]。
头臂血管严重受损的A 型AD 患者血管受损严重,影响心血管有效的循环血量,可能会导致多组织器官衰竭,严重时还会导致死亡。LVEDD、CI、CVP是临床常见的血液动力学参数。LVEDD能够反映机体左心室功能变化情况,当其异常升高时,则表示机体心功能受损,影响其血流动力学;CI指的是每平方米的体表面积心输出量,能够反映心脏的泵血功能,当其异常降低时,则表明机体泵血功能降低;CVP 指上下腔静脉的胸腔段及右心房压力,能够判断机体血管张力、心功能以及血容量,CVP 明显降低,则表示机体状况不佳[22-23]。张剑彬等[24]研究结果显示孙氏手术后A 型AD 患者LVEDD 明显降低;杨建国等[25]报道孙氏手术后A 型AD 患者LVEDD 降低,CVP 明显改善。本研究结果与张剑彬、杨建国的研究结果基本一致。表明孙氏手术可改善头臂血管严重受损的A 型AD 患者血液动力学参数。孙氏手术将病变血管替换为四分支的人工血管,并进行分支灌注,与自体血管吻合顺序能够根据术中需求进行调节,与原有的生理状态血流一致,其顺应性好,符合患者生理状态血液动力学,对改善患者预后意义重大。
综上所述,孙氏手术治疗头臂血管严重受损的A型AD,一方面降低了并发症发生率和短期死亡率,另一方面改善了机体血液动力学参数,值得临床参考。
