过氧亚硝酸根荧光探针的构建及细胞成像应用
2021-08-31张洪星刘景郭炜
张洪星,刘景,郭炜
(山西大学 化学化工学院,山西 太原030006)
0 引言
过氧亚硝酸根(ONOOˉ)是一种内源性的高活性氧化物,由一氧化氮自由基(NO·)和超氧自由基(O2•ˉ)通过扩散反应生成(k=6.7×109(mol/L)ˉ1·sˉ1)[1],在细胞中主要产生于线粒体和吞噬体[2]。在正常的生理条件下,ONOOˉ虽然具有低的稳态浓度(~纳摩尔)和极短的寿命(~10 ms),却发挥着重要的生理功能。例如,ONOOˉ不仅可以通过硝化络氨酸残基起到信号传导的作用、可以对入侵的病原体起到免疫作用、可以保护神经元免于凋亡,而且在维持细胞内氧化还原平衡方面起着至关重要的作用;然而,ONOOˉ过量产生可以氧化和/或硝化一系列生物分子,例如蛋白质、核酸、脂质、核酸、络氨酸残基和生物硫醇等[3],严重影响细胞正常的生理活动,甚至引起细胞凋亡和坏死。长期的ONOOˉ压力还会引发多种疾病,如心血管疾病、神经退行性疾病、自身免疫性疾病和癌症等[4]。因此,开发特异性的ONOOˉ荧光探针具有重要的生理学和病理学意义。
近年来,用来检测ONOOˉ的方法多种多样,主要有电化学分析法、电子顺磁共振法、高压液相色谱法、化学发光法、紫外可见分光光度法[5-8]等,但是这些技术普遍存在一些缺陷,如灵敏度低、侵入性、设备昂贵、操作费时等。鉴于高敏感性、可视化、生物兼容性、无辐射、实时检测等特点,荧光探针技术已经是生物学、医学领域不可或缺的研究手段,到目前为止,已经开发了大量的ONOOˉ荧光探针用于体外或体内ONOOˉ的检测。罗丹明或荧光素的还原产物是早期报道的ONOOˉ荧光探针,这类探针的发射波长通常位于可见区,且容易受到其他活性氧的干扰[9-11]。随着人们对ONOOˉ结构及性能的深入了解,一系列高选择性ONOOˉ荧光探针也陆续被报道,从反应位点分析,这些探针主要可分为 三 氟 甲 基 酮 型[12]、α-酮 酰 胺 型[13-14]、硼 酸 酯型[15-16]、有机硒/碲型[17]、酰肼型[18-19]、对羟基苯胺型[20-22]、C=C 双键裂解型[23]、二苯基膦型[24-25]等。上述研究成果对于人们更好地理解ONOOˉ的生理功能以及与ONOOˉ的相关疾病有极大的帮助。然而,上述大部分探针仍存在由于水溶性差导致的生物兼容性差、发射波长短(<600 nm)、灵敏性低、易受其他活性氧化物(Reactive oxygen species,ROS)干扰的问题,因此大多不适用于生物系统中ONOOˉ检测。发射波长位于红及近红外区(>600 nm)的荧光探针因具有更深的组织成像深度、小的光损伤以及受生物自发荧光干扰小的特点,因此在组织、活体荧光影像时具有比可见区荧光染料更高的时空分辨率。此外,鉴于ONOOˉ活泼的化学性质、短的寿命和低的稳态浓度,如何避免生物体内其他活性氧,尤其是次氯酸根(hypochlorite,ClOˉ)、羟基自由基(hydroxyl radical,HO·)和过氧化氢(hy⁃drogen peroxide,H2O2)的干扰,仍然是该领域的重要挑战。
罗丹明类荧光染料由于具有荧光量子产率高、生物兼容性好、细胞器靶向性好以及发射波长易于调控等优点,是荧光探针领域备受青睐的染料平台之一。其中,吡罗红染料因包含了罗丹明染料的母体结构,因此具有与其类似的光物理性质;除此之外,该染料的荧光性质不仅易受光诱导的电子转移(photoinduced electron transfer,PET)荧光调控机理所调控,而且当该染料的9-位被不同取代基取代后,光物理性质会发生明显的变化:供电子基团能导致发射波长蓝移,吸电子基团或硫醇官能团能导致发射波长红移。吡咯是天然五元杂环芳香化合物,具有较大的电子云密度,因此极易被氧化剂氧化。此外,与PET 机理中经典的单原子供体(如O,N,Se,Te 等)相比,更富电子的吡咯结构将会通过“增强的PET(Enhanced PET)”过程更有效的猝灭荧光团的荧光,从而实现低背景和高信噪比[26]。本工作基于“9-氯吡罗红”平台,将2,4-二甲基吡咯反应位点直接与吡罗红染料的9 号位连接,合成了一个“2,4-二甲基吡咯-吡罗红”荧光探针PyP(图1)。由于从富电子的2,4-二甲基吡咯基团到吡罗红“增强的PET”作用,探针PyP 具有极低的背景荧光;与ONOOˉ作用后,探针在624 nm 处的荧光强度增强128 倍,对ONOOˉ的检出限为2.3 nmol/L。此外,该探针具有优良的水溶性和生物兼容性,可以用于Raw264.3 细胞(小鼠单核巨噬细胞白血病细胞)中外源性及内源性ONOOˉ的传感。
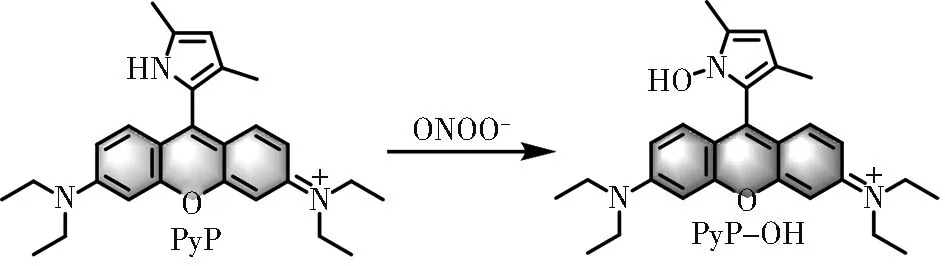
图1 探针PyP 与ONOOˉ响应机理示意图Fig. 1 Proposed ONOOˉsensing mechanism of PyP
1 实验部分
1.1 仪器与试剂
吡罗红B、2,4-二甲基吡咯、草酰氯购于北京伊诺凯科技有限公司,细胞计数试剂盒(CCK8)购于北京索莱宝科技有限公司,NOC-9、SIN-1 购于西格玛奥德里奇(上海)贸易有限公司,其他常用试剂购于阿拉丁试剂有限公司,上述所有原料均为市售分析纯或化学纯,如无特殊说明则没有进一步提纯;实验用到的溶剂购于当地经销商,溶剂使用前均按照标准进行干燥处理;所有反应经磁力搅拌进行,反应过程用薄层色谱(TLC)监测,反应产物用柱色谱分离提纯。紫外-可见吸收光谱图在紫外-可见分光光度计(Varian Carry 4000,日本)上测定;荧光光谱图在荧光光谱仪(Hitachi F-7000,日本)上测定;核磁共振氢谱和碳谱(1H NMR 和13C NMR)在核磁共振氢谱仪(Bruker AVANCE III HD,瑞士)上测定,其中,氢谱为600 MHz,碳谱为150 MHz;高分辨质谱图在质谱仪(Varian QFTESI,德国)上测定;细胞成像数据在共聚焦显微镜(Ceiss LMS 710,德国)上测定。
1.2 探针的合成及表征
1.2.1 化合物2的合成
将 化 合 物1(0.358 g,1.0 mmol)和KCN(0.195 g,3.0 mmol)溶解在10 mL 水中,反应液加热回流18 h 后冷至室温,过滤得固体,将固体溶解在2.0 mol/L 的HCl 中(100 mL),然后逐滴 加入FeCl3·6H2O(0.807 g,3.0 mmol)的HCl 溶 液 中(2.0 mol/L,10 mL),反应液在90 ℃时反应12 h 后冷至室温,过滤得固体,将固体溶解在50 mL 的NaHCO3饱和溶液中回流反应3 d,反应结束后冷却至室温,过滤得粗品。粗产品经柱色谱(CH2Cl2/MeOH,50:1V/V)分离得亮黄色固体(0.134 g,产率39.7%)。1H NMR(600 Hz,CDCl3)δ8.10(d,J= 9.0 Hz,2H),6.65(dd,J1= 1.8 Hz,J2= 9.0 Hz,2H),6.69(s,2H),3.46(q,J=7.2 Hz,8H),1.25(t,J= 7.2 Hz,12H);13C NMR(150 MHz,CDCl3)δ177.099,161.402,154.921,130.754,114.531,111.513,99.266,47.652,15.459;ESIMS:[M+H] + calcd for 339.2066,Found 339.2067。
1.2.2 探针PyP的合成
在N2 保护下,将氧杂蒽酮2(0.338 g,1 mmol)溶解在干燥的CH3CN(10 mL)中,向上述溶液中逐滴滴入草酰氯(73 μL),室温反应2 h 后在旋转蒸发仪上蒸干溶剂,得到的中间体无须提纯,直接用于下一步反应中。将2,4-二甲基吡咯(0.475 g,5 mmol)和上述中间体(0.196 g,0.5 mmol)溶解在CH2Cl2(10 mL)中,室温反应5 min 后,蒸干溶剂,粗产品经柱色谱(CH2Cl2/MeOH=15/1)分离得到化合物PyP(0.22 g,产率97.6%),合成路线见图2。
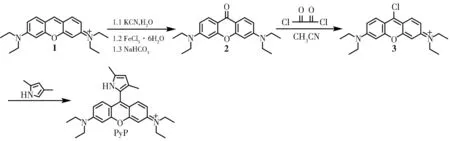
图2 探针PyP 的合成路线Fig. 2 Synthetic route of probe PyP
1H NMR(600 Hz,CDCl3)δ12.47(s,1H),7.95(dd,J1= 1.8 Hz,J2= 9.0 Hz,2H),6.89(d,J=9.6 Hz,2H),6.59(s,2H),6.05(s,1H),3.56(q,J= 7.2 Hz,8H),2.56(s,3H),2.05(s,3H),1.30(t,J= 7.2 Hz,12H);13C NMR(150 MHz,CDCl3)δ173.9,160.6,157.2,151.8,142.6,137.9,131.1,123.5,115.7,115.5,98.7,48.4,17.1,16.5,16.3,15.5;ESI-MS:[M+H]+ calcd for 416.2696,Found 416.2697。
1.3 待测物的配置
探针PyP 用乙腈配成2 mmol/L 的储存液;GSH用蒸馏水配成20 mmol/L的储存液;O2⋅-溶液是将KO2和18-Crown-6(1 当量)溶于二甲基亚砜(DMSO)中制得;HO·是通过Fenton 反应(Fe2++H2O2)制得,其浓度等于Fe2+浓度;1O2溶液是通过次氯酸钠溶液(NaOCl)与双氧水溶液(H2O2)的反应制得,其浓度等于NaOCl 浓度;NO 是将商业化NO 供体NOC-9 溶解于0.1 mol/L 的NaOH 中制得;H2O2溶液通过稀释市售的过氧化氢制得,其浓度由240 nm处的吸光度值计算确定(摩尔消光系数为43.6(mol/L)ˉ1·cmˉ1);ClOˉ溶液通过稀释市售的NaClO制得,其浓度由292 nm处吸光度值计算确定(摩尔消光系数为350(mol/L)ˉ1·cmˉ1);ONOOˉ根据文献中报道的方法制得[27],其浓度由302 nm 处吸光度值计算确定(摩尔消光系数为1 670(mol/L)ˉ1·cmˉ1),进行细胞实验时,ONOOˉ是由商业化ONOOˉ供体SIN-1 溶解于0.1 mol/L 的NaOH 中产生。
1.4 细胞成像实验
Raw264.7 细胞购于通派(上海)生物科技有限公司。将Raw264.7 细胞培养在含有10%胎牛血清(FBS)及1%抗生素的1 640 培养液中,将细胞按照1×105 个/孔的密度铺在共聚焦玻底皿中(直径=30 mm),待细胞贴壁后备用。在影像内源性ONOOˉ的实验中,细胞需预先用包含或不包含抑制 剂(AG、TEMPO 和FeTMPyP)的LPS(1 mg·mLˉ1)和IFN-γ(50 ng·mLˉ1)处理6 h,然后再孵化探针PyP(2 μmol/L)15 min;在影像外源性ONOOˉ的实验中,细胞需用PyP(2 μmol/L,15 min)处理,再用SIN-1(1 mmol/L,30 min)处理,细胞用PBS洗涤3 次,成像。激发波长为561 nm;发射收集波长为570 nm~750 nm。
1.5 细胞毒性实验
Hela 细胞购于通派(上海)生物科技有限公司。HeLa 细胞培养于含10%胎牛血清(FBS)及1%抗生素的DMEM 培养液中,将细胞按照8×103/孔的密度铺在96 孔板中,待细胞贴壁后更换溶有2、4、6、8 和10 μmol/L 探针PyP 的新鲜培养基,每个浓度梯度重复6 次,细胞继续孵化24 h。细胞用PBS 洗涤3次后,更换含有10%CCK-8 的新鲜培养液,细胞继续孵化30 min。然后用酶标仪(SpectraMax 190)测量450 nm 处的OD 值。细胞存活率通过下述公式进行计算:细胞存活率=(Awithprobe-Ablank)×100%或(Acontrol-Ablank)×100%。
2 结果与讨论
2.1 探针的光物理性质
为了验证探针PyP 在PBS 中可以稳定存在,首先测试了探针在PBS 中的荧光光谱图,如图S1 所示,探针在PBS 中放置30 min 不会引起荧光信号的改变。接下来,验证探针PyP 对活性氧化物的传感性能,我们首先通过紫外-可见吸收光谱研究探针PyP 与代表性活性氧化物的响应情况。如图3(A)和图S2 所示,在PBS 缓冲体系中,探针的最大吸收峰值为558 nm,当向探针中逐渐加入10 当量常见的活 性 氧 化 物 后,包 括1O2,H2O2,ClOˉ,O2•ˉ,BO3ˉ,NO2ˉ,NOC-9,OH·和ONOOˉ,仅有ONOOˉ能引起探针PyP 吸收光谱的改变,即探针在558 nm 处的吸收峰消失,在580 nm 处出现了新的吸收峰。由于细胞内GSH 的浓度高达1 mmol/L~10 mmol/L,Cys 的浓度高达200 μmol/L,考虑到实际的活细胞应用,我们还测试了探针与GSH 和Cys 的反应性能,如 图S2(I,J)所 示,1 mmol/L 的GSH 和200 μmol/L 的Cys 均不会引起探针吸收光谱的改变。为进一步探究探针PyP 与ONOOˉ的反应历程,测试了其与不同浓度ONOOˉ的反应动力学,如图S3所示,随着ONOOˉ浓度的逐渐增加,探针在558 nm处的吸收峰逐渐下降,在580 nm 处的吸收峰逐渐增强,当ONOOˉ的浓度为20 μmol/L 时,探针达到了饱和,探针与ONOOˉ反应前后最大吸收峰红移了22 nm,说明探针与ONOOˉ的反应产物具有吸电子的诱导效应。荧光光谱如图3(B)和图S4 所示,由于从2,4-二甲基吡咯到吡罗红的PET 作用,探针几乎没有荧光,随着ONOOˉ浓度的逐渐增加,探针在624 nm 处出现了新的发射峰,且荧光强度随着ONOOˉ浓度的增加而增大,荧光强度增强128 倍,反应产物的红色荧光可在紫外灯照射下通过肉眼明显观测到(图3B 插图)。为了研究探针荧光强度与ONOOˉ浓度的线性关系,我们进行了荧光滴定实验并制作了工作曲线,如图3(C-D)所示,探针在624 nm 处的荧光强度与ONOOˉ的浓度(0 μmol/L~10 μmol/L)呈良好的线性关系,线性相关系数为0.999,探针对ONOOˉ的最低检出限(S/N=3)为2.3 nmol/L。鉴于细胞内低的ONOOˉ浓度,进一步研究了探针与小当量ONOOˉ的滴定实验,如图S5 所示,探针在624 nm 处的荧光强度与ONOOˉ的浓度(0 μmol/L~2 μmol/L)仍然呈良好的线性关系。
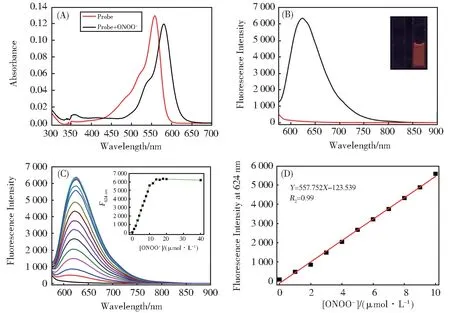
图3 探针PyP(2 μmol/L)与ONOOˉ(20 μmol/L)反应前后的紫外-可见吸收光谱图(A)及荧光光谱图(B);(C)向探针PyP(2 μmol/L)中加入ONOOˉ(0 μmol/L~40 μmol/L)后的荧光光谱图;(D)PyP 对ONOOˉ的工作曲线Fig. 3 (A)Absorbance and(B)fluorescence spectra of PyP(2 μmol/L)upon addition with ONOOˉ(20 μmol/L);(C)Fluorescence spectra of probe PyP(2 μmol/L)in the presence of ONOOˉ(0-40 μmol/L);(D)A plot of F624 versus the concentration of ONOOˉin the range of 0-10 μmol/L
随后,研究了探针PyP(2 μmol/L)对ONOOˉ的荧光选择性及抗干扰能力。如图4 所示,向含有探 针 的PBS 体 系 中 加 入1O2,H2O2,ClOˉ,O2•ˉ,BO3ˉ,NO2ˉ,NOC-9,OH·,ONOOˉ,GSH 和Cys后,仅有ONOOˉ能引起624 nm 处荧光强度的显著增强。此外,我们在上述竞争物存在的条件下分别测试了探针对ONOOˉ的响应情况,如图S6 所示,探针能在各种竞争物存在下对ONOOˉ进行识别。最后,研究在不同pH 条件下探针PyP 与ONOOˉ的反应性能,结果显示,探针在2~12 的pH 范围内均显示可忽略的荧光,当加入20 μmol/L 的ONOOˉ后,探针在6~10 的pH 范围内观察到明显的荧光信号(图S7),说明探针可以在生理pH 范围内对ONOOˉ进行传感,这为探针的实际应用提供了可能。以上结果说明,探针PyP 可以在生理pH 条件下高选择性地传感ONOOˉ荧光探针。鉴于良好的水溶性,该探针有望在细胞水平实现对ONOOˉ的实时传感。
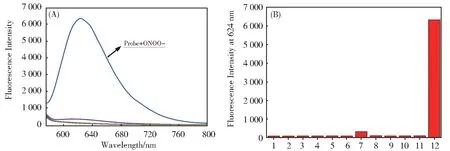
图4 探针PyP(2 μmol/L)与ONOOˉ及其他ROS、GSH 和Cys 反应1 min 后的荧光光谱图(A)及柱状图(B)。(1)只有PyP;(2)1O2;(3)H2O2;(4)ClOˉ;(5)O2ˉ;(6)BO3ˉ;(7)NO2ˉ;(8)NOC-9;(9)OH·;(10)GSH;(11)Cys;(12)ONOOˉ。激发波长为565 nm;发射波长为624 nm;狭缝为10/10 nm;电压为600 VFig. 4 Fluorescence spectra(A)and bar chart(B)of PyP(2 μmol/L)toward ONOOˉand other ROS(10 μmol/L)after 1 min. (1)PyP only;(2) 1O2;(3)H2O2;(4)ClOˉ;(5)O2ˉ;(6)BO3ˉ;(7)NO2ˉ;(8)NOC-9;(9)OH·;(10)GSH;(11)Cys;(12)ONOOˉ. λex/λem=565 nm/624 nm;Slits:10/10 nm;voltage:600 V
2.2 探针的响应机理研究
为了探究探针PyP 与ONOOˉ的反应机理,接下来我们模拟体外测试的条件,在PBS体系中进行了PyP与ONOOˉ的放大反应,并分离得到了反应产物。经薄层色谱监测反应液,我们发现PyP 与ONOOˉ的反应产物有两个,主要产物是具有红色荧光的物质,少量副产物是没有荧光的物质,二者的含量大约是3:1。为了验证其具体结构,将探针及其与ONOOˉ反应的两个产物进行了质谱分析。如图5 中质谱数据显示,探针PyP 本身的信号峰为m/z=416.267 6;红色荧光物质的信号峰为m/z=432.264 0,证实生成了羟基化产物PyP-OH;少量副产物的信号峰为m/z=461.252 3,证实生成了硝基化产物PyP-NO2,这与ONOOˉ共轭酸形式能分解为HO·和NO2·的情况一致(ONOOˉ⇌ONOOH ⇌HO·+NO2·)[28]。为进一步确定反应产物的结构,我们将探针及其与ONOOˉ反应的两个产物进行了核磁分析。如图6 所示,在氘代氯仿中,PyP 中吡咯结构上N-H 的化学位移在12.47 ppm,C-H 的化学位移在6.05 ppm;羟基化产物PyP-OH中吡咯结构上N-H的峰消失,这说明羟基化反应发生在探针的吡咯NH 位置;硝基化产物PyP-NO2中吡咯结构上C-H的峰消失,这说明硝基化反应发生在探针的吡咯环上。基于这些信息,我们推测探针PyP 与ONOOˉ的反应是单电子氧化机理。由于探针与ONOOˉ反应生成的产物为PyP-OH,为进一步验证OH·不会干扰PyP 对ONOOˉ的检测,我们进行了探针PyP 与OH·的滴定实验,如图S8 所示,随着OH·浓度的增加(20 μmol/L~250 μmol/L),探针PyP 在624 nm 处的发射峰仅有微弱的升高。考虑到细胞内具有极低的OH·浓度,因此OH·不会干扰探针对ONOOˉ的检测。
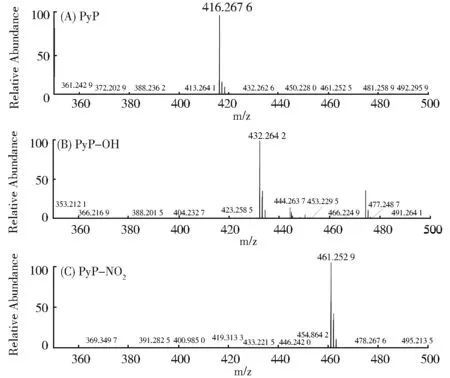
图5 探针PyP 及其与ONOOˉ反应产物的质谱图Fig. 5 Mass-spectroscopy analysis of PyP or the reaction products of PyP treated with ONOOˉ
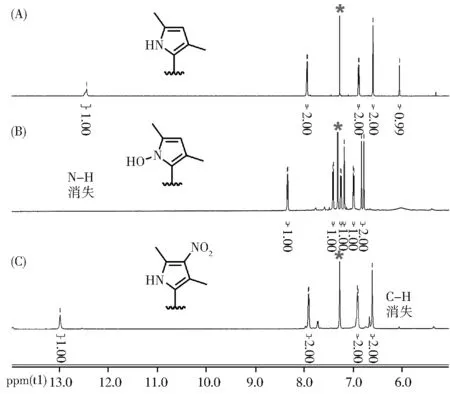
图6 探针PyP 及其与ONOOˉ反应产物的氢谱结果Fig. 6 1H NMR analysis of PyP or the reaction products of PyP treated with ONOOˉ
2.3 活细胞荧光成像
进行活细胞成像之前,首先用CCK-8 试剂盒评价探针的细胞毒性。如图S9 所示,HeLa 细胞用不同浓度的PyP(0 μmol/L~10 μmol/L)处理24 h后,细胞存活率在60%左右,说明大浓度的探针会对细胞产生一定的毒性。然而,当选用2 μmol/L 的PyP 作为细胞影像的工作浓度时,细胞存活率大于90%,说明此浓度的探针适合生物成像研究。随后,选取Raw264.7 细胞作为发炎细胞模型,验证探针PyP 影像细胞中外源性及内源性ONOOˉ的能力,如图7(A,B)所示,当Raw264.7 细胞经PyP(2 μmol/L,15 min)处理后,细胞中呈现出可忽略的荧光信号;当Raw264.7 细胞先经PyP(2 μmol/L,15 min)处理,再经SIN-1(一种常见的ONOOˉ供体)处理后,细胞中可观察到明显的红色荧光信号,说明探针可以影像Raw264.7 细胞中外源性的ONOOˉ。此外,探针影像内生ONOOˉ的能力如图7(C-F)所示,Raw264.7 细胞先用脂多糖(LPS)和γ-干扰素(IFN-γ)处理6 h 刺激产生ROS 后,再孵化探针15 min,细胞内可观测到红色荧光信号;Raw264.7 细胞若先用包含ROS 清除剂(AG、TEMPO 和FeTMPyP)的脂多糖(LPS)和γ-干扰素(IFN-γ)处理6 h 后,再孵探针15 min,细胞内观察不到红色荧光信号的产生,说明该红色荧光信号是由ONOOˉ的产生引起的。由此可知,探针PyP不仅具有低的细胞毒性、好的亲水亲油性及良好的细胞渗透能力,而且可以影像巨噬细胞中外源性及内源性的ONOOˉ。

图7 RAW264.7 细胞的细胞成像图。(A)细胞用PyP(2 μmol/L,15 min)处理后影像;(B)细胞先用PyP(2 μmol/L,15 min)处理,再用SIN-1(1 mmol/L,30 min)处理后影像;(C)细胞先用LPS(1 mg·mL-1)和IFN-γ(50 ng·mL-1)刺激6 h,再用PyP(2 μmol/L,15 min)处理后影像;(D)细胞先用LPS(1 mg·mL-1)、IFN-γ(50 ng·mL-1)和AG(5 mmol/L)共同刺激6 h,再用PyP(2 μmol/L,15 min)处理后影像;(E)细胞先用LPS(1 mg·mL-1)、IFN-γ(50 ng·mL-1)和TEMPO(300 μmol/L)共同刺激6 h,再用PyP(2 μmol/L,15 min)处理后影像;(F)细胞先用LPS(1 mg·mL-1)、IFN-γ(50 ng·mL-1)和FeTMPyP(30 μmol/L)共同刺激6 h,再用PyP(2 μmol/L,15 min)处理后影像;(G)A-F 的荧光定量图。荧光信号收集范围在570 nm~750nm(λex:561nm),标尺为20 μmFig. 7 Fluorescence images of RAW264.7 murine macrophages under different conditions. (A)cells were treated with PyP(2 μmol/L,15 min)and then imaged;(B)PyP-loaded cells were treated with SIN-1(1 mmol/L,30 min)and then imaged;(C)cells were stimulated with LPS(1 mg·mL-1)and IFN-γ(50 ng·mL-1)for 6 h and then with PyP(2 μmol/L,15 min);(D)NOS inhibitor AG(5 mmol/L)was co-incubated during LPS/IFN-γ stimulation and then with PyP(2 μmol/L,15 min);(E)superoxide inhibitor TEMPO(300 μmol/L)was co-incubated during LPS/IFN-γ stimulation and then with PyP(2 μmol/L,15 min);(F)FeTMPyP(30 μmol/L)was co-incubated during LPS/IFN-γ stimulation and then with PyP(2 μmol/L,15 min)(G)Quantification of fluorescence intensities of confocal microscopy images of RAW264.7 murine macrophages obtained under conditions A-F. The image from the band path of 570-750 nm upon excitation of 561 nm. Scale bar:20 μm
3 结论
综上所述,本工作基于增强的PET 机理,将2,4-二甲基吡咯反应位点与吡罗红荧光团的9 号位通过共价键直接相连,设计合成了新型的荧光探针PyP。探针PyP 可以高选择性、高特异性对ONOOˉ作出荧光增强的响应。此外,探针PyP 具有好的水溶性及稳定性、长的吸收和发射波长和优良的生物兼容性,可以用于影像RAW264.7 细胞中外源性及内源性的ONOOˉ。该探针的开发对于人们了解ONOOˉ的生理功能以及ONOOˉ相关疾病诊断方面具有潜在的应用价值。
