电压门控钾通道作为疼痛治疗的新靶点在慢性疼痛模型中的变化特征*
2021-08-31张诗嘉刘文涛张广钦
张诗嘉 刘文涛 张广钦
(1 徐州医科大学药学院,徐州221004;2 南京医科大学江苏省神经退行性疾病重点实验室,南京211166;3 中国药科大学临床药学教研室,南京210009)
疼痛是一种与实际或潜在的组织损伤相关的不愉快的感觉和情绪情感体验,或与此相似的经历[1]。疼痛信号传递依赖于伤害性神经元的活动,这些神经元将伤害性刺激从外周通过动作电位传导到中枢神经系统。神经病理性疼痛(neuropathic pain, NP)是由躯体感觉神经系统的损伤或疾病而造成的慢性疼痛。炎症性疼痛是由炎症介质作用于外周伤害性感受器,诱发疼痛神经兴奋性增强所致。由此可见,两种疼痛均伴随有痛觉神经元兴奋性增加。
慢性疼痛治疗的目标是缓解疼痛和改善临床症状,全面提高生活质量。令人遗憾的是,现有的镇痛药物对于慢性疼痛的治疗效果差强人意,迫切需要开发更安全有效的新药。目前选择性靶向离子通道新型化合物成为新型镇痛药物研发热点[2],而开放钾通道可以使细胞超级化并降低兴奋性,在疼痛领域受到了很多关注。
钾通道根据结构和生理特性分为电压门控钾通道(KV)、钙激活的钾通道(KCa)、双孔钾通道(K2P)和内向整流钾通道(Kir),其中KV通道在疼痛进程中尤为重要[3]。
本文聚焦KV通道在神经病理性疼痛和炎症性疼痛模型上的变化特征,尤其是KV通道与背根神经节(dorsal root ganglion, DRG)神经元兴奋性之间的关系,并探讨药物作用的潜在靶点,为临床应用钾通道调节剂治疗疼痛提供理论依据,也为新型镇痛药物开发提供新思路。
一、电压门控钾通道亚型及 DRG 功能调控
1.电压门控钾通道亚型及在DRG 神经元上的分布[4]
KV通道是由4 个功能性α 亚基构成的同型四聚体,每个α 亚基含6 个跨膜结构域S1-S6,分别为电压感受器区域(S1-S4)和由S5 和S6 区域构成的围孔区域。根据蛋白质整个疏水核心的氨基酸序列,KV通道可分为12 个KV通道亚家族,根据离子渗透性分为8 个通透型,4 个沉默型。目前已知与疾病发生相关的主要是通透型,沉默型与疾病的关系并不十分清楚。通透型KV通道亚家族各亚型及在DRG 神经元上的分布见图1。
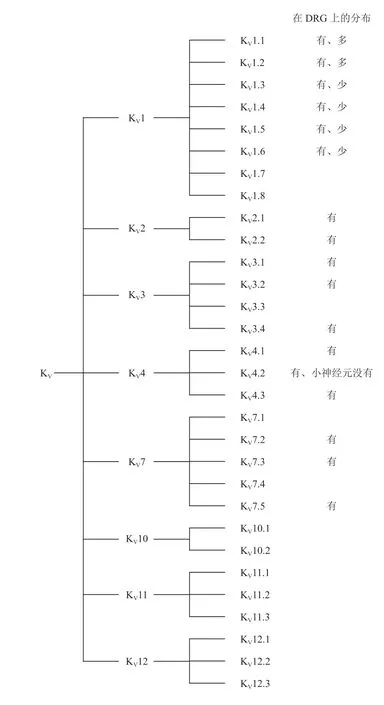
图1 电压门控钾通道亚型及在DRG 神经元上的分布
2. DRG 神经元与电压门控钾电流
DRG 神经元是初级感觉神经元 (primary sensory neurons, PSNs),能够将外周初级感觉信号传递给脊髓。DRG 是PSNs 的胞体所在位置,因此,DRG 成为临床上治疗疼痛的重要位点。从形态学上可将DRG 分为大、中、小三类神经元。DRG 中、小神经元主要发出细的有髓鞘的Aδ 纤维和无髓鞘的C 纤维,传递伤害性感觉;而有髓鞘的Aβ 粗纤维则起源于大的DRG 神经元,主要传递非伤害性感觉。在此过程中,DRG 上多种电压门控离子通道参与兴奋性的传导,其中电压门控钾通道(KV)在静息膜电位、动作电位(action potential, AP)的产生和神经兴奋性中发挥着重要调节作用。在DRG 神经元上天然KV电流分为两大类:A 型电流(IA)和延迟整流电流(IK),分别对4-氨基吡啶(4-AP)和四乙基铵(TEA)敏感。IA主要由KV1.4、KV3.4、KV4.2和 KV4.3 组成, IK主要由 KV1.1、KV1.2、KV2.1 和KV2.2 组成。A 型K+电流参与神经冲动发放间隔时间的延迟和动作电位发放频率的降低,而持续延迟整流型K+通道则参与动作电位阈值,AP 复极化和神经元AP 数目的变化,提示K+通道在DRG 神经元兴奋性中发挥不同的作用[5]。
二、神经病理性疼痛与电压门控钾通道
1.慢性压迫性神经损伤模型 (chronic constriction injury, CCI)
大鼠CCI 7 天后,引起同侧足部退缩所需的机械力和温度显著降低,提示触觉超敏和热痛觉过敏。在DRG 小神经元上,全细胞膜片钳记录显示IA和IK电流在CCI 模型大鼠上均明显小于正常大鼠,CCI 使DRG 神经元激发动作电位的电流阈值(基强度)和去极化静息膜电位明显低于对照组,提示KV电流下调。部分同侧DRG 神经元自发动作电位和重复放电增加,这些结果表明,DRG 神经元IK和IA电流密度的改变以及伴随的传入性兴奋性增高可能与损伤后的神经病理性疼痛有关[5]。
2.慢性背根神经节压迫模型 (chronic compression of the dorsal root ganglion, CCD)
CCD 是由椎间孔内狭窄或其他影响DRG、脊神经或脊神经根的疾病引起的一种神经性疼痛。小鼠CCD 1~7 天,引起CCD 同侧足部退缩(触觉性痛觉)所需的机械力阈值较术前显著低。CCD 7~10天,DRG 小神经元表现出IK电流密度增加,而IA不改变。CCD 神经元上动作电位具有较低的电流阈值和较负的阈电位。虽然IK增加的机制尚待阐明,但推测IK增加可能是CCD 损伤后神经元活动增强的一种代偿机制。这种作用可以抑制DRG 异常放电[6]。CCD 5~7 天,在DRG 中神经元上,CCD模型的IK电流密度较正常动物明显降低,但IA不变。CCD 导致动作电位产生电流的阈值降低,DRG 神经元兴奋性增加[7]。
3.脊髓损伤模型 (spinal cord injury, SCI)
瞬时IA钾电流在DRG 神经元中可以根据失活动力学进一步分为至少2 个亚型即快失活和慢失活IA电流[8]。慢失活的IA电流优先表达于小的、辣椒素敏感的膀胱传入神经元上。
在辣椒素敏感的膀胱传入神经DRG神经元上,慢失活的IA峰值电流密度脊髓切断大鼠明显小于脊髓完整大鼠,失活曲线向超极化方向偏移,但IK没有变化。此外,SCI 明显降低激发动作电位的阈值,增加动作电位发生频率,提高神经的兴奋性,因此,辣椒素敏感的C 纤维膀胱传入神经元的兴奋性增加与瞬时A 型K+电流密度的降低有关[9]。
4.坐骨神经切断模型 (sciatic nerve axotomy, SNA)
大鼠坐骨神经切断术2~7 周后,对所有类型的DRG 神经元的传导都有相同的影响。一般来说,DRG 小神经元变化最明显,DRG 大神经元有变化但不显著。在DRG 大、中、小神经元上IK均明显降低,激发动作电位的阈电流明显减少,动作电位触发的数量和神经细胞兴奋性显著增加。坐骨神经切断后,发现稳定的K+通道电流主要由延迟K+电流(IK)组成,其引起的兴奋性增加与IK的降低有关[10,11]。另据报道,大鼠坐骨神经切断术2~3 周后,总钾电流、快失活瞬时IA和IK在DRG 中神经元上均明显减少,而慢失活瞬时ID没有变化[8]。在大鼠坐骨神经切断术2 周后,模型大鼠DRG 小神经元上的慢失活IA和IK电流明显小于正常大鼠[12]。
5.糖尿病神经病理性疼痛模型 (diabetic neuropathic pain, DNP)
大鼠应用链脲佐菌素 (streptozotocin, STZ) 3 周诱导糖尿病模型,糖尿病大鼠在对后爪施加压力刺激后,其收缩阈值显著降低。糖尿病大鼠的总钾电流、IA和IK的电流密度在DRG 大、中神经元上比正常大鼠明显减小,但DRG 小神经元上的电流密度无明显减少[13]。与正常组相比,糖尿病DRG 神经元重复放电的触发阈值显著降低,神经兴奋性增强,使机体直接产生疼痛感觉[14]。另据报道,糖尿病大鼠(3~4 周)表现出较低的机械阈值和较短的热潜伏期。在DRG 小神经元上KV电流明显减少,糖尿病使DRG 神经元的动作电位波幅增大、半宽变短、斜率增大、触发阈值和基强度降低。这些结果提示STZ 诱导的糖尿病大鼠小DRG 神经元兴奋性增强[15]。
三、炎症性疼痛与电压门控钾通道
1.膀胱炎模型(cystitis)
向膀胱内滴注盐酸(0.4 N),诱导膀胱炎模型,结果发现DRG 体积明显增大,膀胱炎大鼠DRG 神经元表现出低动作电位激活阈值和重复性放电模式,膀胱神经元兴奋性增加。膀胱炎大鼠使辣椒素不敏感的膀胱传入神经上的DRG 小神经元慢失活瞬时IA电流密度明显小于假手术大鼠,但IK电流密度不变。这些数据表明膀胱炎症通过降低慢失活瞬时IA电流增加膀胱传入神经元的兴奋性[16]。环磷酰胺诱导慢性膀胱炎2 周后,对膀胱传入神经进行研究,发现慢性膀胱炎大鼠DRG 小神经元体积比正常大鼠明显增大,表现出低动作电位激活阈值和重复性放电模式。慢性膀胱炎大鼠神经元IA峰电流密度明显小于对照大鼠,IA失活曲线向超极化方向偏移[17]。
2.慢性胰腺炎模型 (chronic pancreatitis, CP)
慢性胰腺炎是一种较为常见的疾病,具有腺体功能不全和慢性疼痛等特点。应用三硝基苯磺酸(trinitrobenzene sulphonic acid, TNBS)处置,胰腺出现明显的慢性炎症,与人类CP 的变化非常相似。TNBS 诱导慢性胰腺炎大鼠模型21~26 天,慢性胰腺炎使DRG 神经元的静息电位移向去极化方向,激发动作电位的电流阈值明显减少,动作电位的触发频率显著增加。慢性胰腺炎DRG 神经元IA密度显著降低,而IK密度无显著变化。IA稳态激活曲线向超级化方向偏移。实验主要在DRG 中、小神经元上研究[18]。
3.抗原性关节炎模型 (antigen-induced arthritis,AIA)
mBSA 抗原诱导关节炎小鼠模型,AIA 小鼠对机械刺激显示较低的爪退缩阈值,对热刺激具有较短的退避潜伏期。在DRG 小神经元上,AIA 组小鼠与对照组相比,静息膜电位向去极化方向偏移,平均激发动作电位的电流阈值显著降低,动作电位数量明显增加。提示AIA 增加关节感觉神经元的兴奋性。AIA 能引起IA电流密度显著降低,但对IK电流密度无显著影响[19]。
4. DRG 局部炎症模型 (localized inflammation of the DRG, LID)
通过在DRG 附近直接注入新鲜制备的免疫激活剂酵母多糖,直接炎症刺激感觉神经元胞体制备LID 大鼠模型。LID 3~6 天后分离DRG 小神经元用于实验研究。结果显示,LID 可降低动作电位阈值并且增加神经兴奋性。LID 由于增加快失活IA和IK电流密度,也使KV电流幅度明显增加。此外,LID 使河豚毒素敏感型(TTX-S)钠电流增加2~3倍,河豚毒素不敏感型(TTX-R)钠电流增加超过2倍。实验结果发现神经兴奋性的增加和钾电流的增加产生了矛盾性,导致该模型钾电流特性与其他慢性疼痛模型不同的原因可能是钠电流的幅度发生了变化。虽然实验发现许多与LID 诱导外周炎症相似的模型,均能增加Na+电流密度,但在LID 模型中,Na+电流变化的幅度通常要大得多。这可能是神经元整体兴奋性的内在调节机制,通过增加K+电流,以部分补偿Na+电流的巨大增加[20]。
5.前列腺炎模型(prostatitis)
甲醛诱导大鼠前列腺炎1 周,使用DiI 和Fast Blue标记膀胱和前列腺传入神经上的DRG神经元,发现前列腺炎明显降低动作电位的阈值,增加动作电位的数量。前列腺炎使DRG 神经元上的IA电流密度显著减少,但对IK没有影响。此外,注射甲醛大鼠的DRG 输入电容明显大于对照大鼠,表明前列腺炎诱导了这些神经元的肥大[21]。
6.胃肠道炎症模型 (gastrointestinal inflammation,GLI)
三硝基苯磺酸(TNBS)诱导豚鼠回肠炎7~10天,在DRG 小神经元上,TNBS 回肠炎明显降低激发动作电位的电流阈值,增加动作电位触发数量。与对照组相比,炎症肠Fast Blue 或DiI 标记神经元的IA和IK电流密度显著降低,而非标记神经元的IA和IK电流密度则无显著变化。IA在标记神经元中的失活曲线向较负的电压方向偏移[22]。在醋酸诱导的胃溃疡大鼠7 天后也看到类似的结果,胃炎明显降低DRG 神经元上IA电流密度,但不影响IK电流。因此,K+电流的减少在一定程度可使神经元兴奋性增加,从而导致消化不良[23]。
7.痛风性关节炎模型 (gouty arthritis, GA)
应用尿酸钠诱导痛风性关节炎小鼠模型,观察痛风性关节炎DRG 小神经元钾电流的变化特征。结果发现,痛风性关节炎降低小鼠机械刺激的疼痛阈值。在造模第4 天,痛风性关节炎明显减少DRG神经元上的IA和IK电流密度,降低动作电位阈值,增加动作电位触发的数量,提高神经兴奋性[24]。
四、以钾通道为靶点的药物开发
本文对上述神经病理性疼痛和炎症性疼痛模型DRG神经元钾电流变化和兴奋性进行总结(见表1)。从表1 中可见,与正常动物相比,大多数神经病理性疼痛和炎症性疼痛动物模型在DRG 神经元上均显示较低的IA和IK,这些共同的变化有助于增加神经元尖峰放电和动作电位延长,增加神经兴奋性。钾通道开放剂能引起细胞膜的超极化,降低细胞的兴奋性。因此,针对治疗神经病理性疼痛和炎症性疼痛,IA和/或IA通道开放剂(尤其选择性作用亚型)具有潜在的开发前景。根据KV通道各亚型在DRG上的分布,几个主要亚型 KV1.1/KV1.2 和 KV7.2/KV7.3 均参与 AP 的产生和传播,KV2.1 主要参与AP 的传播。KV3.4 能够使AP 由DRG 向中枢传递。因此,选择性作用于这些不同的通道亚型,可能达到较好的镇痛效果。文献资料显示,IA电流通道亚型(KV1.4、KV4.2 和 KV4.3)和IK电流通道亚型(KV1.1、KV1.2 和KV2.2)分别在不同慢性疼痛模型DRG 神经元上均表现为下调。这些发现表明KV通道亚型可作为潜在的分子靶点,但需要进一步研究来探索这种可能性。虽然对KV通道亚型进行了广泛的研究,但作用于特异性通道的药物还比较少。目前,KV7 开放剂瑞替加滨(retigabine),在糖尿病、骨性关节炎和痛风性关节炎等不同动物模型上均可有效减轻神经病理性疼痛[3]。此外,许多天然来源的生物毒素对电压门控离子通道具有高度的专一性和有效性,它们通过阻断钠通道和钙通道发挥镇痛作用。生物毒素是新的镇痛药物研究的一大方向和热点。但到目前为止,天然毒素几乎都是阻断KV通道亚型,例如蛇毒肽类毒素(α-dendrotoxin),阻断 KV1.1、KV1.2 和 KV1;蜘蛛毒素 Hanatoxin1 和Hanatoxin2 阻断 KV2.1;海葵毒素BDS-I 和BDS-II阻断KV3.4 等[25]。因此,从天然毒素中寻找KV通道开放剂还需要进一步研究。

表1 神经病理性疼痛和炎症性疼痛动物模型DRG 神经元上电压门控钾电流的变化特征
除KV通道外,其他钾通道类型开放剂也显示较好的镇痛效果[3]。氟吡汀(flupirtine) 可通过激活G 蛋白调控的内向整流钾离子通道 (G proteingated inwardly rectifying K+channel, GIRK),导致神经细胞膜超极化,降低兴奋性。临床已用于治疗骨骼肌疼痛、头疼、癌症痛和神经源性疼痛等各种急性轻、中度疼痛。KATP通道开放剂吡那地尔对糖尿病、术后疼痛和骨癌痛动物模型均显示明显的镇痛作用。K2P 通道亚家族TREK1 几个开放剂(如咖啡酯)对内脏痛发挥显著的镇痛效果。鞘内注射BKCa通道开放剂NS1619 剂量依赖性逆转神经结扎大鼠的痛觉过敏和超敏反应。因此,以钾通道为靶点,特别是选择性针对KV不同亚型的钾离子通道开放剂作为镇痛药物具有良好的前景。
五、总结
综上所述,由于钾通道类型较多,已开发许多不同类型钾通道开放剂,这些药物主要治疗高血压、冠心病、心绞痛等心血管疾病。但在疼痛治疗中,以KV通道为靶点的开放剂相对较少。
不同原因造成的神经元损伤和炎症大多会引起IA和/或IK电流减少,IA和IK电流降低往往是由于KV通道不同亚型通道基因表达减少引起的,最终使神经元兴奋性增加,进而导致疼痛。因此,以KV通道(IA和IK)为靶点,尤其是选择性作用于KV亚型通道,对开发新的钾通道开放剂,治疗各类疼痛具有临床价值。
