六氯苯胁迫对香蒲根系分泌次生代谢物组分的影响
2021-08-30张翠萍鲁广秋刘淑娟李淑英周元清
张翠萍, 鲁广秋, 刘淑娟, 李淑英, 周元清
(玉溪师范学院 污染控制与生态修复研究中心, 云南 玉溪 653100)
0 引言
【研究意义】根系分泌物是植物根系在生长过程中释放到根际环境的各种有机化合物总称。根系分泌物既是植物与外界环境进行物质交流的重要媒介,也是根际微生物可直接利用的重要碳源[1],与根际微生物对污染物的生物降解密切相关[2]。【前人研究进展】近年来,随着根际生态学的建立和发展,对于根系分泌物的收集、检测方法及分泌机制等方面的研究不断深入。常用方法是将植物在实验室组培、水培或砂培[3-4],收集分泌物后采用高效液相色谱法(HPLC)、离子色谱法(IC)及色谱-质谱联用法(GC-MS,LC-MS)等[5]分离鉴定其种类和数量。根系分泌物的组成及含量变化是植物响应环境胁迫最直接和最明显的反应[6-7],研究聚焦于植物单因素环境胁迫[8]、营养胁迫[9-10]、污染物胁迫[11-12]条件下植物根系分泌效应及机理。持久性有机污染物(Persistent Organic Pollutants,POPs)是一类具有环境持久性、长距离迁移能力、生物累积性和高生物毒性的特殊污染物。我国不同环境介质及生物体中POPs污染不容乐观,如何高效去除环境介质中的POPs污染已成为研究者普遍关注的热点问题。湿地作为POPs在生物圈迁移转化过程中一个重要的“汇”,近年来,湿地生态系统的POPs污染问题备受关注。湿地植物的根际效应是解决POPs污染的主要切入点[13-14],植物作为湿地生态系统的重要组成部分[15],通过根系泌氧和根系分泌物,影响根际微生物的群落结构组成及多样性[16-17],强化湿地根际效应对污染物的生物降解与净化能力[18-19]。植物根系分泌一定量的转化酶、磷酸酶、蛋白酶和过氧化氢酶等外酶类物质可直接降解有关的有机污染物。香蒲是全球广布的多年生宿根性湿地草本植物之一,在水体氮磷吸收、重金属累积、有机污染物去除等生态环保上的价值日益凸显。据报道,香蒲生物降解持久性有机污染物六氯苯(Hexachlorobenzene,HCB)的能力较芦苇强[20]。【研究切入点】根系分泌物介导的根际效应在水体生态修复中有极大的应用潜力[21],基于根系分泌物对POPs生物降解的影响开展了大量研究[7,22-23],但关于POPs胁迫对湿地植物根系分泌物组分变化特征影响的报道较少。【拟解决的关键问题】深入探讨香蒲根系分泌物对POPs降解的作用,以狭叶香蒲(Typhaangustifolia)植株为材料,以《斯德哥尔摩公约》中首批受控的HCB作为研究对象,水培法收集HCB胁迫下香蒲的根系分泌物,GC-MS技术检测分泌物的组分种类和数量,分析HCB降解率与香蒲根系分泌物间的相关性,旨在为人工湿地去除水体氯苯类有机污染物的应用及发展水生植物净化污水提供基础数据和理论支持。
1 材料与方法
1.1 材料
1.1.1 植物材料 狭叶香蒲,云南省玉溪师范学院百草园种植,植株高20~40 cm,主根长5~8 cm。
1.1.2 试剂 有机污染物六氯苯(HCB)标准品(99.1%),AccuStandard Inc.;正己烷(分析纯),广州西陇化工;5% Hogland营养液,自制;纯水,采用Milli-Q制备;XAD-4大孔树脂层析柱,Sigma-Aldrich(上海)贸易有限公司;二氯甲烷(分析纯),天津风船化学试剂科技有限公司;无水硫酸钠(分析纯),广州西陇化工;氢氧化钠(分析纯),广州西陇化工;浓盐酸(分析纯),中国医药集团。
1.1.3 主要设备 Multi-3430 SET便携式多参数分析仪,德国WTW公司;UPR-II超纯水机,西安优普仪器设备有限公司;CP214分析天平,美国奥豪斯公司;R-200旋转蒸发仪,瑞士布奇公司;KDB-12氮气吹扫仪,青岛科迪博公司;SQ8T/ Clarus 680气相色谱质谱仪,美国PerkinElmer公司。
1.2 方法
1.2.1 材料预处理
1) 处理液制备。采用HCB标准品溶于正己烷中配制1.0 mg/L HCB的污染储备液。5% Hogland营养液采用WANG等[23]的方法配制。配制质量浓度分别为0.1 mg/L、0.2 mg/L、0.5 mg/L、1.0 mg/L、2.0 mg/L、5.0 mg/L、10.0 mg/L的HCB标准溶液。
2) 植物材料培养。将香蒲均一苗用自来水洗净根部,再经纯水冲洗3次后放入装有一定量纯水的锥形瓶中预培养3 d备用。
1.2.2 试验设计 试验设营养液空白对照(CK)、香蒲植株空白对照(CK1)和试验组(HCB)3个处理:添加1.0 mg/L HCB无香蒲的营养液作为营养液空白对照,用于测HCB的含量变化;未添加HCB有香蒲植株作为根系分泌物变化的香蒲植株空白对照;添加1.0 mg/LHCB有香蒲作为试验组。3个处理的每个培养时段设3次重复,3株香蒲苗为1组,种植于200 mL 5% Hogland营养液中,分别于水培1 d、5 d、10 d、15 d、20 d、25 d和30 d取出植株。先用纯水冲洗根系3次,冲洗液并入营养液中便于HCB剩余量的测定。再将植株放入装有200 mL超纯水的锥形瓶内,锥形瓶外用黑色纸包裹避光处理,在光照良好的条件下开始水培收集香蒲根系分泌物6 h(即13:30~19:30)。培养过程中注意补充营养液至初始量。
1.2.3 香蒲根系分泌物的测定 采用便携式Multi-3430 SET现场测定根系分泌物收集液的pH、溶解氧DO(mg/L)、电导率EC(μs/cm)和氧化还原电位Eh(mV)4个指标。将收集液通过活化好的XAD-4大孔树脂层析柱,每个样品过层析柱3次富集分泌物后,用洗耳球吹净水溶液,每次用30 mL二氯甲烷分3次洗脱层析柱。为了减少水分,层析柱下面用装有无水硫酸钠的小烧杯盛洗脱液。最后洗脱液装入分液漏斗,用二氯甲烷30 mL分2次萃取。萃取后取有机相,用烘干的无水硫酸钠干燥处理后进行旋转蒸发浓缩至近干。用约6 mL二氯甲烷分3次洗涤旋转蒸发瓶,洗涤液倒入10 mL的离心管中,将其进行氮吹。氮吹至溶液少于1 mL时加入内标物正十七烷,然后用二氯甲烷定容到2 mL,振荡混匀后装入进样瓶待气相色谱-质谱联用仪测定。各试验组香蒲根系分泌物的图谱数据结合NIST 2011 Mass Spectral Library质谱谱库进行匹配度分析,再采用面积归一化法半定量计算香蒲根系分泌物的相对百分含量。
1.2.4 指标测定
1) 香蒲根系分泌物。参考KUMAR等[24-25]的方法,建立香蒲根系分泌物GC-MS测定条件。其中,GC分析条件:PE Elite-5MS毛细管柱(规格:30 m×0.25 mm×0.25 μm);载气:高纯度氦气(99.999%);进样口温度:250℃;进样量:2.0 μL;载气流量1 mL/ min;分流进样,分流比为40∶1;升温程序:从50℃开始,先保持0 min,以50℃/min升至150℃,保持1 min;再以4℃/min升至250℃,维持1 min,最后以2℃/min升至270℃,维持3 min。MS分析条件:EI+源,离子源温度 250℃;传输线温度250℃;电子电压70 eV;全扫描,TIC扫描,范围为33~550 m/z。
2) HCB浓度。测定香蒲培养液中的HCB浓度,样品倒入分液漏斗中,再加入200 mL分析纯正己烷,分3次进行液-液萃取,萃取液旋转蒸发浓缩后,加约15 mL色谱纯正己烷转移至离心管中进行氮吹浓缩,氮吹至溶液体积少于5 mL,再加入色谱纯正己烷定容至5 mL,混匀后过0.45 μm滤膜装瓶进行GC-MS测定,测定条件同上。测定HCB标准溶液,外标法定量,以HCB质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.3 统计分析
采用Excel 2013对试验数据进行统计,采用SPSS 16.0进行Pearson相关性分析和显著性检验,采用单因素方差分析(One-Way ANOVA)进行多重比较,检验各指标的差异显著性(P<0.05)。Origin 8.0作图。
2 结果与分析
2.1 根系分泌物收集液的pH、溶解氧、电导率和氧化还原电位
根系分泌物的种类繁多,质子和无机离子(如H+、NH4+、Na+、K+、Cl-、SO42-和HPO42-等)对根际pH及氧化还原电位(Eh)有一定的调节作用。从表1看出,水培不同时间后,香蒲根系分泌物收集液的pH和溶解氧(DO)总体呈先降后升再降趋势,而电导率(EC)和Eh则相反。
2.1.1 pH HCB胁迫处理根系分泌物收集液的pH为5.53~6.06,随培养时间增加呈先降后升再降趋势,处理1 d和15 d时的pH显著高于其余时段,处理5 d时的pH显著低于其余时段;对照(CK1)pH为5.47~6.20,呈先降后升趋势,处理30 d和1 d时的pH分别显著高于和低于其余时段。HCB胁迫处理各时段pH较CK1的变化为-0.38~0.15,其中以处理30 d时HCB胁迫处理的pH较CK的变幅最大,二者间相差0.38;处理1 d和15 d时其次,二者均相差0.15;处理10 d时最小,二者间相差0.01。
2.1.2 DO HCB胁迫处理与对照中,根系分泌物收集液的DO均随培养时间增加呈先降后升再降趋势,处理15 d时的DO显著高于其余时段,处理5 d时的DO显著低于其余时段;HCB胁迫DO为3.26~6.64,而对照DO为3.58~6.54,表明HCB胁迫对香蒲根系分泌物收集液的DO影响不大。
2.1.3 EC HCB胁迫下,根系分泌物收集液的EC随培养时间增加而明显升高,且试验组(HCB)与对照组(CK1)相比较,变化范围为5.2~33.9 μs/cm,表明HCB胁迫下,香蒲根系分泌物收集液的导电性增强。HCB处理与CK1均在30 d时达峰值。
2.1.4 Eh 培养1~5 d、20~25 d时间段,HCB胁迫诱导根系分泌物收集液的Eh升高,可能由于HCB胁迫促进香蒲根系参与氧化还原反应的氧化性物质分泌。HCB胁迫下,湿地植物具有特殊的根系泌氧功能,环境胁迫下,香蒲水培收集液中Eh和DO水平升高,且受到植物类型、生长发育期以及营养状况的影响。
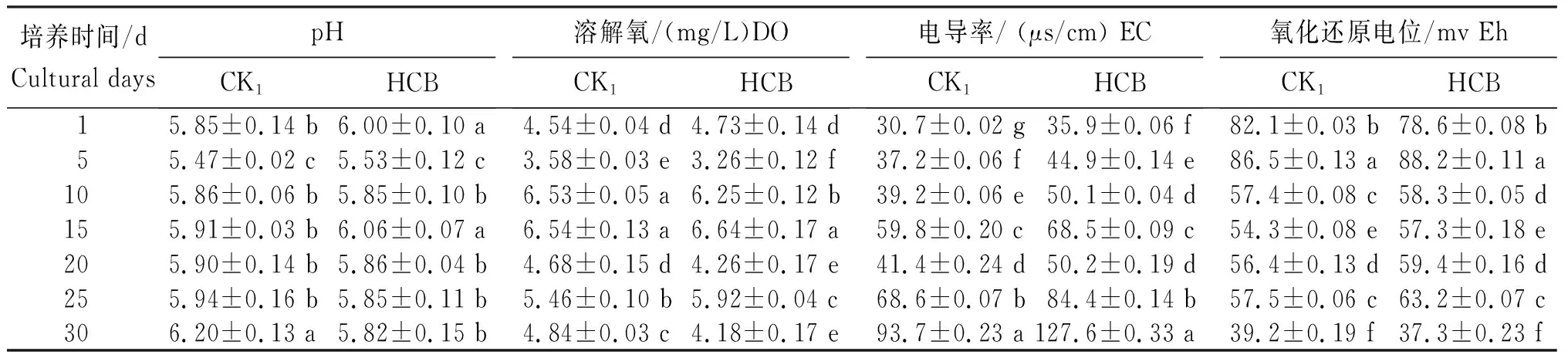
表1 HCB胁迫处理不同培养时间根系分泌物收集液的pH、溶解氧、电导率和氧化还原电位
2.2 HCB浓度的动态变化
拟合得到线性回归方程y=8 226.04x+28.536 6(r=0.999 9),方法最低检测限为0.001 2 mg/L(图1)。HCB在GC-MS处理26.33 min时出现最高峰,说明GC-MS可用于HCB检测。从表2看出,随水培时间增加,培养香蒲的水体HCB的降解率呈先升后降趋势,水培20 d时达最大值68.2%,然后呈下降趋势。各培养时段,对照营养液中HCB浓度为0.928~0.957 mg/L,而香蒲水培液中HCB浓度为0.318~0.651 mg/L。表明,培养香蒲促进水体HCB浓度较CK下降31.98%~66.53%。

表2 HCB胁迫处理不同培养时间后HCB的浓度
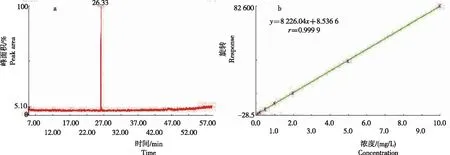
图1 GC-MS测定HCB标样的色谱图谱(a)及标准曲线(b)
2.3 HCB胁迫处理香蒲根系分泌次生代谢物的组分变化特征
2.3.1 香蒲根系分泌次生代谢物的组分及其变化 从图2看出,培养30 d后,各处理香蒲根系分泌物的GC-MS总离子流色谱的变化。HCB胁迫改变香蒲根系分泌次生代谢物的组分含量(图3),其中,1-十二烯、α-细辛脑和苯甲酸乙酯含量变化较大。从表3看出,收集到的10种香蒲根系分泌次生代谢物包括1-十二烯、正十二烷、1-十三烯、正十四烷和α-细辛脑5种烃类,苯甲酸乙酯和邻苯二甲酸二甲酯2种酯类,及α-毕橙茄醇、1H-3A,6-氢呋喃-2-酮-3-羧酸和油酸酰胺。HCB胁迫下香蒲根系分泌次生代谢物组分随培养时间而动态变化,培养1~5 d时,HCB胁迫香蒲根系分泌1-十二烯、α-细辛脑和苯甲酸乙酯含量明显低于对照(CK1)。培养10 d后,1-十二烯未检出,苯甲酸乙酯含量也相应减少。培养至15 d后,α-细辛脑含量达峰值,随后急剧下降,且HCB胁迫下α-细辛脑含量下降速度较对照明显加快。

图2 30 d后香蒲根系分泌物的GC-MS总离子流色谱

图3 HCB胁迫处理30 d后香蒲根系分泌物的GC-MS总离子流色谱
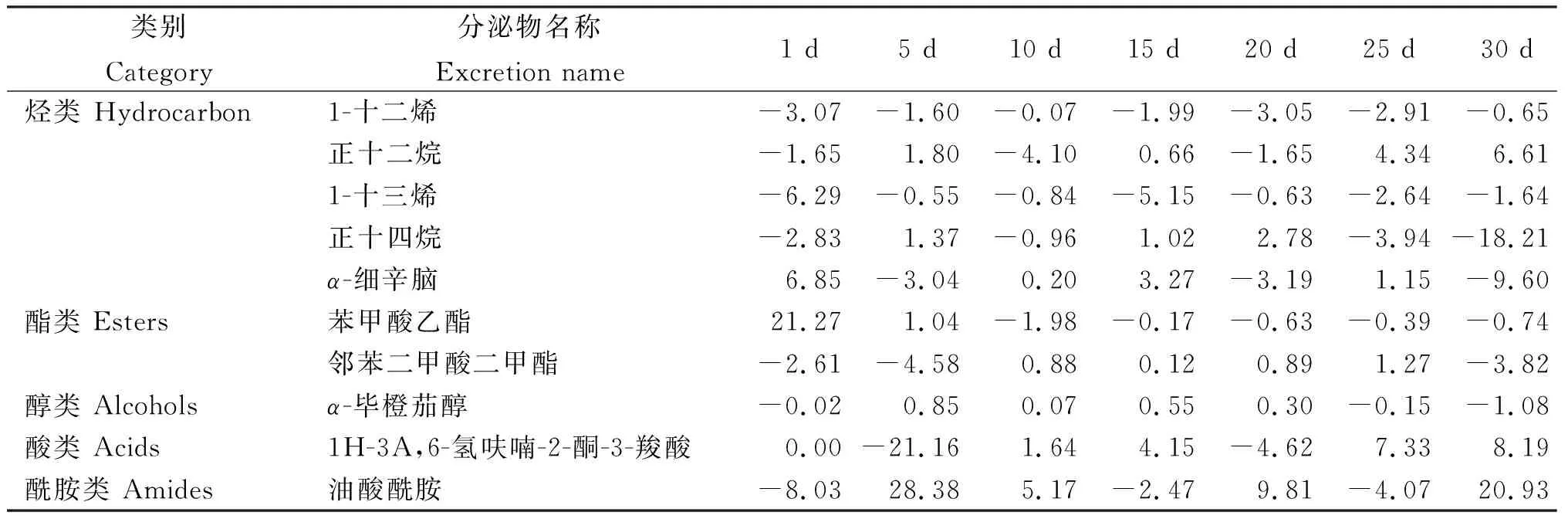
表3 HCB胁迫处理不同培养时间香蒲根系分泌次生代谢物组分含量的动态变化
2.3.2 次生代谢物的组分含量与HCB降解率的相关性 由表4可知,α-毕橙茄醇、正十四烷和α-细辛脑含量均降低,分别下降25.7%、68.2%和96.5%。正十二烷、1H-3A,6-氢呋喃-2-酮-3-羧酸和油酸酰胺含量则显著增加,分别增加27.2%、87.4%和112.6%。说明,环境胁迫直接影响香蒲根系分泌次生代谢物组分进而影响HCB的生物降解。对HCB降解率与香蒲根系分泌物进行Pearson相关分析可知,相关系数r为-0.887~0.509,其中,HCB降解率与苯甲酸乙酯呈极显著负相关(r=-0.887,P<0.01),表明,HCB胁迫下香蒲根系分泌物苯甲酸乙酯可抑制HCB降解。
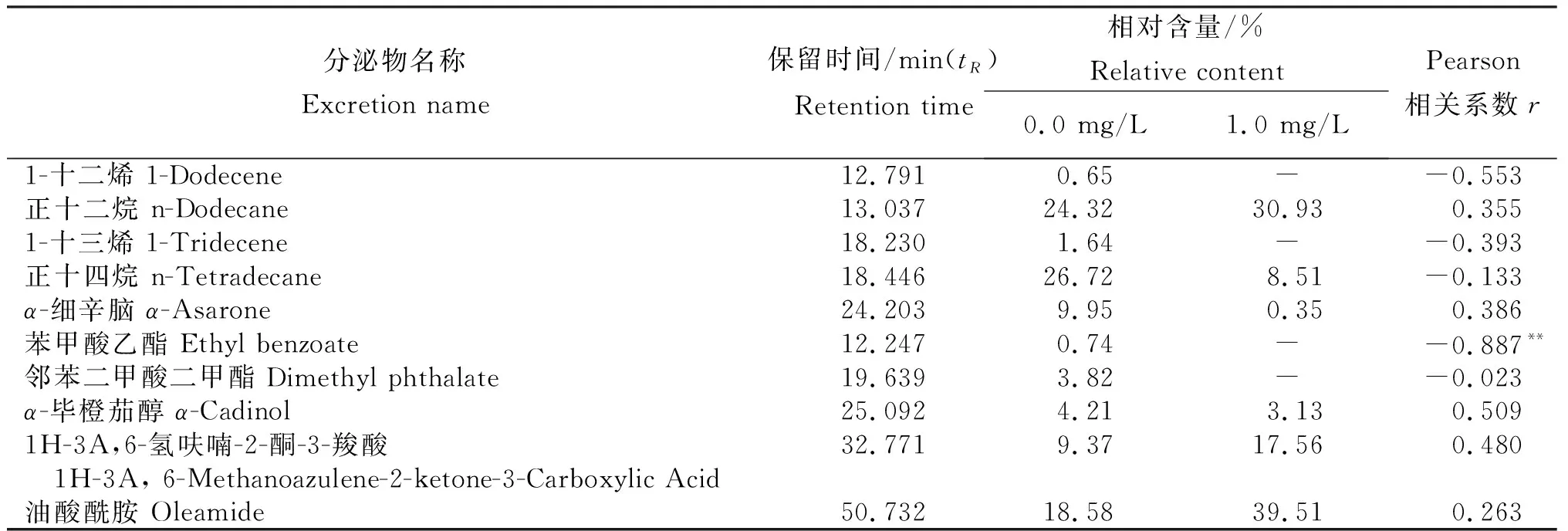
表4 水培30 d时香蒲根系分泌次生代谢物组分含量及其与HCB降解率的相关性
3 讨论
根系分泌作用是适应胁迫环境的一种重要方式,是根际生命共同体中连接水体-植物-微生物及其环境条件的重要枢纽。环境胁迫下,研究根系分泌物的组成和分泌规律,有助于了解根际效应与胁迫环境的响应关系[26]。一方面,根系分泌的某些胞外酶能够直接参与污染物的降解过程;另一方面,根系分泌物通过塑造根际微生物组以驱动植物逆境防御的反馈,调控微生物群落结构及多样性,进而加速污染物降解[27]。此外,根系分泌的低分子有机酸、氨基酸等可改变根际代谢微域环境的pH,直接影响污染物的迁移转化过程,影响污染物的去除[20,28]。TOYAMA等[7,21]已研究多环芳香烃与根系分泌物的共代谢作用,表明根系分泌物能够选择驯化形成特定的根际微生物群,促进多环芳香烃的降解。郑师章等[29]报道凤眼莲根系分泌物对根际细菌的降酚酶活性有积极影响,促进了根际细菌的降酚效率。植物种类、生长阶段、根系分泌物和微生物可利用的碳源等影响根际微生物种类及活性,目前,根际污染生态过程及调控方向,核心根际微生物与根系分泌物组分间的关系还有待深入研究。
HCB胁迫改变香蒲根系分泌物组分,抑制1-十二烯和1-十三烯2种烃类,苯甲酸乙酯和邻苯二甲酸二甲酯2种酯类的分泌,水培30 d后未检测到,根系调整烯烃类和酯类的分泌可能是适应HCB胁迫的一种响应机制。与张建聪等[30]水培沉水植物对面源污染物磷的响应机制相一致。HCB降解率与苯甲酸乙酯呈极显著负相关(r=-0.887,P<0.01),表明,HCB胁迫下香蒲根系分泌物苯甲酸乙酯抑制HCB降解率,可能是HCB生物降解过程中,香蒲根系分泌的苯甲酸乙酯被根际微生物消耗过快导致[31]。后期将进一步试验证明。
4 结论
研究结果表明,HCB胁迫初期,香蒲根系分泌物收集液的导电性增强,氧化还原电位在37.3~88.2 mV变化。香蒲根系分泌次生代谢物经GC-MS分析得到10种主要化合物,包含1-十二烯、正十二烷、1-十三烯、正十四烷和α-细辛脑共5种烃类,苯甲酸乙酯和邻苯二甲酸二甲酯共2种酯类,及α-毕橙茄醇、1H-3A,6-氢呋喃-2-酮-3-羧酸和油酸酰胺。
HCB胁迫水培30 d后,香蒲根系分泌次生代谢物组分发生改变,抑制1-十二烯、1-十三烯、苯甲酸乙酯和邻苯二甲酸二甲酯的分泌,促进正十二烷、1H-3A,6-氢呋喃-2-酮-3-羧酸和油酸酰胺显著增加,分别较未受胁迫的对照(CK1)增加27.2%、87.4%和112.6%。α-毕橙茄醇、正十四烷和α-细辛脑含量均明显降低,分别下降25.7%、68.2%和96.5%。
HCB降解率与香蒲根系分泌物苯甲酸乙酯之间呈极显著负相关(r=-0.887,P<0.01),表明,HCB胁迫影响香蒲根系分泌酯类含量,分泌次生代谢组分发生改变,进而影响HCB的生物降解。
