肺高血压与细胞代谢
2021-08-29虎梅李德红苏红玲高锦霞曹云山
虎梅 李德红 苏红玲 高锦霞 曹云山
肺高血压(pulmonary hypertension,PH)是一种以血管僵硬和细胞代谢改变为特征的进行性疾病。PH患者的肺动脉进行性重塑,引起肺血管阻力进行性升高,最终导致右心衰竭甚至死亡[1-2]。PH进展缓慢,诊断难度大,死亡率高。尽管近年来PH患者可服用新型靶向药物进行治疗,但对于心功能Ⅲ级和Ⅳ级的患者来说,5年生存率仍然很低(分别为65.4%和61.2%)[3]。目前PH的治疗方法主要集中在扩张血管方面,而不是针对其他致病的根本原因[1]。近年来,研究发现肺血管细胞代谢改变与PH发病机制有关[4]。PH患者和动物模型中均存在肺血管细胞代谢紊乱,导致出现细胞(肺动脉内皮细胞和平滑肌细胞)异常增殖和抗凋亡现象[4]。因此,如今人们越来越多地关注肺血管细胞代谢改变在肺血管重塑中所起的作用,从这些细胞代谢途径中寻找PH生物标志物将有助于早期诊断PH和预测疾病的严重程度,并为深入了解该疾病的发病机制提供新思路。
1 葡萄糖代谢与肺高血压
细胞代谢是一个动态平衡的过程,它能迅速改变以适应机体生理环境的变化[5]。在正常情况下,细胞代谢维持机体的生长、发育以及内环境的稳态;疾病状态下,细胞代谢会发生显著变化,这些异常的代谢变化又会促进疾病的发生发展,如癌细胞代谢改变会促进肿瘤细胞的增殖和转移[6-7]。在有氧环境中,人体内的葡萄糖经过代谢产生丙酮酸,丙酮酸进入三羧酸循环(tricarboxylic acid cycle,TAC),经过一系列代谢过程后产生代谢产物;而在低氧或缺氧的环境中,机体中葡萄糖转化为丙酮酸,进而转化为乳酸(图1)。研究发现在PH患者中,肥厚的右心室与重塑的肺血管中均存在糖代谢稳态失衡,氧化减少的同时糖酵解增强,被称为“Warburg效应”[6-7]。在缺氧的情况下,糖酵解增强还会引起肺动脉平滑肌细胞(PASMCs)的损伤,是因为PASMCs氧化酶NOX4表达上调,产生大量的超氧化物,导致PASMCs异常增殖,造成肺血管重构,引起肺动脉高压[8]。

图1 葡萄糖酵解及葡萄糖氧化代谢途径Fig.1 Metabolic pathways of glucose-glycolysis and glucose oxidativation
近年来,研究发现缺氧诱导因子-1(hypoxiainducible factor,HIF-1)在缺氧条件下对PH的发生发展起重要作用。HIF-1是由组成型表达的HIF-1b和氧调节的HIF-1a组成的异二聚体,其中HIF-1a在PH发展中起关键作用。在缺氧的环境中,HIF-1a被激活并诱导丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDK)上调,激活的PDK导致丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)受到抑制,使PDH减少,进一步抑制氧化磷酸化途径,使线粒体中活性氧簇(reactive oxygen species,ROS)减少。ROS通过调控多个离子通道的活性,诱导细胞内Ca2+释放、细胞外Ca2+内流,抑制细胞内K+累积而引起PH。ROS和K+、Ca2+信号可能协同触发炎症级联反应,参与PH的发生[9-10]。此外,当机体处于低氧环境时,PDH被抑制,HIF-1a蛋白降解减少,并转移到细胞核中启动基因表达程序,使HIF-1a靶基因被激活,葡萄糖转运蛋白和PDK增加,进而使PDH减少且丙酮酸从线粒体内转移到线粒体外,抑制葡萄糖氧化磷酸化,进而水和氧气生成不足,使细胞处于低氧状态,进一步造成低氧恶性循环。同时,HIF-1a活化对其他代谢相关关键调节分子[包括PDK3和丙酮酸激酶同工型M2(PKM2)、PDH激酶、己糖激酶、葡萄糖转运蛋白(GLUTs)]也有重要的调节作用,从而导致糖酵解增加和代谢重编[11]。因此,HIF-1是PH发展过程中的重要影响因子,也是PH治疗的重要靶点(图2)。

图2 缺氧诱导因子-1对肺血管的影响Fig.1 Effects of hypoxia-inducible factor-1 on pulmonary vessels
2 脂肪酸代谢与肺高血压
脂肪酸代谢紊乱对肺血管系统也有重要影响[12]。在缺氧的环境中,线粒体脂肪酸β-氧化(fatty acidβ-oxidation,FAO)成为机体主要的代谢途径。该过程非常复杂,脂肪酸经过细胞摄取、活化、转脂化作用,通过线粒体膜、再脂化,经线粒体内氧化、电子产生和转运以及被分解成乙酰辅酶A,乙酰辅酶A进入TCA,经过电子传递链产生NADH和FADH2,从而参与一系列代谢过程。见图3。
近年来研究发现,PH患者的内皮细胞和平滑肌细胞存在脂肪酸代谢紊乱,进而造成肺血管细胞异常增殖和血管重塑。研究发现,PH患者的游离脂肪酸(FFAs)和长链酰基肉碱明显增加,且心肌细胞中出现脂肪酸堆积[13-17]。Randle等[18]研 究发现,FAO途径产生的乙酰辅酶A可以抑制PDH,进而抑制丙酮酸进入TCA循环,使氧化磷酸化途径被抑制,造成低氧,引起肺血管收缩,导致PH。此外,Zhuang等[19]研究发现线粒体中FAO的关键——限速酶肉毒碱棕榈酰转移酶(carnitine palmitoyltransferase,CPT)1在PASMCs异常增殖中起重要作用。在野百合碱诱导下,CPT1在PH大鼠PASMCs中高度表达,并伴随着三磷酸腺苷(ATP)的减少和AMPK-p53-p21通路的下调,促进PASMCs异常增殖,使肺血管重塑,进而造成PH。因此,在PH中CPT1是促进PASMCs异常增殖的一个新的发病机制,可能是PH治疗干预的潜在靶点。与此同时,在PH大鼠模型中,Shi等[17]发现脂肪酸合成酶的活性和表达增加可促进脂肪酸合成增多,使肺血管细胞能量代谢改变,造成肺血管细胞内大量脂肪酸堆积,由此造成的酸性环境有助于PH的进展。因此,人们在大鼠模型中通过使用药物抑制剂对脂肪酸合成酶进行抑制,削弱肺血管细胞的增殖、抗凋亡等作用,进而抑制了肺血管重塑,并使肺血管细胞代谢从FAO途径转化为葡萄糖代谢途径[17,19]。
最近,Münzberg等[20]发现脂肪因子(瘦素和脂联素)也与PH的形成有关。瘦素是一种主要由脂肪组织分泌的激素,在抑制食欲和调节能量消耗方面起重要作用。研究发现,瘦素与肺血管平滑肌细胞增殖、内皮细胞功能障碍以及血小板聚集等有关[21-24],瘦素可通过激活细胞外信号调节激酶、信号转导和转录激活因子3(transcriptional activator 3,STAT3)以及蛋白激酶B(Akt)等调节通路来刺激PASMCs增殖,进而引起肺血管重塑[25-26]。但瘦素通过激活信号调节通路对PH发展的影响仍需进一步深入研究。
脂联素也是一种由脂肪组织分泌的激素。脂联素可通过降低肿瘤坏死因子(tumor necrosis factor,TNF)的水平,下调内皮细胞中黏附分子的表达,减少炎症因子的聚集,并调节促炎因子及抗炎因子的水平,激活一氧化氮的合成,介导腺苷酸活化蛋白激酶(AMPK)、mTOR和核转录因子-κB(NFκB)信号传导,从而抑制血管内皮细胞功能障碍和平滑肌细胞异常增殖,使肺血管重塑有所改善[27-29]。此外,脂联素作为PPARγ作用靶点,可通过PPARγ激动剂上调脂联素水平,使黏附分子表达下调,减少炎症细胞聚集和抑制单核-巨噬细胞向泡沫细胞的转化,具有抗炎、抗肺血管重塑等作用。此外,PPARγ的活化还可以抑制PH中的脂质代谢紊乱。因此,脂联素和PPARγ相互作用有望成为PH的治疗靶点[30-32]。
3 氨基酸代谢与肺高血压
在线粒体中,谷氨酰胺酶(glutaminase,GLS)催化谷氨酰胺转化为谷氨酸和氨,再通过谷氨酸脱氢酶(glutamate dehydrogenase,GDH)将谷氨酸转化为TCA循环中间产物α-酮戊二酸(α-KG),从而产生ATP和生物合成原料(图4)。在正常的心肌细胞中几乎没有谷氨酰胺分解代谢,而在右心衰竭的患者中,可观察到异常增殖的肺血管细胞中大量谷氨酰胺分解。这可能是由于肺血管细胞过度增殖,细胞代谢旺盛,使谷氨酰胺需求量增加[33-36]。此外,研究发现,在骨形态发生蛋白2(bone morphogenesis protein 2,BMPR2)突变的PH患者中也存在谷氨酰胺代谢的改变,这可能与PH患者存在肺血管细胞的异常增殖,谷氨酰胺的摄取量大于正常人有关[37]。Bertero等[38]和Dieffenbach等[39]研究发现,Hippo通路下游效应因子YAP/TAZ激活可上调GLS1水平,导致谷氨酰胺代谢增强,使肺血管内皮细胞过度增殖,引起肺血管重塑,导致肺动脉压力升高。因此,研究者在野百合碱诱导的PH大鼠模型中发现,通过抑制YAP/TAZ激活可下调GLS1水平,进而抑制谷氨酰胺分解和肺血管内皮细胞过度增殖,从而抑制肺血管重塑。
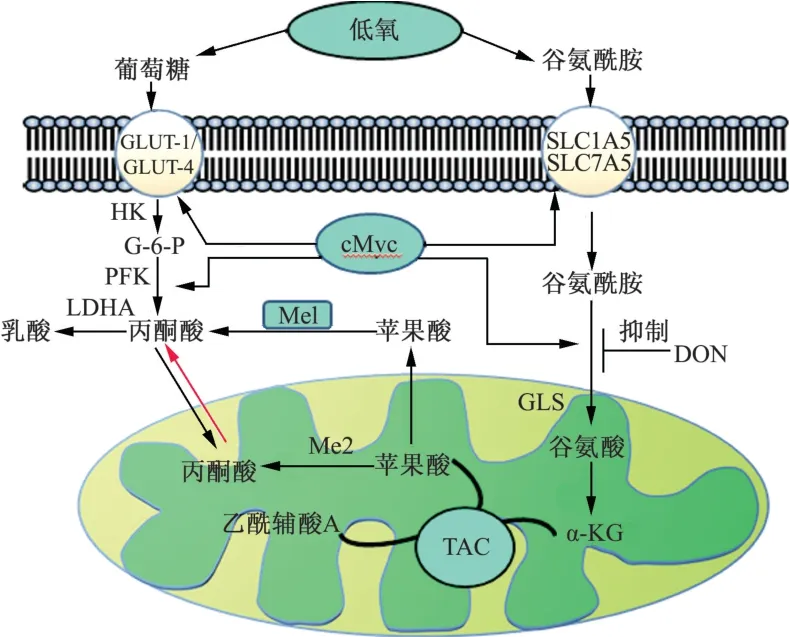
图4 葡萄糖与氨基酸分解代谢途径Fig.4 Metabolic pathways of glucose and amino acid decomposition
4 代谢抑制剂与肺高血压
代谢抑制剂在代谢通路中发挥着重要作用,因而代谢途径中的关键酶和(或)限速酶可作为干预PH的 靶 点[40]。例 如,二 氯 乙 酸(dichloroacetate,DCA)是线粒体内PDK抑制剂,可促进PDH的活化和葡萄糖氧化,增加线粒体内电子传递链能量,使ROS增加;可抑制细胞增殖、促进细胞的凋亡和血管的舒张,逆转肺血管重塑[41-42]。此外,DCA也可以改善线粒体功能,维护线粒体结构完整性,减少肺动脉平滑肌细胞异常增殖,使PH降低[43]。因此,DCA有望成为PH新的治疗药物。
曲美他嗪和雷诺拉嗪是脂肪酸抑制剂,可通过抑制脂肪酸氧化过程中的3-酮酰基辅酶A硫解酶(3-ketoyl COA thiolyase,3-KAT)来抑制FAO,增加葡萄糖氧化,改善糖酵解与糖氧化耦联,优化细胞能量代谢。在肺动脉结扎模型研究中发现,曲美他嗪和雷诺拉嗪可增加右心室的葡萄糖氧化和提高ATP水平,改善心输出量和运动耐力[44]。此外,它们还能抑制FAO,进一步激活PDH,增加葡萄糖氧化,使细胞代谢方式发生改变,从而提高细胞氧的利用率[45-46]。
谷氨酰胺酶抑制剂6-重氮-5-氧代-L-正亮氨酸(diazo-5-oxo-l-norleucine,DON)可拮抗谷氨酰胺,增加心输出量,改善右心室肥厚,恢复PDH活性,增加葡萄糖氧化并提高细胞氧的利用率[39]。此外,在PH中,Bertero等[38]发现谷氨酸可刺激谷氨酸受体N-甲基-D-天冬氨酸受体(NMDAR),促进A型选择性内皮素受体和血小板衍生生长因子受体诱导PASMCs过度增殖。在PH动物模型研究中发现,NMDARs的先天缺失和药物抑制均能减缓PH的进展。因此,干预谷氨酰胺代谢途径可作为PH治疗新的靶点,但目前关于氨基酸代谢途径在PH或右心肥大患者中作用的临床研究十分有限,具体机制也尚未完全阐明。上述代谢抑制剂通过抑制代谢途径中的关键酶和(或)限速酶发挥抑制作用,延缓PH的进展。
总之,PH的发病机制复杂,与肺动脉内皮细胞功能障碍、PASMCs及成纤维细胞异常增殖、遗传和炎症等因素密切相关。这些因素在肺血管重塑的发生发展过程中起着重要作用。见图5。
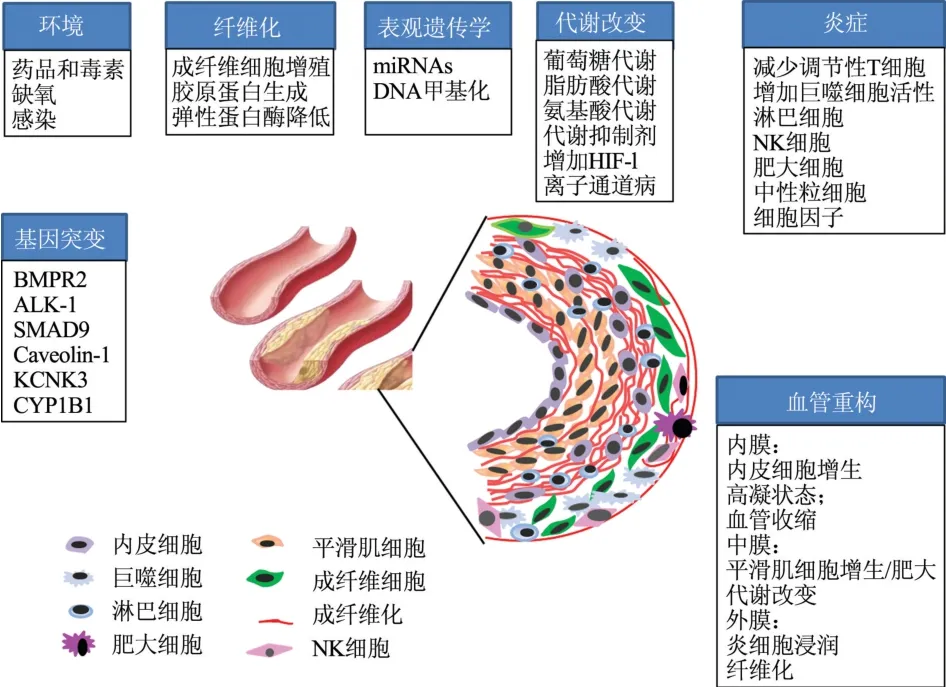
图5 肺高血压发病机制Fig.5 Pathogenesis of pulmonary hypertension
肺血管细胞代谢改变在PH发生发展中起重要作用,因此,深入了解肺血管细胞代谢改变将有助于进一步阐明PH的发病机制,以便寻找PH生物标志物,并为开发PH治疗药物提供新思路。
