基于MAPK/ERK信号通路探讨当归多糖 对脑缺血再灌注损伤大鼠的影响
2021-08-27汤定中余春丽罗国君
汤定中 余春丽 罗国君△
(上海市第六人民医院金山分院 1.神经内科;2.肾病科 上海 201599)
脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)是脑血流不足或中断致脑组织缺血缺氧一段时间,之后血供恢复,以脑组织损伤程度和功能障碍反而加重为主要特征的复杂病理现象[1]。该病的临床表现主要为感觉、运动或意识严重障碍等。CIRI是大部分缺血性脑血管病的重要病理生理过程,近年来,随着缺血性脑血管病发病率逐年增加,CIRI发生的几率也不断升高,并且拉高了脑血管病患者的残疾率、死亡率[2],对患者生命健康造成严重威胁。目前,CIRI治疗中常用的脑保护药物为麻醉药物、他汀类药物、N-乙酰半胱氨酸、阿片类物质、磷酸肌酸、蛋白酶抑制剂等等[3],它们通过不同途径对脑损伤起到一定的改善作用,但尚无特效药物。明确各种药物的作用靶点及疗效,开发新的脑保护药物是该病的研究重点,而中医药是CIRI新药研发的主要来源之一[4]。当归多糖为中药当归的主要活性成分,林国芳等[5]研究发现,当归多糖可能通过抑制神经元凋亡对CIRI大鼠发挥神经保护作用,但具体作用机制不明确。本次研究主要基于丝裂原活化蛋白激酶(MAPK)/细胞外调节蛋白激酶(ERK)信号通路,探讨当归多糖对CIRI模型大鼠的影响。报告如下。
1 资料与方法
1.1材料 (1)研究对象:6~7周SPF级健康SD大鼠65只,均为雄性,体重250~280g,平均(263.46±9.54)g,购自常州卡文斯实验动物有限公司,动物许可证号:SCXK(苏)2016-0010。将所有大鼠每笼5只置于饲养室内进行为期5 d的适应性饲养,温度设定为24℃~26℃,相对湿度维持在50%~70%,光照时间6:00~18:00,大鼠在笼内自由活动并摄入标准颗粒饲料及清洁饮水,定期清扫鼠笼并消毒。(2)主要药品与试剂:当归多糖,纯度≥98%,货号:s31086,规格:每瓶25 g,购自苏州瑞诺德生物科技有限公司,使用时采用蒸馏水配制成浓度为3 mg/mL、6 mg/mL的当归多糖溶液,现用现配。尼莫地平片,规格:每片20 mg,批号:20180613,购自亚宝药业集团股份有限公司,使用时用蒸馏水配制成浓度为1.5 mg/mL的尼莫地平混悬液,现用现配。PBS、TBST缓冲液,购自北京华迈科生物技术有限责任公司;末端脱氧核苷酸转移酶(TdT)介导的脱氧尿三磷酸(dUTP)缺口末端标记测定法(TUNEL法)细胞凋亡检测试剂盒,购自上海恒斐生物科技有限公司;二氨基联苯胺(DAB)显色试剂盒,购自北京百奥莱博科技有限公司;大鼠B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)酶联免疫分析(ELISA)检测试剂盒,购自武汉菲恩生物科技有限公司;RIPA组织裂解液,购自北京碧橙蓝生物科技有限责任公司;兔抗磷酸化原癌基因丝氨酸/苏氨酸蛋白激酶-1(p-Raf1)、磷酸化丝裂原活化蛋白激酶2(p-MEK2)、磷酸化细胞外调节蛋白激酶1/2(p-ERK1/2)、β-肌动蛋白(β-actin)单克隆抗体,购自北京孚博生物科技有限公司;羊抗兔IgG-HRP(辣根过氧化物酶标记抗体),购自上海恒斐生物科技有限公司;十二烷基硫酸钠聚丙烯酰胺 (SDS-PAGE)凝胶制备试剂盒,购自金克隆(北京)生物技术有限公司;ECL化学发光检测试剂盒,购自爱必信(上海)生物科技有限公司。(3)主要仪器设备:ID-Centrifuge 12 S II型离心机,瑞士DiaMed GmbH公司产品;EM-3000型光学显微镜,日本多美公司产品;SUNRISE型酶标仪,瑞士TECAN公司产品;GeneQuant Pro型超微核酸蛋白检测仪,美国GE公司产品;HYDRASYS 2型全自动电泳仪,法国SEBIA公司产品;Trans-Blot型转膜仪,美国BIO-RAD公司产品。
1.2方法 (1)造模及实验方法[6]:适应性饲养完成后,将所有大鼠依照随机数字表法分为对照组12只和造模组53只。腹腔注射4%水合氯醛350 mg/kg麻醉大鼠,仰卧位固定于小动物手术台上,颈前右侧常规备皮消毒,于颈正中线右侧旁开0.5 cm处作纵向切口,逐层分离组织,暴露右颈总动脉,分离右颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)及翼腭动脉(PPA),造模组用4号手术线将ECA远心端和PPA近心端结扎,动脉夹夹闭CCA、ICA,于距离ICA和ECA交叉部4 mm的ECA结扎处剪“V”形切口,长度为0.2 mm左右,并将4号手术线穿过交叉部3 mm内;“V”形切口内插入2-0尼龙鱼线,去掉夹闭ICA的动脉夹,将线栓(2-0尼龙鱼线头端5 mm用石蜡包被,且标记18 mm处)依次经ECA-ICA和ECA交叉部-ICA-大脑前动脉(ACA)、中动脉(MCA)分叉处插入16 mm~18mm,阻断MCA入口,切口外留线栓1 cm左右;将ECA远心端结扎并固定线栓;对照组仅分离动脉,不进行栓塞;去掉夹闭CCA的动脉夹,缝合皮肤;2 h后,轻轻拉出线栓,感受到阻力时剪断,将ECA近心端结扎;于伤口注射青霉素2.5 mg/kg以防止染。待大鼠清醒且生命体征稳定后,采用Zea longa神经功能缺失评分[6]评估大鼠神经功能,评分为1~3分即认为脑缺血再灌注损伤模型建立成功。将造模成功的48只大鼠随机分为模型组、西药组及当归多糖低、高剂量组,各12只。模型组、对照组分别灌胃给予蒸馏水10 mL/kg,每日1次;西药组灌胃给予1.5 mg/mL尼莫地平悬液10 mL/kg,每日1次;当归多糖低、高剂量组分别灌胃给予3 mg/mL、6 mg/mL当归多糖溶液10 mL/kg,每日1次。所有大鼠连续给药7 d。(2)神经功能缺损评分评估:末次给药次日,采用Zea Longa评分标准对大鼠神经功能进行评分:无神经功能缺损记0分;提尾时左侧前肢伸展不完全记1分;自发行走时向左侧转圈记2分;自发行走时向左侧跌倒记3分;意识丧失,不能自发行走记4分。(3)标本采集与处理[7]:麻醉后于冰上断头取脑,自缺血侧脑组织重分离海马组织,其中1/2液氮速冻后保存于-80℃冰箱内,以备蛋白质免疫印迹(Western blot)检测;另外1/2海马组织加入10倍体积预冷的生理盐水,充分匀浆后,以3 000 r/min速度离心15 min,将组织上清液保存在-70 ℃冰箱内。剩余缺血侧脑组织置于4%多聚甲醛内固定48 h,经二甲苯透明、梯度酒精脱水、石蜡包埋后,制备2 μm切片,于冷水内展片放于载玻片上,65℃烘干1 h,4℃保存备检。(4)TUNEL法检测大鼠缺血侧脑组织凋亡细胞数[8]:将(3)中制备的组织切片取出,恢复至室温,采用二甲苯脱蜡10 min×2 次,100%-100%-95%-95%-80%-80%-70%-70%酒精依次处理5 min,然后去离子水冲洗2 min×3 次使切片水化;采用终止液50 mL处理切片5 min使内源性过氧化物酶失活,去离子水冲洗2 min×3 次;按照试剂盒说明书配制TUNEL反应液,取50 μL处理切片,37 ℃反应5 min后终止,PBS冲洗2 min×3 次;取HRP标记链霉亲和素溶液50 μL处理切片,18 ℃反应10 min后,PBS冲洗2 min×3 次;采用DAB显色试剂盒室温染色6 min,去离子水漂洗10 s后,用甲基绿溶液染色3 min;依次采用去离子水漂洗、70%-90%-95%-95%-100%酒精脱水、二甲苯透明、中性树胶封片。在光学显微镜下观察染色结果,凋亡阳性细胞的细胞核呈棕色,于400倍镜下,每张切片随机选择5个不重复视野,计数凋亡细胞个数,并取平均值。(5)ELISA法检测大鼠海马组织Bcl-2和Bax水平[9]:将1.2.3中制备的海马组织上清液取出,4℃缓慢融化并恢复至室温,按照ELISA试剂盒说明书,采用SUNRISE型酶标仪测定海马组织上清液内Bcl-2和Bax水平。(6)Western Blot法检测大鼠海马组织p-Raf1、p-MEK2、p-ERK1/2蛋白表达水平[8]将(3)中保存的海马组织取出100 mg,置于玻璃匀浆器内,加入RIPA组织裂解液(含苯甲基磺酰氟)1 mL,于冰上匀浆30 min,超声裂解5 s×3次,4℃、12000 r/min速度离心5 min,分离上清液,采用超微核酸蛋白检测仪测定总蛋白浓度;取蛋白样本,加入2×蛋白上样缓冲液10 μL,煮沸5 min,冷却备用;按照试剂盒说明配制SDS-PAGE10%分离胶和5%浓缩胶,注入电泳仪上;上样,开始电泳,电压为浓缩胶80 V、分离胶120 V;采用转膜仪将目的蛋白条带转印至聚偏氟乙烯(PVDF)膜上,TBST洗膜10 min×3次;PVDF膜置于5%脱脂奶粉封闭液内,室温摇床封闭1.5 h;PVDF膜置于p-Raf1(1:1 000稀释)、p-MEK2(1:1 000稀释)、p-ERK1/2(1:800稀释)、β-actin(1:2 000稀释)一抗工作液内,4℃孵育过夜,取出后TBST洗膜10 min×3次;将PVDF膜置于羊抗鼠二抗工作液(1:5 000稀释)内,室温孵育2 h,取出后TBST洗膜10 min×3次;采用ECL处理PVDF膜5 min后曝光。扫描曝光后的底片,用Quantity one软件分析各蛋白条带灰度值,计算p-Raf1、p-MEK2、p-ERK1/2蛋白相对于β-actin的表达量。
1.3统计学方法 所有统计数据均统一整理,采用spss22.0软件包分析,符合正态性的计量资料采用均数±标准差表示,多组间比较采用单因素方差分析,P<0.05存在统计学意义;组间多重比较采用LSD-t检验,P<0.05存在统计学意义。
2 结果
2.1各组大鼠神经功能缺损评分比较 与对照组比较,模型组大鼠神经功能缺损评分明显较高,差异有统计学意义(P<0.05)。与模型组比较,当归多糖低、高剂量组和西药组大鼠神经功能缺损评分较低,且当归多糖低剂量组>当归多糖高剂量组和西药组,差异有统计学意义(P<0.05)。 见表1。

表1 各组大鼠神经功能缺损评分比较
2.2各组大鼠缺血侧脑组织凋亡细胞数比较 TUNEL染色结果显示,对照组有少量凋亡细胞存在(见图1A);模型组可见大量棕色凋亡细胞核(见图1B);当归多糖低、高剂量组和西药组大鼠凋亡细胞数量较模型组有不同程度减少(见图1C、D、E)。定量分析显示,与对照组比较,模型组大鼠缺血侧脑组织凋亡细胞数明显增加,差异有统计学意义(P<0.05)。与模型组比较,当归多糖低、高剂量组和西药组大鼠缺血侧脑组织凋亡细胞数均较低,且当归多糖低剂量组>当归多糖高剂量组和西药组,差异有统计学意义(P<0.05)。 见表2。

表2 各组大鼠缺血侧脑组织凋亡细胞数比较

注:(A:对照组 B:模型组 C:当归多糖低剂量组 D:当归多糖高剂量组 E:西药组)图1 各组大鼠缺血侧脑组织凋亡细胞观察 (TUNEL染色,×400)
2.3各组大鼠海马组织Bcl-2和Bax水平比较 与对照组比较,模型组大鼠海马组织Bcl-2和Bax水平均明显升高,差异有统计学意义(P<0.05)。与模型组比较,当归多糖低、高剂量组和西药组大鼠海马组织Bcl-2水平均较高,且当归多糖低剂量组<当归多糖高剂量组和西药组,差异有统计学意义(P<0.05)。与模型组比较,当归多糖低、高剂量组和西药组大鼠海马组织Bax水平均较低,且当归多糖低剂量组>当归多糖高剂量组和西药组,差异有统计学意义(P<0.05)。 见表3。

表3 各组大鼠海马组织Bcl-2和Bax水平比较
2.4各组大鼠海马组织 p-Raf1、p-MEK2、p-ERK1/2蛋白表达水平比较与对照组比较,模型组大鼠海马组织p-Raf1、p-MEK2、p-ERK1/2蛋白表达水平明显升高,差异有统计学意义(P<0.05)。与模型组比较,当归多糖低、高剂量组和西药组大鼠海马组织p-Raf1、p-MEK2、p-ERK1/2蛋白表达水平均较低,且当归多糖低剂量组>当归多糖高剂量组和西药组,差异有统计学意义(P<0.05)。 见表4,图2。

表4 各组大鼠海马组织p-Raf1、p-MEK2、p-ERK1/2蛋白表达水平比较
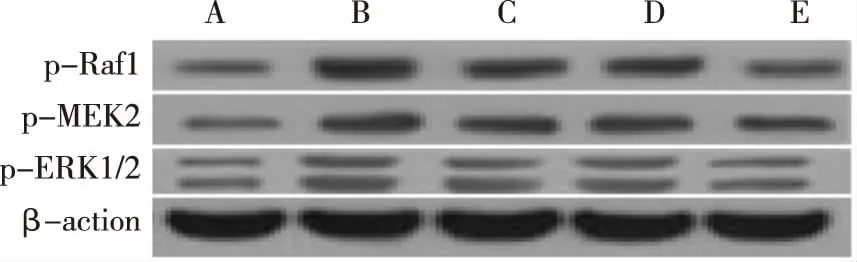
注:(A:对照组 B:模型组 C:当归多糖低剂量组 D:当归多糖高剂量组 E:西药组)图2 Western Blot法检测各组大鼠海马组织海马组织 p-Raf1、p-MEK2、p-ERK1/2蛋白表达结果
3 讨 论
有报道称[10-12],MAPK途径在脑、心脏等重要器官缺血再灌注时活化,在细胞凋亡诱导中发挥关键作用,改变其活化状态有助于减轻组织损伤。
在此次研究中,我们即基于MAPK/ERK信号通路,探讨当归多糖对CIRI大鼠的影响。当归多糖是中药当归中的额水溶性多糖物质,包括葡萄糖、阿拉伯糖、半乳糖醛酸等,药理研究认为[13],其具有调节免疫功能、促进造血、抗肿瘤、保肝、抗氧化、抗辐射、防治肺纤维化、抗衰老等多种功效。闫安等[14]采用不同剂量的当归多糖对线栓法制备的CIRI模型大鼠进行干预,发现其能通过减少脑组织氧化应激水平,以及抑制炎症相关信号通路Toll样受体-4/核转录因子-κB(TLR-4/NF-κB)激活的作用保护大鼠脑组织。方针等[15]研究则发现,当归多糖能明显促进CIRI大鼠模型的神经功能恢复和血管生成。由此可见,当归多糖可通过不同机制干预CIRI进展。在本研究中,我们采用大脑中动脉阻塞法成功建立了CIRI大鼠模型,分别经不同浓度的当归多糖和尼莫地平治疗后发现,与模型组比较,各用药组大鼠神经功能缺损评分较低,且当归多糖低剂量组>当归多糖高剂量组和西药组,差异有统计学意义(P<0.05),Zea Longa评分是评估神经功能缺损程度的常用指标,得分越高,提示神经功能缺损越明显,病情越严重,上述研究结果表明当归多糖可以有效改善CIRI大鼠神经功能障碍,缓解病情,且药物剂量越高,作用效果越明显。TUNEL检测结果显示,与模型组比较,各用药组大鼠缺血侧脑组织凋亡细胞数均较低,且当归多糖低剂量组>当归多糖高剂量组和西药组,差异有统计学意义(P<0.05),表明高剂量当归多糖能有效抑制神经细胞凋亡,减轻缺血侧脑组织损伤。MAPK/ERK信号通路是MAPKs通路的一种类型,为调控细胞凋亡的常见通路。本研究结果显示,与模型组比较,各给药组大鼠海马组织海马组织Bcl-2水平较高,BAX及p-Raf1、p-MEK2、p-ERK1/2蛋白表达水平均较低,且当归多糖高剂量组和西药组改变较模型组最明显,差异有统计学意义(P<0.05),表明高剂量当归多糖可以有效下调海马组织p-Raf1、p-MEK2、p-ERK1/2蛋白表达,进而提高海马组织Bcl-2水平,降低海马组织Bax水平,这可能是当归多糖抑制CIRI大鼠脑组织细胞凋亡的作用机制之一。
综上所述,当归多糖能剂量依赖性的减轻脑缺血再灌注损伤大鼠神经功能缺损,调节凋亡相关蛋白Bcl-2、Bax水平,抑制缺血脑组织细胞凋亡,其作用可能与下调MAPK/ERK信号通路中的p-Raf1、p-MEK2、p-ERK1/2蛋白表达有关。
