β-胡萝卜素微胶囊制备及理化特性分析
2021-08-27周锐丽秦云云随杨潘思轶
周锐丽,秦云云,随杨,潘思轶
(1.陆军勤务学院训练基地,湖北 武汉 430000;2.山西省晋城市古书院矿医院,山西 晋城 048000;3.华中农业大学食品科学技术学院,湖北 武汉 430000)
β-胡萝卜素作为主要的食品天然色素,广泛存在于自然界中。但是其水溶性差和不稳定性严重限制了其应用,这也使得β-胡萝卜素在生产加工和应用中存在着很大局限[1]。为了解决这个难题,许多学者尝试运用了多种方法,其中最有效的方法就是利用微胶囊技术将其包埋,从而提高其稳定性和水溶性。
微胶囊技术是新兴的保护芯材技术,选择最合适的包壁材料在微胶囊技术中是一个至关重要的问题,并且决定着微胶囊产品的理化性质。从其来源分类,可选的壁材主要有天然的、半合成的以及合成的高分子材料[2]。
鉴于β-胡萝卜素的水溶性差和不稳定性的特点,国内外许多专家学者对β-胡萝卜素的微胶囊化进行了广泛深入的研究,Desobry[3]使用麦芽糊精作为壁材,对β-胡萝卜素进行包埋,并且测定其在喷雾干燥、滚筒干燥和冷冻干燥条件下的保存效果,并且研究其在不同湿度和贮藏温度下的稳定性,得到的主要结论是滚筒干燥的方法是最好的;胡富强等[4]使用明胶、阿拉伯胶作为壁材,采用复凝聚法制备β-胡萝卜素微胶囊。以光照试验考察了β-胡萝卜素微胶囊的稳定性,发现在室温贮藏条件下,光照对β-胡萝卜素稳定性有较大影响[1],将β-胡萝卜素包埋之后,微胶囊可以保护里面的β-胡萝卜素不被氧化变质,可增加其稳定性;Wagner[5]研究不同取代度的淀粉水解产物对喷雾干燥后的β-胡萝卜素稳定性的影响,结果发现高取代度(36.5)的淀粉比其他 3 种低取代度(4、15、25)的淀粉对β-胡萝卜素有更好的保留效果。果胶是一种具有黏胶性的多糖,在食品和医药生产中都有广泛的利用,为此,在研究了不同壁材及配比对β-胡萝卜素包埋的影响后,选择了乳清分离蛋白(whey protein isolate,WPI)单独进行包埋和乳清分离蛋白果胶混合物包埋两种制备工艺。
1 材料与方法
1.1 材料与仪器
β-胡萝卜素晶体粉末(96%)、乳清分离蛋白:景竹生物科技有限公司;中链甘油三酯、果胶:上海源叶生物科技有限公司;磷酸氢二钠、磷酸二氢钠、无水乙醇、丙酮、石油醚、氯仿、环己烷(分析纯):国药集团化学试剂有限公司。
离心机(TDL-5-A):上海安亭科学仪器厂;电子天平(EL204-IC):梅特勒-托利多仪器(上海)有限公司;pH计(PHS-25):上海圣科仪器设备有限公司;水浴恒温振荡器(DSHZ-300A):苏州培英实验设备有限公司;磁力搅拌器(85-2):郑州长城科工贸有限公司;均质器(PT MR 2100):瑞士 Kinewmatica公司;激光颗粒度分布仪(APA2000)、Zeta电位仪(Zetasizer Nano):英国马尔文仪器有限公司;真空冷冻干燥机(ALPHA1-4LD):德国M.CHRIST;高压微射流纳米均质机(M-110L):美国安捷伦公司;扫描电镜(JSM-6390LV):日本NTC公司;透射电镜(H-7650):日本 HITACHI公司;傅里叶变换红外光谱仪(Nexus 470):美国Nicolet公司。
1.2 方法
1.2.1 β-胡萝卜素标准曲线的制作
1.2.1.1 β-胡萝卜素测定波长的选择
采用洪清等[6]的方法:准确称取β-胡萝卜素晶体粉末0.002 5 g于100 mL棕色容量瓶中,加入少量氯仿溶解后,用环己烷定容至100 mL。取10 mL溶液于另一个100 mL棕色容量瓶中,用环己烷定容至100 mL,配制成2.5μg/mL的溶液,以环己烷为空白,在400 nm~500 nm波长下扫描检测β-胡萝卜素的吸收光谱,确定最大吸收峰的波长。
1.2.1.2 β-胡萝卜素含量的测定
参照韩宁[7]的方法,用分光光度法制作β-胡萝卜素标准曲线:准确称取β-胡萝卜素晶体粉末0.025 0 g(纯度96%)于50 mL棕色容量瓶中,先加入1 mL氯仿溶解,用丙酮∶石油醚(1∶1,体积比)混合有机剂定容至50 mL;再将此溶液稀释10倍,分别准确取0.5、0.75、1.0、1.25、1.5 mL 于 25 mL 棕色容量瓶中,定容至25 mL;以丙酮∶石油醚(1∶1,体积比)混合有机溶剂为空白对照,分别在最大吸收波长455nm处测定OD455nm,绘制β-胡萝卜素标准曲线。
1.2.2 β-胡萝卜素微胶囊的制备
参考崔健等[8]的方法,做适当改变后如下:将0.2%果胶溶解于50 mmol/L磷酸缓冲液(pH7.0)中,4℃冷藏备用;将1%乳清分离蛋白溶于50 mmol/L磷酸缓冲液中(pH7.0),25℃下磁力搅拌至完全溶解,制备成水相;将β-胡萝卜素溶于0.2%中链甘油三酯(medium chain triglycerides,MCT),磁力搅拌至完全溶解,制备成油相;将油相与水相按质量比1∶9混合,利用均质器于19 000 r/min下高速剪切2 min;向初级乳状液中分别加入磷酸缓冲液(pH7.0)和果胶溶液,初乳占总体积一半;将混合溶液磁力搅拌30 min,再用1 mol/L的HCl调节混合液的pH值至3.0,得到二级乳状液;将二级乳状液在0.076 MPa下高压微射流均质3次;将乳状液冷冻干燥后得到两种β-胡萝卜素微胶囊粉末。
1.2.3 β-胡萝卜素包埋率的测定
参照许波[9]的方法,略作调整后,进行β-胡萝卜素微胶囊包埋率的测定。准确称取0.1 g β-胡萝卜素微胶囊样品于25 mL离心管中,加入10 mL丙酮∶石油醚(1∶1,体积比)混合有机溶剂,剧烈振荡 2 min;然后高速离心 5 min(4℃,转速 6 000 r/min);吸取 5 mL上清液于 50 mL棕色容量瓶中,用丙酮∶石油醚(1∶1,体积比)混合有机剂定容至 50 mL;以丙酮∶石油醚(1∶1,体积比)为空白对照,455 nm处测定吸光值。参照β-胡萝卜素含量标准曲线,测得微胶囊表面β-胡萝卜素含量。包埋率按以下公式计算。

1.2.4 Zeta电位仪测定电位和粒径
为了降低多重光散射效应,在测定前用蒸馏水将β-胡萝卜素微胶囊乳状液稀释100倍[10]。用Zeta电位仪分别测定WPI单独包埋和WPI果胶混合物包埋的β-胡萝卜素微胶囊的平均粒子直径(25℃),并分别测定乳清分离蛋白和果胶的Zeta电位。
1.2.5 红外光谱分析
通过傅里叶红外光谱,比较物质在红外光区对光的吸收,分析β-胡萝卜素包埋前后在微胶囊中的形态和壁材间的相互作用,以判断包埋物是否形成。如果形成了包埋物,分子间的非共价键作用,如疏水作用、范德华力和氢键,其键能会降低,相应基团的吸收强度会减弱,由此来判断壁材的包埋作用[10]。
样品在检测前要在红外光下烘干至少1 h,取少量烘干后的样品和干燥的溴化钾粉末一起研磨,直至无晶体存在,然后压制成均匀无裂缝的薄片。
1.2.6 用透射电镜观察
将β-胡萝卜素微胶囊乳液稀释至微透明状,捞片晾干,用透射电子显微镜(transmission electron microscope,TEM)观察两种不同β-胡萝卜素微胶囊的形态,比较差异,同时验证用光散射粒径分析的粒径大小。
2 结果与分析
2.1 β-胡萝卜素标准曲线
2.1.1 β-胡萝卜素最大吸收波长
β-胡萝卜素晶体粉末光谱扫描图见图1所示。

图1 β-胡萝卜素晶体粉末光谱扫描图Fig.1 Spectral scanning of carotene crystal powder
如图1所示,光谱扫描β-胡萝卜素晶体粉末粉(纯度96%)在455 nm处有最大吸收波长,故选择OD455nm作为β-胡萝卜素的吸光值。
2.1.2 β-胡萝卜素含量测定
β-胡萝卜素含量标准曲线图见图2所示。

图2 β-胡萝卜素含量标准曲线Fig.2 Standard curve of carotene content
如图 2所示,浓度在 1 μg/mL~3 μg/mL 范围内,β-胡萝卜素晶体粉末吸光度值与浓度呈现良好的线性关系,线性回归方程为y=0.204x+0.009。
2.2 β-胡萝卜素微胶囊的包埋率
两种微胶囊表面β-胡萝卜素含量见表1。

表1 两种微胶囊表面β-胡萝卜素含量Table 1 Carotene content on the surface of two kinds of microcapsules
由包埋率公式计算得乳清分离蛋白(WPI)、乳清分离蛋白果胶(WPI加果胶)混合物作为壁材的包埋率分别为85.6%和88.2%。说明乳清分离蛋白果胶混合物的双重壁材,可以提高β-胡萝卜素微胶囊的包埋率。
2.3 Zeta电位和粒径
乳清分离蛋白和果胶的电位值见表2。
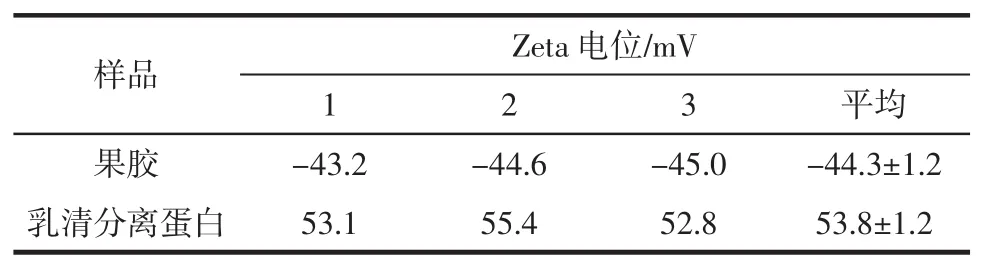
表2 乳清分离蛋白和果胶的电位值Table 2 Potential values of whey isolate protein and pectin
如表2所示,乳清分离蛋白带正电荷,果胶带负电荷,说明两者之间能形成静电吸引,为两者能形成微胶囊壁材且能增加微胶囊稳定性提供了理论基础。表3所示为WPI包埋的β-胡萝卜素微胶囊、WPI和果胶包埋的β-胡萝卜素微胶囊的平均粒径测定值。

表3 WPI包埋的微胶囊、WPI和果胶包埋的微胶囊的粒径Table 3 Particle sizes of whey protein isolate embedded microcapsules whey protein isolate and pectin embedded microcapsules
从表3可以看出,选择用WPI和果胶混合包埋的β-胡萝卜素微胶囊的粒径更小,并且对于WPI包埋的β-胡萝卜素微胶囊而言,其平行性较好,因此可以认为对于大小和平行性,混合包埋的效果更好。
2.4 红外光谱
β-胡萝卜素晶体粉末、WPI包埋的微胶囊、WPI和果胶包埋的微胶囊的红外光谱图见图3所示。

图3 β-胡萝卜素晶体粉末、WPI包埋的微胶囊、WPI和果胶包埋的微胶囊的红外光谱图Fig.3 Infrared spectra of β-carotene crystal powder,WPI encapsulated microcapsules,WPI and pectin encapsulated microcapsules
如图3所示,a为β-胡萝卜素晶体粉末红外光谱图,图中有几处强度较大的吸收峰:2 925.53 cm-1处是-CH3的伸缩振动引起的,1720.221cm-1和1631.51cm-1处的吸收峰为-C=C-伸缩振动;1 631.51 cm-1和1454.08cm-1则是苯环骨架C=C的伸缩振动;1454.08cm-1和1384.66cm-1则是由于甲基面内弯曲振动;966.18cm-1处吸收峰为反式碳碳双键面外摇摆振动。而在b和c中,这些官能团的吸收均减弱,说明乳清分离蛋白和果胶对β-胡萝卜素的结构产生了影响,即形成了包埋物。同时,WPI果胶混合物包埋的微胶囊在官能团处的吸收峰减少幅度更大,说明混合物包埋的程度更高,效果更好,能更多包埋活泼基团来提高稳定性。
2.5 透射电镜观察的结果
WPI包埋的β-胡萝卜素微胶囊在透射电镜下的形态图见图4所示,WPI和果胶包埋的β-胡萝卜素微胶囊在透射电镜下的形态图见图5所示。
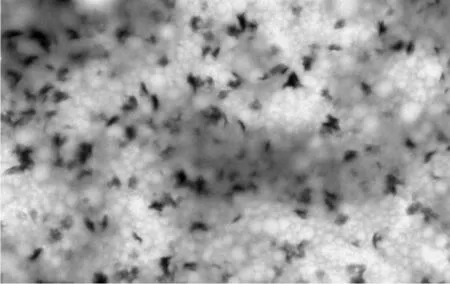
图4 WPI包埋的β-胡萝卜素微胶囊在透射电镜下的形态Fig.4 Morphology of WPI encapsulated β-carotene microcapsules under transmission electron microscope

图5 WPI和果胶包埋的β-胡萝卜素微胶囊在透射电镜下的形态Fig.5 Morphology of WPI and pectin encapsulated β-carotene microcapsules under transmission electron microscope
从图4、图5中可以看到,无论是乳清分离蛋白还是乳清分离蛋白果胶混合物,都形成了包埋物,但是单一包埋的比较混杂,有些β-胡萝卜素还游离在外或夹杂在微胶囊之间,但是混合物包埋得到的微胶囊分布较均一,颗粒大小较稳定。
3 讨论与结论
本试验通过搅拌、高速剪切、高压微射流纳米均质和冷冻干燥,用乳清分离蛋白、乳清分离蛋白果胶混合物分别包埋β-胡萝卜素形成纳米级微胶囊,通过对两种微胶囊粒径的测量以及包埋率的比较,可以看出混合物包埋优于单一的乳清分离蛋白的包埋效果。并且混合物包埋的平行性较好,可以认为相对一段时间内的稳定性较好。
从红外光谱图分析的结果可以看出,官能团的变化证明了β-胡萝卜素包埋在微胶囊里面,不同材料的β-胡萝卜素微胶囊都有相应的振动覆盖,证明β-胡萝卜素被包埋在微胶囊里面。
透射电镜结果显示:两种β-胡萝卜素微胶囊都为完整的形态,但是乳清分离蛋白包埋的β-胡萝卜素微胶囊表面不圆滑,大小不均一,这也证明了之前测定粒径的时候,平行性不好的原因;但乳清分离蛋白和果胶混合物包埋的β-胡萝卜素微胶囊颗粒大小更为均匀,并且可以看到其表面更光滑,同时验证了粒径测定时,其平行性较好的原因。
