低盐胁迫对光裸方格星虫相关组织结构和非特异性免疫酶的影响
2021-08-27李俊伟胡瑞萍陈素文郭永坚朱长波颉晓勇苏家齐
李俊伟,胡瑞萍,陈素文,郭永坚,朱长波,李 婷,颉晓勇,苏家齐
(1. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室/广东省渔业生态环境重点实验室,广东 广州 510300; 2. 广州市海威水产科技有限公司,广东 广州 510300)
盐度是影响水生动物繁殖、发育和生长的重要环境因素之一[1-2]。受全球变暖、降雨增加以及潮汐变化等因素影响,海水盐度出现下降趋势,尤其是雨季形成的地表径流会造成潮间带区域的海水盐度急剧下降,进而影响海水中喜盐生物的生长与繁殖。
星虫类动物是典型的喜高盐生物,盐度是影响其分布的主要环境因子。星虫类动物在繁殖和发育期对低盐的耐受性极差,其繁殖的正常盐度介于25~44,因此其在封闭的低盐环境中无法正常繁殖和发育[3-5]。光裸方格星虫 (Sipunculus nudus) 又称方格星虫,为暖水性、世界广布种,在北部湾沿海滩涂和国内浅海区域均有分布。由于降雨和地表径流等因素,潮间带区域的方格星虫易受到盐度骤变的影响,而渗透调节是水生动物应对盐度变化的生存基础,因此关于盐度变化对渗透调节器官影响的研究受到广泛关注[1]。方格星虫属于较低等的无脊椎动物,受渗透压影响的组织器官主要为体腔液和体壁组织。国内学者曾研究方格星虫幼虫对盐度的耐受性[6-7],对盐度骤降情况下方格星虫成体的生物学结构、免疫能力变化、耐受程度等方面缺乏系统研究。
本研究采用多个盐度处理组开展方格星虫养殖试验,针对其成活率、渗透压、生物组织结构及免疫酶活性等指标研究方格星虫在盐度骤降情况下的综合反应,以丰富方格星虫的盐度变化适应机制,为其增养殖生产提供理论依据。
1 材料与方法
1.1 试验材料及分组
试验用方格星虫采自近海滩涂区域,滩涂底质为细沙质。将方格星虫暂养于循环流水槽中,水槽内铺设细沙,方格星虫体质量为 (4.24±0.95) g,养殖密度为80条·m−2。暂养期间水体盐度29.8~30.9,水温 29~31 ℃,水体溶解氧质量浓度高于 6.0 mg·L−1,养殖10 d后开展盐度胁迫试验。
设置6个盐度处理组 (5、10、15、20、25、30),分别记为 S5、S10、S15、S20、S25、S30,每个处理组设4个重复。采用天然海水和蒸馏水按照不同比例配制各试验组的盐度。试验用养殖箱为 31 cm×20 cm×17 cm,铺设相同厚度的细沙(14.5 cm),粒径为 0.1~0.2 mm,养殖箱内加入3 L不同盐度的水,然后将暂养池中的方格星虫直接转移到相应的养殖箱中进行急性盐度胁迫试验,养殖密度为6条·箱−1。试验期间不投喂,连续微孔充氧96 h。在试验初始时每个处理组取4条方格星虫作为初始样品,随后在试验开始后第24、第48和第96 小时从养殖箱各取1条进行肌肉和体腔液取样,用于测定免疫酶活性。
1.2 样品采集与测定
采集方格星虫后用吸水纸擦拭并称质量,使用一次性无菌注射器抽取体腔液,并记录体腔液体积,样品采集在冰袋上低温操作,体腔液于4 ℃静置 12 h 后,以 3 000 r·min−1进行离心,分装上清液。分装好的体腔液上清和肌肉组织均于−80 ℃保存,用于测定免疫酶活性。
采用南京建成生物工程研究所的试剂盒测定体腔液和体壁肌肉中的蛋白质含量、过氧化氢酶(CAT)、超氧化歧化酶 (SOD) 活性。采用组织渗透压计 (Vapor pressure osmometer) 测定体腔液的渗透压。
方格星虫的体壁组织经过乙醇脱水、二甲苯透明、石蜡包埋、石蜡切片、苏木素-伊红染色和中性树脂封片,采用光学显微镜 (ZEISS Axio Scope A1型) 进行观察和记录图像,观察盐度骤变后方格星虫的体壁组织结构变化。
1.3 数据分析
采用 SPSS 17.0 和 Excel 2010软件进行数据统计和分析。不同处理组间的数据差异采用One-way ANOVA进行分析,显著性为P<0.05。
2 结果
2.1 盐度骤降对方格星虫行为和成活率的影响
不同处理组方格星虫的成活率见图1。除S20、S25、S30外,其他各组均出现方格星虫死亡现象。S5、S10、S15这3组的最终成活率均为0,与其他各组差异显著 (P<0.05)。3个低盐度组(S5、S10、S15) 的成活率分别在 24、72和 96 h 内达到0。观察发现,较高盐度组 (S20、S25、S30)方格星虫钻沙迅速,且在30 min内全部钻入沙层中,而低盐度组 (S5、S10) 钻沙缓慢,分别仅有45.83%、62.50%的方格星虫完整钻入沙中。

图1 不同盐度处理组在盐度骤变后方格星虫的累计成活率Figure 1 Cumulative survival rate of S. nudus of different salnity groups after salinity fluctuation
2.2 盐度骤降对方格星虫体质量、体腔液体积和渗透压的影响
方格星虫体质量和体腔液质量变化见图2和图3。S10、S15、S20处理组方格星虫的体质量和体腔液体积均在第24小时显著增加 (P<0.05),体质量增加幅度较大的S10、S15组方格星虫先后死亡,增加幅度较小的S20组全部存活;S25和S30组方格星虫体质量和体腔液质量均未表现出明显变化。体质量和体腔液体积的线性回归分析表明,盐度骤降后,方格星虫的体腔液体积变化和体质量变化具有较强的相关性 (R2>0.96)。
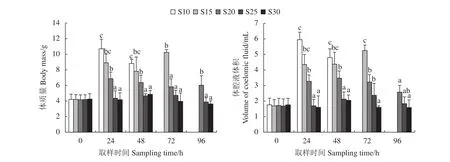
图2 各盐度处理组在不同实验阶段方格星虫的体质量和体腔液体积变化方柱上不同字母表示处理组间差异显著 (P<0.05);后图同此Figure 2 Variation of body mass and coelomic fluid of S. nudus of different salnity groups at different experimental stagesDifferent lowercase letters indicate significant difference (P<0.05). The same case in the following figures.
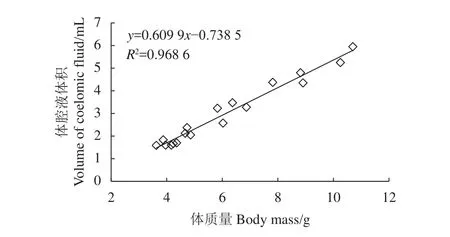
图3 方格星虫体质量与体腔液体积的相关性Figure 3 Linear-regression analysis between body mass and coelomic fluid volume
方格星虫体腔液渗透压和体壁肌肉蛋白质含量变化见图4。随着盐度骤降幅度的增加,方格星虫体腔液渗透压表现出明显降低的趋势。S5、S10、S15、S20和S25组在第24小时分别下降至272、359、471、666和 753 mOsm·L−1,S20和 S25组在第48小时体腔液渗透压有所回升,但是仍低于初始值,S30组体腔液渗透压一直保持相对稳定状态。S10、S15和S20组在第24小时体壁肌肉蛋白质含量均表现出下降趋势,但未达到显著差异 (P>0.05)。在第48小时,S10、S15、S20和S25组体壁肌肉蛋白质含量显著低于S30组 (P<0.05)。在第72小时,S15、S20和S25组体壁蛋白质含量均升高,与S30组无显著差异 (P>0.05)。

图4 各盐度处理组在不同采样时间方格星虫体腔液渗透压和体壁肌肉蛋白质质量分数变化Figure 4 Variation of osmotic pressure of coelomic fluid and protein mass fraction of S. nudus of different salnity groups at different sampling time
2.3 方格星虫触手、体壁的组织结构变化
与S30组相比,S5、S10、S15组方格星虫体壁纵肌和环肌结缔组织均明显变细、疏松、染色变浅,体腔膜表层的柱状上皮细胞染色均变浅,体腔膜与纵肌束基部脱离,空隙明显变大 (图5)。S5、S10、S15组触手表层的柱状颗粒细胞核变圆,其分布更加分散,触手内部的血窦体积增加 (图6)。
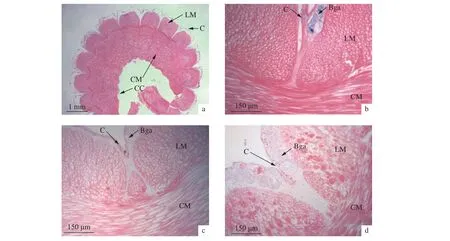
图5 不同盐度处理组中方格星虫的体壁结构组织观察a. 体壁横切 (10×);b. S30组体壁 (100×);c. S15组体壁 (100×);d. S5组体壁 (100×);LM. 纵肌束;C. 体腔膜;CM. 横肌;CC. 角质层;Bgc. 柱状上皮细胞Figure 5 Light microscopic observation of body tissue of S. nudus in different salnity treatmentsTransverse section of body wall (10×); b. Body wall (100×) in S30; c. Body wall (100×) in S15; d. Body wall (100×) in S5;LM. Longitudinal muscle; C. Coelarium; CM. Circular muscle; CC. Cuticular; Bgc. Columnar cell
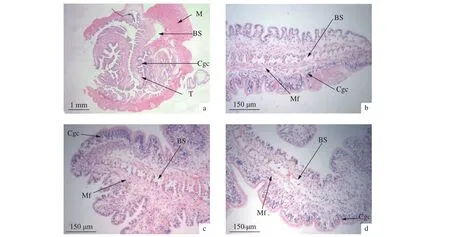
图6 不同盐度处理组中方格星虫触手的观察a. 触手 (10×);b. S30组触手 (100×);c. S15组触手 (100×);d. S5组触手 (100×);M. 肌肉;BS. 血窦;Cgc. 多层柱状细胞;T. 触手;Mf. 肌纤维Figure 6 Observation of tentacle of S. nudus in different salnity treatmentsa. Transverse section of tentacle (10×); b. Tentacle (100×) in S30; c. Tentacle (100×) in S15; d. Tentacle (100×) in S5;M. Muscle; Bs. Blood sinus; Cgc. Columnar cell; T. tentacle; Mf. muscle fiber
2.4 方格星虫体壁和体腔液中的免疫酶活性变化
方格星虫体壁肌肉SOD活性变化较小,S10、S15、S25组在第24小时有升高趋势,略高于S30组 (P>0.05),S20组显著低于 S10组 (P<0.05)。S10、S15组SOD活性在第48小时均降低,且以上2组方格星虫分别在72和96 h内死亡。从第48到第96小时,S20、S25组与S30组的SOD活性相近 (图7-a)。方格星虫体腔液SOD活性变化较大,S10组在第24小时显著低于其他处理组 (P<0.05),而S15、S20组在第48小时也显著低于S25和S30组 (P<0.05),S10组方格星虫在第72小时死亡,S15组方格星虫体腔液SOD活性在第72小时有所增加,随后在第96小时死亡。S25组体腔液SOD活性在第72小时增加,随后恢复到正常水平 (图 7-b)。

图7 不同盐度处理组方格星虫体壁肌肉 (a) 和体腔液 (b) 超氧化物歧化酶活性变化Figure 7 SOD activity in body wall tissue (a) and coelomic fluid (b) of S. nudus of different salnity groups
方格星虫体壁肌肉CAT活性变化范围较大,S10、S20组在第24小时显著低于其他处理组(P<0.05),S10、S15、S20组在第48小时显著高于S30组 (P<0.05)。在第96小时,S20、S25组仍高于 S30组 (图 8-a)。S10、S15、S20组体腔液中CAT活性均表现出先增加后降低的趋势,其中S15组CAT活性在第24小时显著增加 (P<0.05),而S10、S20组CAT活性在第48小时增加,S25组CAT活性相对稳定 (图8-b)。
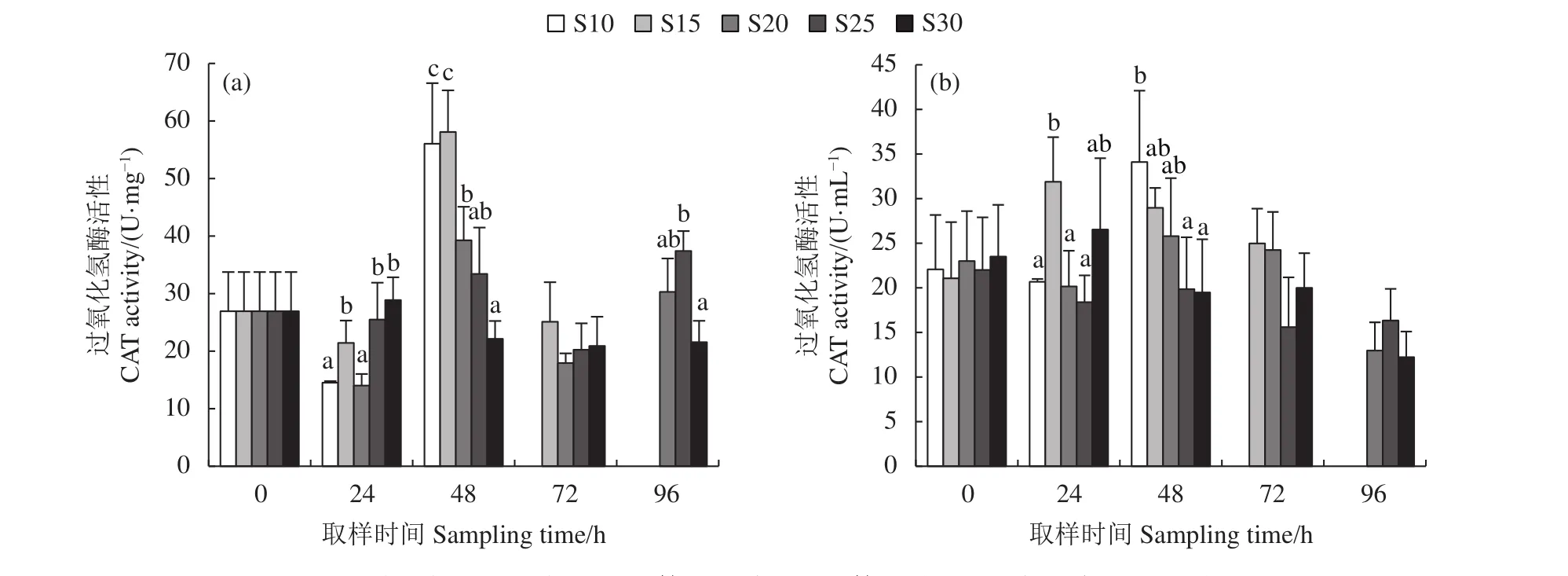
图8 不同盐度处理组方格星虫体壁肌肉 (a) 和体腔液 (b) 过氧化氢酶活性变化Figure 8 CAT activity in body wall tissue (a) and coelomic fluid (b) of S. nudus of different salnity groups
3 讨论
3.1 低盐胁迫对方格星虫体腔液渗透压的影响
方格星虫体腔液渗透压受外界环境盐度变化影响较大。以往研究发现,仿刺参(Apostichopus japonicus) 是等渗动物,其体腔液的渗透压与外界水环境渗透压接近,属于变压性生物[8]。本研究发现,随着盐度骤降幅度的增加,S20、S15、S10处理组方格星虫体腔液体积也显著增大,并且渗透压接近养殖水体,表明方格星虫的体腔液渗透压随外界环境渗透压变化而改变,可知方格星虫也属于等渗变压动物。
外界环境渗透压发生变化时,动物机体均会作出渗透调节。高渗或低渗胁迫首先影响体腔液中的含水量和离子含量,进而对细胞产生胁迫损伤,如改变细胞形状、细胞骨架甚至造成DNA损伤[9-10]。渗透调节是机体细胞通过调节水的跨膜流动从而维持细胞结构和功能的能力。盐度骤降时,外界水进入到体腔内造成各种离子及其他物质浓度下降。盐度骤降幅度过大时,细胞膜受损,钾、钙等离子游离到细胞外,进而影响细胞内的各种代谢活动[11]。研究表明,仿刺参具有一定的渗透调节能力,可以适应一定的盐度变化[12],当盐度骤降幅度较大时,其体腔液渗透压降低明显[13],生物学结构和生理代谢均受影响,继而体细胞离子交换和蛋白质合成过程被破坏[14],最终导致仿刺参排脏甚至死亡。本试验中,S20、S25处理组渗透压均表现出先降低后稳定的趋势,且并未出现死亡,表明方格星虫的机体调节和细胞自身调节能够抵抗盐度骤降10的变化。S5、S10、S15处理组方格星虫的渗透压均降低,并且死亡率先后达到100%,表明方格星虫的机体和细胞调节不能够抵抗盐度骤降15~25的变化,可知方格星虫具有一定程度的渗透调节能力。方格星虫的渗透调节能力与仿刺参存在不同之处,仿刺参体腔液中仅有免疫相关细胞,无血细胞[8,15],在低盐胁迫时仿刺参排出内脏和体腔液,降低对内脏组织的胁迫,而方格星虫缺乏排脏反应,并且其体腔液中包含血细胞、白细胞及多种免疫相关细胞和生殖细胞[16],表明低盐胁迫对方格星虫的呼吸及免疫代谢等方面具有更为严重的危害。
3.2 低盐胁迫对方格星虫体壁结构的影响
本研究发现低盐胁迫会影响方格星虫的肌纤维结构和细胞形态。方格星虫和海参类动物均缺乏完善的体表防御屏障,外界低盐环境容易造成大量水分进入到体腔内。研究发现,低盐胁迫会造成仿刺参体壁组织中胶原纤维间的空隙增加[17],会引起三疣梭子蟹(Portunus trituberculatus) 的鳃丝上皮层变薄甚至破坏、鳃腔增大、血细胞增多[18],也会导致三疣梭子蟹和凡纳滨对虾 (Litopenaeus vannamei)肝胰腺的分泌细胞增多,柱状上皮细胞空泡化明显[18-19]。本研究发现,正常盐度中 (S30) 的方格星虫体壁纵肌纤维致密,体腔膜与纵肌紧密相连,柱状上皮细胞体积较小、染色较深,而低盐处理组(S5、S10、S15) 方格星虫体质量明显增加,体壁纵肌纤维肿胀、增生,纵肌束基部连接松散,组织切片染色较浅,纵肌和环肌纤维均变细、纤维空隙增大。体腔膜表层的柱状上皮细胞体积增大,细胞核HE染色变浅,表明低盐环境对方格星虫体壁组织结构造成破坏,影响了细胞核、肌纤维等相关组织的正常功能。
低盐处理 (S5、S10、S15) 也造成方格星虫触手表层的柱状颗粒细胞数量增加,触手分支变大、增生,触手肌纤维变细、血窦空隙增加。方格星虫摄食和钻沙过程中均需要伸展吻部触手,利用其固着和黏附能力进行摄食和运动[4],根据方格星虫摄食细微颗粒物质的习性分析,其触手表层柱状细胞的作用之一可能是分泌某种起到黏附作用物质。低盐环境对柱状细胞的影响导致方格星虫触手黏附能力减弱,并且触手纤维变细也造成运动受限,从而限制了方格星虫迅速钻沙的能力。低盐度组 (S15、S20) 方格星虫体壁肌肉蛋白质含量在第24和第48小时降低明显,而在后期采集的方格星虫体壁蛋白质含量有升高的趋势,可能与采集的星虫样本钻沙较深、活力较强、体腔液增加较少有一定关系。
3.3 盐度骤降对方格星虫体内免疫酶活性的影响
方格星虫体内的免疫酶活性受到低盐胁迫的显著影响。方格星虫属于无脊椎动物,缺乏特异性免疫组织和器官。在非特异性免疫生物中,体腔细胞既是细胞免疫的承担者,又是体液免疫因子的提供者。SOD和CAT可以清除活性氧自由基,SOD首先将·O2−歧化为H2O2和H2O,随后CAT将H2O2催化为水和氧气,使得H2O2不会进一步生成氢氧根离子。一般情况下,SOD和CAT活性升高预示着机体内需要清除的自由基含量增加[20]。有研究表明,低盐胁迫会造成海马 (Hippocampus kuda)、黄姑鱼 (Nibea albiflora)、毛蚶 (Scapharca subcrenata)等体内SOD活性升高[21-23],也会引起克氏双锯鱼 (Amphiprion clarkii) 体内 Na+-K+-ATP酶活性升高[24],而盐度胁迫会造成无脊椎动物如凡纳滨对虾、仿刺参体内SOD活性降低[25-27],主要原因可能是盐度骤降导致仿刺参机体大量吸水,渗透压变化改变了免疫细胞的相关活性,进而降低了酶的催化效率和酶蛋白的合成[27-28]。本研究发现低盐度组体腔液中的SOD活性表现出先降低后升高 (S15、S20) 或先降低然后失活 (S10) 的现象,表明方格星虫不能耐受盐度骤降10及以上的低盐环境,会由于体内免疫系统紊乱而导致免疫酶活丧失。本研究发现方格星虫体壁肌肉中的SOD活性比体腔液中的变化小,表明体腔液中的SOD更易受到低盐环境影响。
本研究发现S10、S15、S20组体壁肌肉中的CAT活性先降低后升高,随后又降低,而体腔液CAT活性表现出先升高后降低的趋势,主要原因可能是盐度骤降幅度大,低盐水快速进入体腔内,体腔液中的CAT活性迅速增加以清除自由基,但是由于大量低盐水进入体腔内,最终导致CAT失活。其他研究发现,低盐胁迫会造成黄姑鱼肝脏CAT活性先降低后升高而后再降低[22],与本研究中的体壁肌肉CAT变化趋势相同;低盐环境也会造成脊尾白虾 (Exopalaemon carinicauda)、青蛤(Cyclina sinensis) 产生 1 000~3 000个差异表达基因[29-30];低盐胁迫也会造成斑节对虾 (Penaeus monodon) 能量代谢相关基因表达量升高,分析其原因可能是斑节对虾需要加速能量分解和转运以适应渗透压的变化[31]。方格星虫栖息于沉积物内部,其对盐度变化的耐受机制可能与其他无脊椎动物有相似之处,其在低盐胁迫下的基因水平变化仍需进一步研究。
4 结论
方格星虫属于等渗变压动物,可以耐受盐度骤降10的水体环境,盐度骤降超过15将会影响其体壁组织结构,并引起体壁和体腔液中免疫酶的活性变化。因此,在方格星虫增养殖生产中,为减少环境应激,提高成活率,应尽量避免盐度骤降超过10的滩涂区域。
