罗源湾细菌多样性调查及其环境影响因子分析
2021-08-27朱琳
朱 琳
(福建省渔业资源监测中心,福建 福州 350003)
海洋细菌多样性,狭义范围包括遗传物质多样性、种群结构多样性、生理性状多样性和生态功能多样性,广义范围上还包括化学多样性、代谢多样性及其生存环境多样性[1]。海洋细菌种类繁多,数量庞大,无时无刻不在参与着海洋物质如氮、碳、磷、硫的循环[2],能有效地降解石油类污染物[3]、结合海水中高浓度CO2[4]、参与营养能量循环,代谢产物又为其他生物提供了生存环境,海洋细菌为海洋生态系统的功能稳定和能量循环、海洋生物的生存代谢作出了巨大的贡献。环境科学家通过对细菌多样性的研究,探讨环境对细菌菌群结构的影响,以此还原生态多样性、维持生物相互关系、修复海洋环境。
罗源湾是福建省六大深水港湾之一,位于福建省东北部,是典型的半封闭海湾,只在东北角由可门与东海互通[5]。2009—2014年间罗源湾水质出现持续恶化,无机氮和活性磷酸盐超标,主要原因是罗源湾前期大规模的围填海、临港工业项目和海水养殖的密集发展。2015年养殖业开始大量清退,但随着经济的发展和清退工作的开展,罗源湾的产业结构向火电能源、钢铁冶炼、港口物流和船舶修造等重工业方面转变[6]。2018年11月罗源湾水域富营养化指数为2.04[7],较之前有明显好转,但水质仍未达标,无机氮和活性磷酸盐含量持续超标,主要原因是陆源性污染没有得到很好的控制,大量的围填海工程导致海湾纳潮量下降,降低了海湾的自净能力,另外养殖藻类的清退[8]也是海水富营养化的客观原因之一。
宏基因组学是以环境样品中的微生物群体为研究对象,直接从中筛选或分析目标基因功能、遗传信息组成、群落结构功能和种群相互关系等的研究方法[9]。宏基因组研究避免了传统微生物学中靠纯培养来筛选菌株的局限,可以从更高、更复杂的层面了解基因资源,认识生物的多样性,描绘完整的群落结构。本文主要运用宏基因组技术对福建罗源湾内细菌多样性进行分析,了解海湾内的细菌分布情况,结合环境数据分析环境因子对细菌的影响,探索可能影响细菌多样性的环境因子,为罗源湾海湾细菌多样性、基因功能和生态结构提供数据基础,为保护海洋生态系统平衡提供科学依据,以及为保护和改善罗源湾海洋环境奠定基础。
1 材料与方法
1.1 站位布设
为了解福建罗源湾海水中的微生物生态系统平衡变化,以及海湾内细菌多样性、菌群结构及环境对细菌分布的影响,于2018年11月对罗源湾进行表层海水采集。根据功能划分设置站位,生活密集地区设置A号站位(26.4170°N、119.6943°E),主要排污口设置B号站位(26.4582°N、119.6810°E),火电站排污口设置C号站位(26.3853°N、119.7127°E),湾内远离污染口设置D号站位(26.4374°N、119.7611°E),出海口设置E号站位(26.43512°N、119.8294°E),共5个站位(图1)。表层水样的采集方法按照GB 17378.3—2007标准要求执行,每个站点采水器深入海面0.5 m采集海水样品,每个海水样品取3个平行样各3 L,并测定相关环境因子。

1.2 样品的采集与前处理
对福建罗源湾内5个站位进行表层水样采集,出发前所有器皿需消毒杀菌,准备稳定剂。采样过程中,每个站位采水样之前都要清洗采水器,确保不出现样品互相污染。每次采集到的水样装入提前灭好菌的无菌样品袋中混匀,分别编号A、B、C、D、E(与站位号一一对应),4℃保存,24 h内进行微生物试验。
1.3 基本方法
1.3.1 总DNA的提取及测序分析
取距海面0.5 m的表层海水通过0.22 μm微孔滤膜抽滤,将密布菌体的一面向内对折后放置在无菌处理后的50 mL离心管中,-40℃保存。在生物安全柜中,无菌条件下将采集的滤膜样品剪碎,按照厂家提供的DNA提取试剂盒的步骤说明进行DNA提取。将提取好的总DNA,-40℃保存送至上海奥维森科技公司进行MiSeq PE300测序及分析。
1.3.2 环境因子的测定
按照GB 17378.4—2007标准中的方法进行环境因子的测定。现场取样并测定水温及盐度;用磷钼蓝分光光度法测定无机磷;用硅钼黄法测定活性硅酸盐;用萘乙二胺分光光度法测定亚硝酸盐;用锌镉还原法测定硝酸盐;用次溴酸盐氧化法测定氨-氮;用紫外分光光度法测定油类;用多管发酵法测定粪大肠菌群。
1.3.3 样品多样性分析
1)OTU基础分析
提取样品的总基因组DNA,按指定测序区域,合成带有barcode的特异性引物或合成带有错位碱基的融合引物,利用PCR扩增进行文库模板的富集[10]。MiSeq测序得出的双端序列,进行过滤处理后拼接成一条序列,去除嵌合体和长度较小的tags。在生物遗传学研究中,对样品测序结果的序列进行分类,相似度达到97%的进行归类操作,划分为一个小组,这个小组就定义为一个OTU,每个OTU对应一条不同的16S rRNA序列,也就是一个OTU对应一个细菌种。
2)Alpha(α-)多样性
α-多样性指数用于测量和度衡群落的物种多样性,通过对单个样品的α-多样性分析,可以反映一个特定区域或生态系统内的多样性,并可用统计学指数估算物种丰富度和多样性。主要因素有两个:一个是Chao1称作菌种丰富度指数,用来估算群落中的OTU值,Chao1值越大,菌种越丰富;一个是Shannon,用来估算样品中细菌多样性的指数之一,Shannon值越大,说明菌群多样性越高。
3)Beta(β-)多样性
3)提出了风速、降雨量、液态水含量超短期预测方法,并以风速、降雨量、液态水含量预测值为基础提出了超短期覆冰趋势预测方法;
β-多样性用于测度群落的物种多样性沿着环境梯度变化的速率或群落间的多样性,即组间差异,可用来表示样本之间的距离。
4)质量控制与质量保障
为了保证实验真实性和数据可靠性,在样品采集、实验操作和数据分析的过程中遵循以下原则:样品的采集前后,都应多次清洗采水器以保证采水器不被前一个样品污染;盛装样品的容器要灭菌消毒后使用;所有的环境因子测定过程中,均设置平行样及空白样;结果需用仪器测定的要在同一台仪器设备上完成,仪器设备使用之前都要进行检定或校准;实验中用到的药品试剂要严格遵循生产日期及有效期,使用前校验纯度,避免因为试剂过期变质引起结果误差。
2 结果与分析
2.1 OTU分析结果
MiSeq得到的测序结果经过一系列操作过滤尾部过短碱基序列、把剩下的序列拼接成一条序列,去除嵌合体和短序列后,得到优质序列,优质序列分布在400~440之间(表1)。序列分布说明数据处理合理有效。

表1 优质序列分布统计
对DNA相似性≥97%的序列分析,共产生了2 035个OTU,样品的OUT数目见表2。其中A站位生活密集地区采集到的样品编号为A,OTU数目为999;B站位主要排污口采集到的样品编号为B,OTU数目为1 004;C站位火电站排污口采集到的样品编号为C,OTU数目为775;D站位在远离污染口的湾内,采集样品编号为D,OTU数目为977;E站位位于可门口与东海相连的出海口,采集到的样品编号为E,OTU数目为807。罗源湾湾内各站位OTU数目从大到小的样品编号依次为B>A>D>E>C,说明B站位OTU数目最多,可能与排污口排放污水有关;A站位OTU数目较多,可能与生活区污水排放引起水体富营养化有关;D站位在湾内,虽然远离污染口,但湾内水体富营养化影响了整个海湾,直接造成了D的OTU值仅次于A站位;C站位靠近可门电厂,工业废水的排放可能含有油类,对OTU值有负影响;E站位在出海口,但是离C站位比较近,可能油类的影响无法忽视。

表2 单个样本的OTU数目统计
样品稀释曲线趋势平坦(图2),说明数据量合理,增加数据量对产生新的OTU影响不大。对各样品的OTU进行Venn图分析(图3),生活区样品独有的OTUs数有91个,排污口样品独有的OTUs 64个,火电站样品独有的OTUs 51个,湾内样品独有的OTUs 27个,出海口样品独有的OTUs 32个。数据表明远离污染物的D、E水样中特征菌种比较单纯、受环境影响较少,生活区水样中特有菌种最多,表明水体富营养化使细菌大量富集,而且变异产生新的菌种。


2.2 Alpha多样性分析
通过单个样品的α-多样性分析,可以对规定区域内或特定生态系统中的细菌多样性进行了解分析,客观反映菌种的丰富度和细菌多样性。5个站位细菌群落通过α-多样性分析各项指数(表3),覆盖率均大于99%,说明能客观真实地反映罗源湾的细菌群落信息。B站位水样中的Chao1和Shannon指数均大于其他样品,C站位的水样中Shanno值最低,D、E站位水样中的Chao1和Shannon指数明显低于A、B样品。说明主要排污口因排放生活污水等,导致水质富营养化较明显,细菌多样性最丰富;生活密集区的人类活动造成的陆源污染对水质造成的污染不容忽视;电厂污水排放口细菌复杂程度变化不明显;D、E两点为远离污染的区域,环境因子对细菌多样性影响不大,群落相对单纯;C站位Shannon值最低,说明群落多样性最小,该站位水质环境因子对细菌群落多样性有负影响。
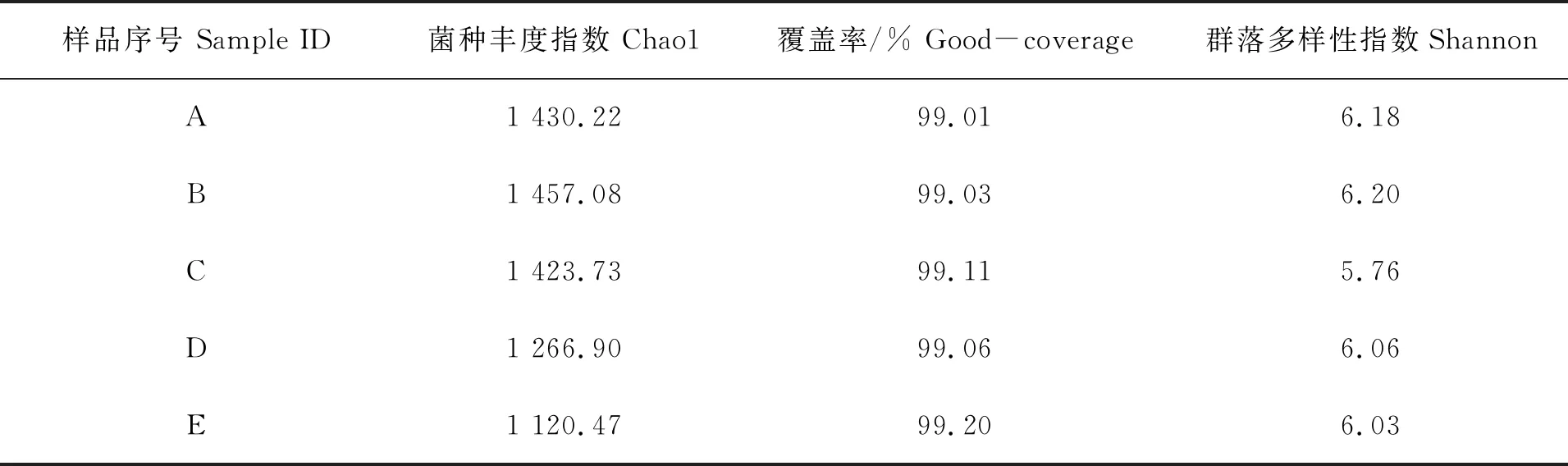
表3 罗源湾细菌α-多样性分析指数
2.3 Beta多样性分析
对罗源湾内5个站位的海水样品运用PCA方差分解,将15组数据的差异反映在坐标图上,如果样本组成越相似,在PCA图中距离越近,以此分析组间和组内差异大小。对5个站位的样品进行聚类分析(图4),同个样品的3个平行样较聚集,说明组内细菌成分较一致,A、B站位出现重合,说明两个站位内,受环境因子影响相似,细菌群落种类相似;D、E站位远离A、B站位,D、E与污染区距离较远,细菌群落较单纯。

2.4 物种注释
对罗源湾5个站位的海水样品按照门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)分类水平进行物种分类统计。
选取门水平中最大丰度排名前20的物种,以样品编号为横坐标,物种丰度为纵坐标,绘制相对物种丰度柱状图(图5)。对比门水平(Phylum)的物种丰度图,得到罗源湾海水中微生物数目前5的优势门分别为变形菌门(Proteobacteria),相对物种丰度为72.00%;拟杆菌门(Bacteroides),相对物种丰度为11.28%;放线菌门(Actinobacteria),相对物种丰度为7.69%;蓝细菌门(Cyanobacteria),相对物种丰度为5.20%;厚壁菌门(Firmicutes),相对物种丰度为2.50%。C样品中的拟杆菌门的相对物种丰度为19.22%,厚壁菌门的相对物种丰度7.81%明显高于其他样品。
对比纲水平(Class)的物种丰度(图6),分析得到所占比例最多的3个纲依次是α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、黄杆菌纲(Flavobacteriia),其中α-变形菌纲平均相对物种丰度为42.53%,黄杆菌纲平均相对物种丰度为10.92%,芽孢杆菌纲(Bacilli)平均相对物种丰度为5.31%。对比各站位纲水平物种丰度(图7),C样品α-变形菌纲的相对物种丰度为30.20%,低于平均丰度12.33%;黄杆菌纲的相对物种丰度为18.92%,高于平均丰度8.00%;芽孢杆菌纲[11]相对物种丰度为7.54%,高于其他站位平均相对物种丰度2.23%。

注:1.变形菌门;2.拟杆菌门;3.放线菌门;4.蓝细菌门;5.厚壁菌门;6.海微菌门进化菌;7.其他。

注:1.α-变形杆菌纲;2.γ-变形杆菌纲;3.黄杆菌纲;4.微酸菌纲;5.β-变形杆菌纲;6.叶绿体;7.杆菌纲;8.蓝细菌纲;9.δ-变形杆菌纲;10.放线菌纲;11.未确认;12其他。图7同此。

对目水平(Order)物种丰度进行分析得出,平均相对物种丰度最高的5个目分别是红细菌目(Rhodobacterales)24.53%、黄杆菌目(Flavobacteriales)[12]10.92%、海洋螺菌目(Oceanospirillales)9.84%、SAR11_clade 9.58%、酸微菌目(Acidimicrobiales)[13]6.38%。A、B样品中酸微菌目分别为8.30%和7.71%,均高于平均相对物种丰度;B样品交替单胞菌目(Alteromonadales)相对物种丰度达到14.19%;C样品中黄杆菌目物种丰度18.92%高于平均相对物种丰度8.00%,SAR11_clade相对物种丰度4.42%低于平均相对物种丰度;D样品的SAR11_clade和嗜甲基菌目(Methylophilales)相对物种丰度分别为16.52%和5.13%,与平均相对物种丰度相比均有大幅上涨。微酸菌存在于酸性废矿水中,对环境具体有什么影响还有待进一步研究;黄杆菌对有机物有明显的分解作用,C站位出现黄杆菌,是微生物对环境适应性自然生物修复的表现。
对科水平(Family)物种丰度进行分析得出,样品中平均相对物种丰度最多的科分别是红螺菌科(Rhodobacteraceae)24.53%、Surface_1 8.96%、黄杆菌科(Flavobacteriaceae)8.51%和OM1_clade 4.71%。B样品中交替单胞菌科(Alteromonadaceae)相对物种丰度为8.93%,假单胞菌科(Pseudoalteromonadaceae)相对物种丰度为3.37%,远大于其他样品。C样品中黄杆菌科相对物种丰度为15.88%,比平均相对物种丰度高7.37%,Oceanospirllaceae和Planococcaceae相对物种丰度分别为6.75%和6.10%,也都远高于其他样品,但是Surface_1相对物种丰度很低,只有4.10%。D样本中Surface_1相对物种丰度突破15.50%,嗜甲基菌科(Methylophilales)的物种丰度达到5.13%,红螺菌科的物种丰度为3.99%,均高于其他样品丰度。E海水样品中Oceanospirllaceae的物种丰度有5.41%,弧菌科(Vibrionaceae)相对物种丰度6.62%,Cryomorphaceae相对物种丰度3.06%高于其他样品。
对属水平(Genus)物种丰度进行分析得出,55%以上的属还没有确定分类,每个样品中物种丰度最高属不一样,且差异较大。各样本中的第一优势属及其相对物种丰度分别为:A样本中Tateyamaria相对物种丰度为5.83%,B样本中假交替单胞菌属(Pseudoalteromonas)物种丰度为8.32%,C样本中动性球菌属(Planococcus)相对物种丰度为6.02%,D样本中OM43菌属相对物种丰度为5.13%,E样本中弧菌属(Vibrio)物种丰度为6.49%。
2.5 样品组间差异物种分析
对两两组合计算,R-value均介于(-1,1)之间,R-value大于0说明组间差异显著,R-value小于0代表组内差异大于组间差异。分析数据结果R-value均在(0,1)之间,说明组间差异显著,组内差异较小,5个海水样品中对组间差异影响较大的差异物种有显著差异,并且差异物种对组间差异影响的程度也有一定的差别。
2.6 罗源湾内环境因子结果分析
对海水样进行环境因子的检测,得出数据见表4,平均pH值为7.98、平均盐度为29.97、水体中溶解氧的平均值为6.76 mg/L、平均化学耗氧量为0.4%、亚硝酸盐-氮平均值为0.03 mg/L、硝酸盐-氮为0.41 mg/L及氨-氮为0.07 mg/L,B站位粪大肠菌群计数(FCB)最高。

表4 罗源湾海水样品环境因子测定结果
对照5个优势门的菌类进行环境因子相关性分析。图8显示变形菌门与pH呈正相关,与营养盐呈微弱正相关;拟杆菌门与溶解氧和盐度呈正相关;放线菌门与营养盐呈正相关,并随着硝氮和亚硝氮的升高而菌群丰度增加;蓝细菌门与pH和化学耗氧量呈正相关;厚壁菌门与pH、盐度、石油类均呈正相关。大多数细菌群落都同时受多种环境因子的影响,影响最明显的环境因子是pH和营养盐,例如,C样品中pH和盐度均高于平均值,拟杆菌门和厚壁菌门丰度均高于其他样品;B样品中亚硝酸盐-氮、硝酸盐-氮及氨-氮含量最高,物种遗传多样性丰度分析结果OTU值最高,由此可见pH和无机氮含量是影响罗源湾海湾细菌群落分布及多样性的主要环境因子。

注:1.蓝细菌门;2.变形菌门;3.放线菌门;4.拟杆菌门;5.厚壁菌门;6.酸碱度;7.化学耗氧量;8.硝酸盐氮;9.粪大肠菌群;10.氨氮;11.活性硅酸盐;12.亚硝酸盐氮;13.活性磷酸盐;14.溶解氧;15.悬浮物;16.石油类;17.盐度。
3 结论
2018年11月采集的罗源湾海湾5个站位的样品,通过宏基因组测定分析菌种结构多样性,菌群数目从大到小排列为B>A>D>E>C,即污水排放口>生活密集区>湾内远离污染地区>出海口>火电站排污口,A样品特有OTU数目91个,B样品特有OTU数64个,C样品特有OTU 数目有51个,D样品特有OTU数27个,E样品特有OTU数32个。结果表明A站位是生活密集区、B站位是污水排放口,水文环境富营养化明显,细菌种群数目相近且最多,细菌多样性最丰富。2016年罗源湾内已完成养殖全面清退,养殖业对水体的污染可以排除,但排污口及生活密集区内的人类活动形成的污染不容忽视;C站位火电厂污水排放虽然造成的生物复杂程度变化不明显,但黄杆菌和芽孢杆菌等丰度均高于其他站位,研究表明黄杆菌和芽孢杆菌对油类有分解作用[12,14],火电厂污水中含有的油类对其他微生物的生长呈现负相关关系,也解释了C站位的OTU数目低于其他站位的原因;D、E两点作为远离污染的区域,污染物对细菌多样性影响不大,群落较单纯。由此可见主要排污口和生活污水的排放是造成罗源湾海水富营养化的主要因素,火电站的排污口排放的油类使细菌多样性受到影响,菌群结构缺失。
在门(Phylum)水平对比得到5个优势门及其相对物种丰度分别为:变形菌门相对物种丰度为72.00%,拟杆菌门相对物种丰度为11.28%,放线菌门相对物种丰度为7.69%,蓝细菌门相对物种丰度为5.20%,厚壁菌门相对物种丰度为2.50%。对照5个优势门的菌类进行环境因子相关性分析,显示变形菌门与pH呈正相关,与营养盐呈微弱正相关;拟杆菌门与溶解氧和盐度呈正相关;放线菌门与营养盐呈正相关,并随着硝酸盐-氮和亚硝酸盐-氮的升高而菌群丰度增加;蓝细菌门与pH和化学耗氧量呈正相关,厚壁菌门与pH和盐度、石油类呈正相关。大多数细菌群落都同时受多种环境因子的影响,例如C样品中pH及盐度高于平均值,拟杆菌门和厚壁菌门丰度均高于其他样品;B样品中亚硝酸盐-氮、硝酸盐-氮及氨-氮含量最高,OTU值最高,由此可见pH和无机氮含量是影响罗源湾海湾细菌群落分布及多样性的主要环境因子。
综上所述,本论文总结如下:1)主要排污口和生活区的污水排放是造成罗源湾海水富营养化的主要因素,火电站的排污口排放的油类使细菌多样性受到影响,菌群结构缺失;2)pH和无机氮含量是影响罗源湾海湾微生物群落分布及多样性的主要环境因子。
4 展望
本文结合分子生物学和微生物学等学科对罗源湾的生态结构、菌群特点进行分析,研究罗源湾环境因子对细菌多样性的影响,为改善海洋生态系统平衡、稳定海洋生物能量转化奠定了基础。基于本文的研究结果,对以后的研究方向提出几点展望:1)本文只研究了冬季的罗源湾内细菌多样性,并只测定了当月的环境因子,对季节、洋流、藻类等造成的影响没有规划,之后的研究要结合时间跨度和其他特定条件进行细菌多样性的比较;2)继续研究沉积物中的细菌多样性,形成对比分析,更全面地了解该海湾的细菌菌群及生态系统结构。
