凡纳滨对虾传染性皮下及造血组织坏死病毒(IHHNV)可视化环介导等温扩增(LAMP)技术方法的优化与应用
2021-08-27吴建绍杨章武吴丽云杜秀萍林克冰林嘉铭
葛 辉 ,吴建绍,杨章武,吴丽云,张 哲,杜秀萍,洪 伟,林克冰,林 琪,林嘉铭,周 宸*
(1.福建省水产研究所,福建 厦门 361013;2.集美大学水产学院,福建 厦门 361021)
凡纳滨对虾(Litopenaeusvannamei),原产于厄瓜多尔和其他南美太平洋沿岸水域,俗称南美白对虾,是世界三大对虾养殖种类之一[1]。由于生长迅速、抗逆性强、可高密度养殖、盐度适应范围大,因此其养殖产量在世界对虾总产量中占有很大比例[2]。然而,随着集约化养殖的发展,养殖密度不断提高,对虾养殖环境不断恶化,导致对虾养殖业病害日益严重。疾病的暴发已成为阻碍对虾养殖业发展的主要因素之一[3]。
目前对虾养殖业中大约有20种不同的病毒,已造成大量的对虾死亡和严重的经济损失[4-5]。其中,传染性皮下及造血组织坏死病毒(Infectious hypodermal and hematopoietic necrosis virus,IHHNV)是虾的主要病原之一。IHHNV是一种无包膜二十面体的单链线性DNA病毒,也称细角滨对虾浓核病毒(Penaeusstylirostrisdensovirus,PstDNV)[6]。IHHNV自1981年在美国夏威夷地区的细角滨对虾(Penaeusstylirostris)中首次发现以来,迅速向世界各地传播,在北美、南美、美洲中部、加勒比等印度洋和太平洋的许多地区均有报道[7]。
IHHNV宿主种类繁多,包括凡纳滨对虾、斑节对虾(Penaeusmonodon)、日本沼虾(Macrobrachiumnipponensis)、罗氏沼虾(Macrobrachiumrosenbergii)、宽沟对虾(Penaeuslatisulcatus)等[8]。虽然该病毒感染凡纳滨对虾和斑节对虾后不会导致对虾的大量死亡,但该病毒对对虾仔虾的危害较大[9]。仔虾感染该病毒后,会出现生长缓慢,以及表皮崎形引起的触角鞭毛皱起、额剑弯曲、表皮粗糙或残缺、腹部甲壳病变、尾节弯曲,还有规格参差不齐等症状,称为慢性矮小残缺综合征(Runt-deformity syndrome,RDS),对养殖业造成较大的经济损失[10],因此,世界动物卫生组织(World Organisation for Animal Health,OIE)将IHHNV导致的传染性皮下及造血器官坏死病列为必须申报的甲壳类疾病之一[11]。
感染IHHNV的存活对虾将终生携带该病毒,并能通过受精卵将病毒垂直传播到下一代[12],或通过水平传播传递到其他个体[13]。因此,在还没有有效的防治措施来控制IHHNV感染的情况下,早检测早预防并控制疾病的传播显得尤为重要。
目前,动物疫病检测方法包括传统的形态学和生化方法、分离鉴定方法、免疫学方法、分子生物学方法、蛋白质指纹图谱分析方法等[14-15]。世界动物卫生组织(OIE)标准推荐的IHHNV检测方法是荧光实时定量PCR方法和常用PCR方法。基于PCR的检测方法灵敏、特异,但是需要昂贵的设备和相对复杂的步骤,耗时约2 h,在实际水产养殖中的应用明显不足。病原体的快速检测与鉴定需要一种真正简单和快速的现场检测方法。环介导等温核酸扩增技术(Loop-mediated isothermal amplification,LAMP)是日本研究人员Notomi等于2000年首次开发的一种在体外等温扩增特异核酸片段的新技术[16]。其基本原理是对靶基因的6个特异部位设计引物,利用具有链置换活性的BstDNA聚合酶在恒温条件下催化新链合成,从而使靶基因高效、快速、特异地扩增,不需要模板的热变性和长时间温度循环,对设备要求低[17-18]。这些优点使得它在流行性细菌或病毒的定性和定量检测等方面有着广泛的应用[19]。因此,本研究根据IHHNV病毒基因中的一段序列,采用Primer Explorer V4软件设计LAMP特异性引物组合,建立了一种IHHNV-LAMP检测技术,以期为养殖现场的快速检测IHHNV病毒提供快速高效的检测方法。
1 材料与方法
1.1 材料和试剂
凡纳滨对虾采自于漳浦县佛昙鸿达水产育苗场。IHHNV(传染性皮下及造血组织坏死病毒核酸)、NNV(神经坏死病毒核酸)、鱼核酸(斜带石斑鱼总核酸)、沙门氏菌、绿脓杆菌和柠檬酸杆菌等核酸均-80℃保存于本实验室。BstDNA聚合酶购自纽英伦(NEB)生物技术(北京)有限公司;pUC19载体购自宝生物工程(大连)有限公司;序列合成和DNA测序委托上海捷瑞生物工程有限公司完成;其余试剂为国产或进口分析纯。
1.2 传染性皮下及造血组织坏死病毒LAMP引物筛选
根据GenBank发布的IHHNV基因组序列及相关文献资料,选取高度保守序列区的一段序列,按照LAMP引物的设计原则,采用PrimerExplorer V4软件设计LAMP引物。共设计了5套引物,经筛选后选用其中一套共6条引物,选用的引物序列如表1所示。

表1 实验所用引物
1.3 LAMP反应体系
将IHHNV-2引物以IHHNV病毒的核酸和水为模板,在63℃下进行LAMP反应60 min,其中,各引物的用量分别为FIP(40 μmol/L)、BIP(40 μmol/L)各1.0 μL,F3(5 μmol/L)、B3(5 μmol/L)各1.0 μL,环引物(20 μmol/L)1.0 μL;以NNV的总RNA为模板的反应体系中添加逆转录酶1.0 μL,反应结束后,通过观察扩增曲线分析扩增结果。其中,引物扩增体系如表2所示。
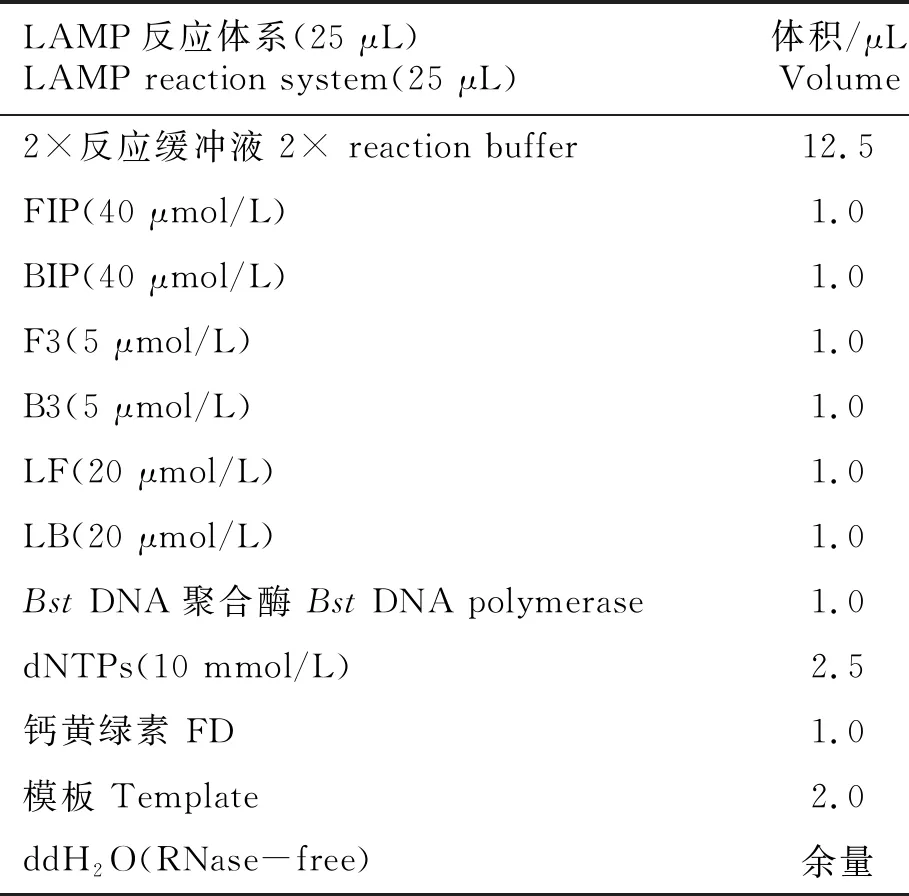
表2 IHHNV-LAMP扩增引物的筛选体系
1.4 传染性皮下及造血组织坏死病毒阳性质粒的构建及质量检测
根据GenBank数据库公布的IHNNV病毒基因,委托上海捷瑞生物工程有限公司合成该病毒的部分核酸序列。将该合成的核酸序列与克隆载体PUC19连接,转化至E.coliDH5α感受态细胞。细胞涂布在含有100 μg/mL氨苄青霉素的LB固体培养平板上。从平板挑选40个单菌落进行菌落PCR鉴定重组子(PUC19-IHNNV),产物经由1.2%琼脂糖凝胶电泳检测后,交由上海捷瑞生物工程有限公司测序,鉴定重组质粒PUC19-IHNNV中的插入序列。
IHHNV-2引物分别以IHHNV病毒核酸、PUC19-IHHNV和水为模板,进行LAMP反应,在63℃下进行LAMP反应60 min。同时IHHNV-2引物分别以PUC19-IHHNV和稀释100倍的PUC19-IHHNV模板,进行LAMP反应,每组做2个平行,以检测质粒稀释前后质量。
1.5 传染性皮下及造血组织坏死病毒引物特异性实验
采用筛选后的引物组,分别以IHHNV(传染性皮下及造血组织坏死病毒核酸)、NNV(神经坏死病毒核酸)、鱼核酸(斜带石斑鱼总核酸)、沙门氏菌、绿脓杆菌和柠檬酸杆菌等核酸为模板,在63℃下进行LAMP反应60 min,以检测本研究建立的IHHNV-LAMP检测方法的特异性。反应结束后,通过观察扩增曲线分析扩增结果。
1.6 传染性皮下及造血组织坏死病毒引物灵敏度检测
用浓度为315 ng/μL(5.29×1010copies/μL)的IHHNV病毒阳性质粒为实验模板,按10倍梯度稀释,做灵敏度实验。
采用筛选后的引物组,分别以浓度为3.15 ng/μL(5.29×108copies/μL)、315 pg/μL(5.29×107copies/μL)、31.5 pg/μL(5.29×106copies/μL)、3.15 pg/μL(5.29×105copies/μL)、315 fg/μL(5.29×104copies/μL)、31.5 fg/μL(5.29×103copies/μL)、3.15 fg/μL(529 copies/μL)、315 ag/μL(52.9 copies/μL)、31.5 ag/μL(5.29 copies/μL)、3.15 ag/μL(0.529 copies/μL)的IHHNV病毒阳性质粒作为模板;每个体系中加入2 μL模板,水作为阴性对照组,在63℃下进行LAMP反应60 min,反应结束后,通过观察扩增曲线分析扩增结果。
1.7 不同IHHNV检测方法的灵敏度比较分析
为确定本研究建立的IHHNV-LAMP检测方法的灵敏度,以构建的pUC19-IHHNV质粒,用QuantusTMFluorometer测定1∶100稀释的pUC19-IHHNV质粒浓度。根据计算的拷贝数梯度稀释质粒,使稀释倍数分别为1×103、1×104、1×105、1×106、1×107、1×108和1×109倍。按OIE推荐的普通PCR、qPCR的要求进行扩增反应。普通PCR、qPCR的扩增产物均进行琼脂糖凝胶电泳分析。
根据如下公式计算1∶100稀释pUC19-IHHNV质粒的拷贝数:
质粒拷贝数/μL=
(1)
2 结果与分析
2.1 传染性皮下及造血组织坏死病毒LAMP引物筛选
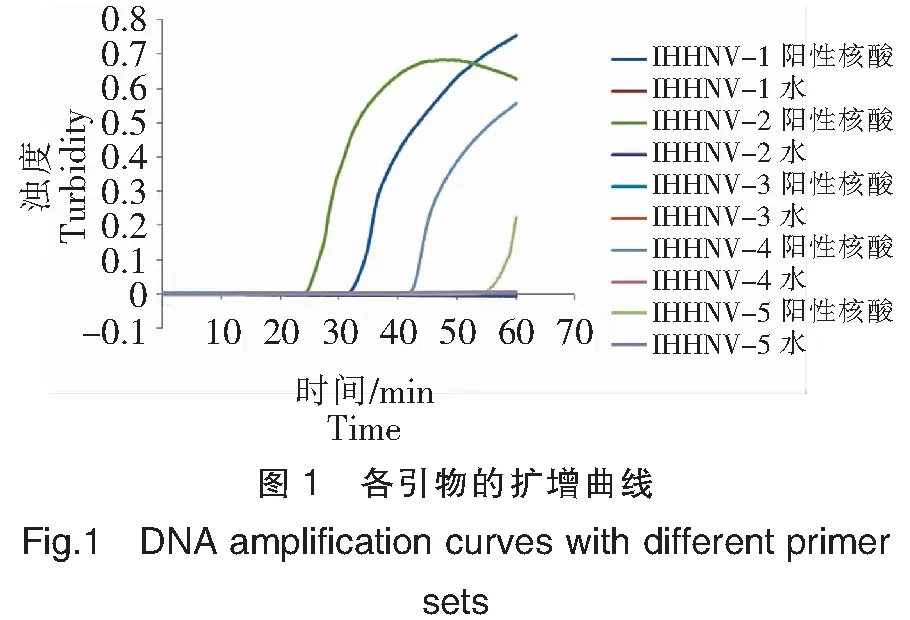
结果显示引物IHHNV-1能够在33 min左右将阳性核酸扩增出来,引物IHHNV-2能够在25 min左右将阳性核酸扩增出来,引物IHHNV-4能够在43 min左右将阳性核酸扩增出来,所以含有环引物的IHHNV-1、IHHNV-2、IHHNV-4引物初步能够使用,待后续继续验证;本实验中,取IHHNV-2为实验引物。引物IHHNV-3在60 min内不能扩增出阳性核酸,引物IHHNV-5虽然能够在55 min左右将阳性核酸扩增出来,但时间太长,因此IHHNV-3、IHHNV-5均舍弃。
2.2 传染性皮下及造血组织坏死病毒引物特异性实验
实验结果如图2和图3所示,只有IHHNV病毒的核酸出现扩增,其他对照病毒、细菌和水均未检测出扩增结果,显色结果与曲线图一致。这说明建立的以IHHNV-2为引物的IHHNV-LAMP检测方法具有良好的特异性。
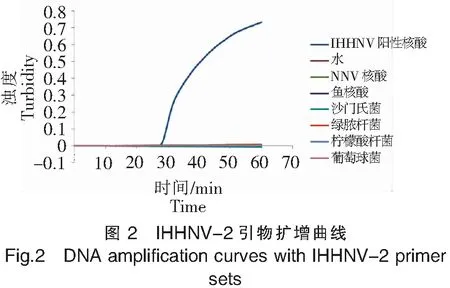
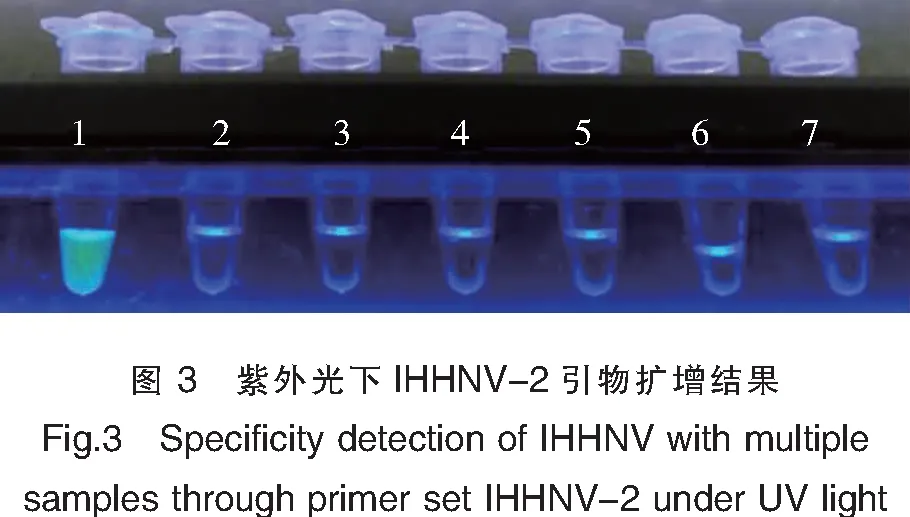
注:1.IHHNV阳性核酸;2.水;3.NNV核酸;4.鱼核酸;5.沙门杆菌;6.绿脓杆菌;7.柠檬酸杆菌。
2.3 传染性皮下及造血组织坏死病毒引物灵敏度检测
2.3.1 重组质粒pUC19-IHHNV的质量检测
引物在检测时,质粒均在10~16 min出现扩增,比提取的IHHNV病毒核酸(36~40 min)扩增速度快,这说明本研究制备的IHHNV病毒阳性质粒优良,符合实验要求。稀释100倍的IHHNV病毒阳性质粒与未稀释的质粒原液均在16 min左右出现扩增,这说明本实验制备的IHHNV病毒阳性质粒符合实验要求。

2.3.2 IHHNV-2灵敏度检测实验
用浓度为315 ng/μL(5.29×1010copies/μL)的PUC19-IHHNV质粒为实验模板,依次10倍梯度稀释,做灵敏度实验。第一孔浓度为3.15 ng/μL,每管加入2 μL,以此类推。
引物IHHNV-2的灵敏度检测的实验结果如图5和图6所示:IHHNV病毒阳性质粒含量在63 ag~6.3 ng均能检测到扩增,阴性对照未见扩增,可见IHHNV-2引物组的最低检测限为63 ag,约10.3 copies。
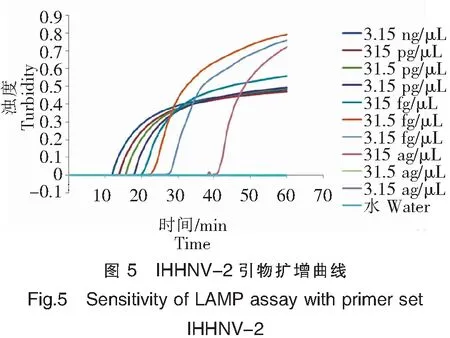
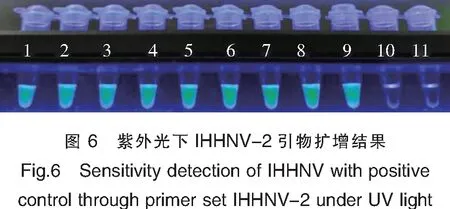
注:1为3.15 ng/μL;2:315 pg/μL;3:31.5 pg/μL;4:3.15 pg/μL;5:315 fg/μL;6:31.5 fg/μL;7:3.15 fg/μL 8:315 ag/μL;9:31.5 ag/μL;10:3.15 ag/μL;11:水。
2.3.3 不同IHHNV检测方法的灵敏度比较
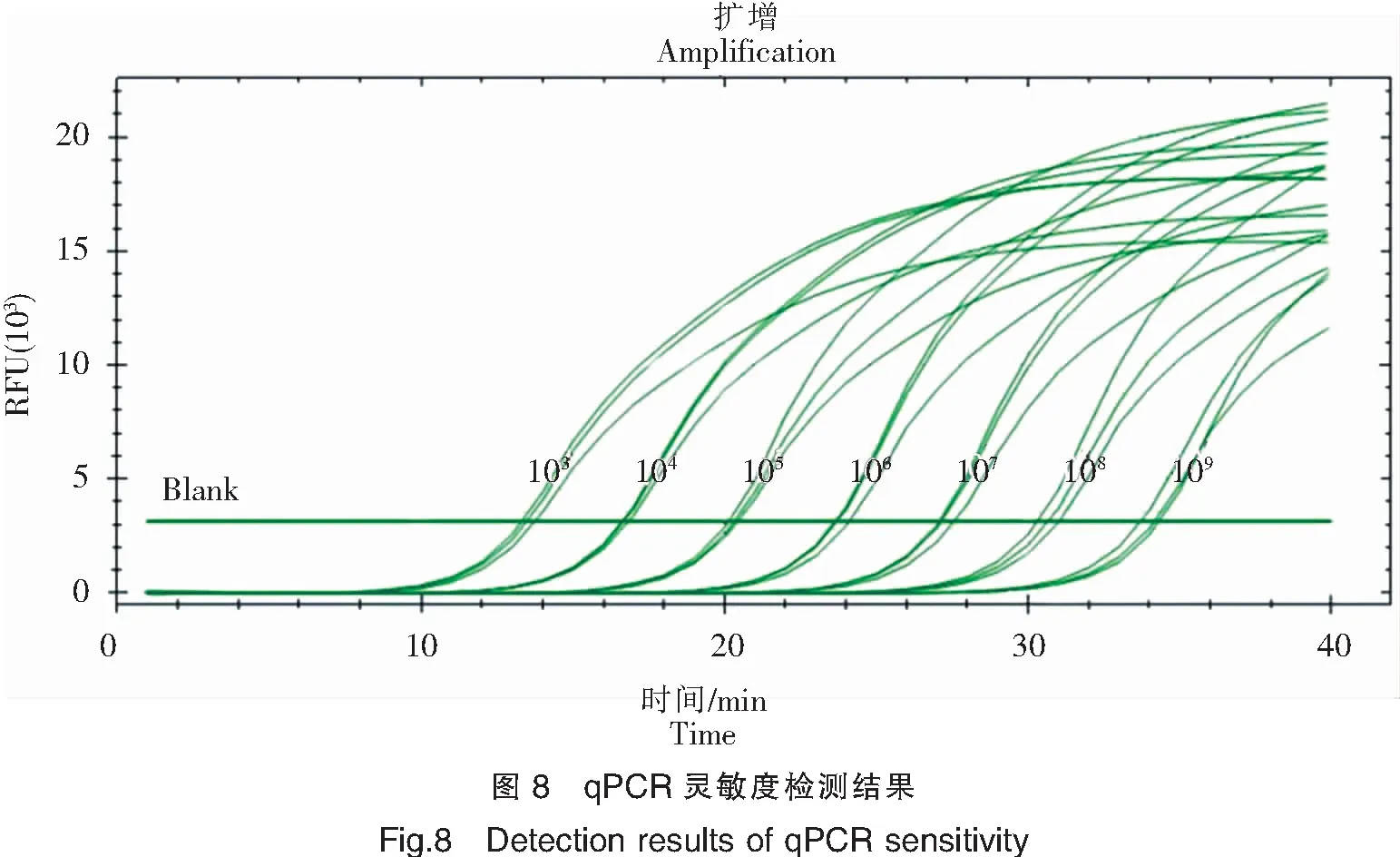
用1∶100稀释的pUC19-IHHNV质粒进行后续梯度稀释,使稀释倍数分别为1×103、1×104、1×105、1×106、1×107、1×108和1×109倍,拷贝数分别为5.04×107copies/μL、5.04×106copies/μL、5.04×105copies/μL、5.04×104copies/μL、5.04×103copies/μL、5.04×102copies/μL、5.04×101copies/μL。梯度稀释后进行qPCR和普通PCR的产物电泳结果对比如图7所示。qPCR至少可检测到的稀释度为109,又因为使用了8 μL质粒,则拷贝数为50.4 copies×8=403.2 copies。同样的,PCR至少可检测到稀释度为109,拷贝数为403.2 copies。而从qPCR Cq值数据上分析,理论可检测到的拷贝数至少为7.84 copies。
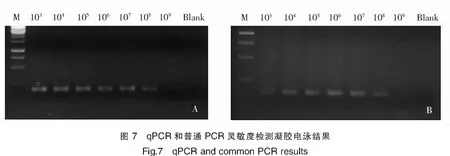
注:A为qPCR;B为普通PCR;M为DNA marker。
3 讨论
目前暂无有效的治疗对虾病毒病的手段,对虾病毒病的防治与控制是一个复杂且系统性的工程,涉及到虾池的消毒杀菌、投饲、使用药物增强防病能力、药物治疗等诸多方面。近几年来随着检测技术的发展以及病毒的研究,IHHNV的检测技术也越来越成熟且多样化,其中主要包括普通PCR方法、qPCR方法、环介导等温扩增技术(LAMP)、组织病理学切片等[20-21]。而在现场的检测中,要选择最适合且便捷的检测方法,才能在实际运用中得到更好的结果。
目前国内外对虾IHHNV最常用的检测方法是聚合酶链式反应(PCR),需要复杂的操作步骤和条件,以及昂贵的仪器,而LAMP反应仅在恒温条件下便可进行,只需具有稳定热源的装置即可,极大地降低了操作难度和仪器成本,更加有利于现场快速检测。
环介导等温扩增技术(LAMP),最初在2000年由日本研究人员Notomi发明。该技术可结合特定的荧光染料从而出现肉眼可见的显色反应,检测人员可以根据颜色的变化来得出结果。因此,LAMP方法已被成功用于多种病毒、真菌、细菌等病原的分子生物学检测和诊断,甚至在性别鉴定、各种疫病、食品安全的检测中也得到应用[14,21-22]。LAMP技术本身也在改进和提高,并与其他技术合并应用,如荧光LAMP技术[23]、Stem Primers在LAMP中的应用[24]、横向流动试纸条检测方法(LFD)[25]、限制性内切酶片段长度多态性分型研究[26]等。由此可见,LAMP方法得到了众多科研人员的认可。而在其他辅助条件下,LAMP方法将有更多更广泛的应用。本研究开发的IHHNV-LAMP检测方法是一种适用于现场快速检测的非常有前途的检测方法。
本研究对GenBank收录的IHHNV基因组序列进行比对并选取高度保守序列区的一段约1 447 bp的序列。针对该序列设计6条引物,其中包括1对环引物,从而把反应时间缩短到30 min以内,并以此判别阴阳性。与普通PCR相比,本研究在恒温热水浴即可完成操作,不需要对模板进行热变性处理,节省了因温度循环而消耗的时间,对仪器依赖性小。在63℃下进行25~33 min的LAMP检测,比李红梅等的快[23]。很多报道中曾提到过,使用PCR诊断IHHNV经常有假阳性结果的出现,原因主要是IHHNV的部分序列插入到宿主对虾的基因组中。在本研究中以水、石斑鱼核酸、NNV病毒等6种核酸为模板,均未检测到任何IHHNV的扩增,表明本方法能够满足检测需求,也说明了本研究所选择的检测序列片段合理。目前为止,对IHHNV的检测已应用了多种技术,其中灵敏度相对较高的技术都是基于PCR的扩增技术,包括传统的PCR技术和qPCR技术。为了验证IHHNV-LAMP检测体系的检测性能,笔者又构建了普通PCR-IHHNV和qPCR-IHHNV检测体系。将三者进行比较。结果显示,三个体系都显示出了很优越的检测性能。但是,IHHNV-LAMP检测体系的灵敏度和特异性优于普通PCR-IHHNV检测技术;其次反应由于借助了从dNTPs中解离出的焦磷酸根离子与反应溶液中的镁离子结合,产生副产物焦磷酸镁沉淀,用肉眼即可观察到反应结果,借助浊度仪可获得精确的结果;并且本体系在反应体系中添加了钙黄绿素,有核酸扩增的反应产物在紫外光下可观察到黄绿色荧光,不需要复杂的加热系统和成像系统;仅需在63℃、25 min内就可得出肉眼检测结果,更适合于养殖现场的实地诊断。
综上所述,本研究基于GenBank收录的IHHNV基因组序列所建立的LAMP检测方法,不仅操作简单,反应速度快,特异性好,灵敏度高,成本低廉,而且可以直观地观察反应的进行情况,可用于实验室快速分析,也适用于对虾养殖现场的诊断。
