低强度交变电磁场对于丙泊酚诱发老年大鼠认知功能衰退的治疗作用研究
2021-08-27刘文雄
高 敏,刘文雄
(西安市西电集团医院麻醉科,西安710077)
0 引言
丙泊酚是临床上最为常用的麻醉剂之一,其主要通过激活γ-氨基丁酸受体氯离子通道复合物发挥镇静催眠作用。丙泊酚被广泛用于重症监护病房危重患者的麻醉诱导、麻醉维持和镇静[1]。丙泊酚具有起效快、诱导平稳、恢复快、功能恢复完全、术后恶心呕吐发生率低等优点[2]。然而,患者经丙泊酚麻醉后也常发生认知功能障碍[3],该现象尤其在中老年的手术患者中更为常见且严重[4-5]。低强度交变电磁场(electromagnetic fields,EMF)治疗作为一种经济、安全、无创的物理因子作用手段,已得到广泛的临床应用[6]。已有研究表明,低强度交变EMF对于生物体的认知功能具有明显的改善作用[7-8]。目前,有关应用低强度交变EMF减轻麻醉后认知功能障碍研究的报道较少。本研究探讨低强度交变EMF对于麻醉后大鼠认知功能恢复的影响并探究其可能的作用机制。
1 材料与方法
1.1 仪器和试剂
Morris水迷宫,上海移数信息科技有限公司;电磁场刺激装置及实验大鼠有机玻璃笼(电磁场研究专用),课题组自制;高精度病理切片机(RM 2016),德国徕卡公司;激光扫描共聚焦显微镜(FV1200),日本奥林巴斯公司;双垂直电泳仪(DYCZ-24DN),北京六一仪器厂;酶标检测仪(Rt2100c),美国Rayto公司;凝胶成像系统(Gel Doc XR+),美国Bio-Rad公司;半干转膜仪(Trans-Blot SD System),美国Bio-Rad公司;丙泊酚注射液,西安立邦制药有限公司;ELISA试剂盒,武汉华美生物公司;B淋巴细胞瘤-2(Bcl-2)、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)和甘油醛-3-磷酸脱氢酶(GAPDH)抗体,美国Abcam公司;戊巴比妥钠,美国Sigma公司;脱氧核糖核酸转移酶介导的缺口末端标记法(TdT-me-diated dUTP nick end labeling,TUNEL)凋亡荧光检测试剂盒,美国Abcam公司。
1.2 实验动物与实验分组
将36只清洁级健康Sprague-Dawley大鼠(20月龄,雄性,体质量400~420 g,购于成都达硕实验动物有限公司)随机分为对照组、丙泊酚组和丙泊酚+EMF组,每组12只。对照组于第1天腹腔注射生理盐水(5 mL/d),丙泊酚组和丙泊酚+EMF组腹腔注射丙泊酚,首次注射剂量为60 mg/kg,随后每小时注射1次(第二次及以后的注射剂量为首次剂量的一半,即30 mg/kg),共注射6次,即可维持麻醉状态6 h。每次麻醉后大鼠立即平卧在自制的吸氧箱上,以5 L/min的流量持续供氧,待翻正反射恢复后,将大鼠从吸氧箱中取出。除实验时间外,大鼠可以自由进食和饮水。丙泊酚+EMF组大鼠每天进行6 h的全身性EMF暴露,治疗第7天结束。本研究严格按照美国国立卫生研究院实验室动物护理和使用指南中的建议进行。
1.3 低强度交变EMF治疗装置
低频、低强度电磁场治疗系统由电磁场发生模块和Helmholtz线圈输出模块构成。电磁场发生模块由MSP430单片机作为控制核心,输出产生频率、强度线性可调的低强度正弦交变电磁信号,该信号经过系统内部整合的信号调制、整合、滤波、放大处理后,将电流输出至Helmholtz线圈模块中。Helmholtz线圈模块中包含有2个直径相同(40 cm)且等轴放置的线圈组,线圈匝数为100,线圈间距为20 cm。实验所产生的交变电磁场峰值强度为5 mT,频率为50 Hz。实验过程中确保大鼠实验笼底部与线圈中轴线在一个平面上,以保证电磁场分布的均匀稳定。
1.4 学习记忆功能测试
治疗结束后,采用Morris水迷宫测试3组大鼠的学习记忆功能。实验前,将平台放置在水迷宫东北象限的中心,高度在水面以下2 cm处。在用于水迷宫实验的水池里加入适量的墨水,使大鼠无法分辨平台。在用于水迷宫实验的水池的墙上挂着几个物体作为参考。将水温加热至24~26℃,进行定位导航试验5 d。每天分为2个时段,每时段进行4次训练。在4次训练中,将大鼠分别置于不同象限的水中。用秒表记录大鼠找到平台前的持续时间(逃逸潜伏期)。2次训练间隔1 min。第5天下午进行探索实验。平台被移走,所有大鼠被从西南象限放入水中,使用Morris水迷宫系统自带的摄像机和分析软件记录和量化大鼠在水迷宫中2 min内的游动路径的距离(游泳距离)和穿越平台次数。
1.5 血清淀粉样β蛋白(Aβ)和神经元特异性烯醇化酶(NSE)检测
水迷宫实验结束后,使用过量戊巴比妥钠(100 mg/kg)腹腔注射麻醉,腹主动脉取血3 mL,以3 000 r/min离心5 min,-20℃保存血清。采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测血清Aβ和NSE的表达水平。该过程严格按照试剂盒中的说明标注的操作步骤进行。
1.6 海马组织神经营养因子的检测
大鼠开颅后取脑取、海马组织。将海马组织等分为3份,分别用于ELISA、组织切片染色和蛋白质印迹法检测。用生理盐水(1∶10)快速制备匀浆,3 000 r/min离心10 min,获得上清液。采用ELISA法检测神经生长因子(NGF)和脑源性神经营养因子(BDNF)的表达水平。该过程严格按照试剂盒中的说明标注的操作步骤进行。
1.7 海马组织TUNEL荧光染色
对提取的大鼠海马组织先进行4%多聚甲醛固定,再进行石蜡包埋,包埋后利用高精度病理切片机进行组织切片,然后使用二甲苯和梯度酒精脱蜡。脱蜡后用TUNEL工作液孵育组织切片(37℃避光1 h),随后进行4',6-二脒基-2-苯基吲哚二盐酸盐(4',6-diamidino-2-phenylindole,DAPI)复染细胞核(37℃避光1 h),最后对样本进行封片,封片后在激光扫描共聚焦显微镜下进行图像采集和分析。
1.8 海马组织凋亡因子的蛋白质印迹法检测
先将海马组织在玻璃研磨机中研磨成分散的细胞,随后向样本中加入1 mL细胞裂解液保持30 min,然后以2 000 r/min离心5 min,获得上清液,使用二喹啉甲酸法(bicinchoninic acid,BCA)对蛋白表达水平进行定量检测。随后以4∶1的比例上样,煮沸后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE),转膜及封闭后,分别使用抗凋亡基因Bcl-2和凋亡标志物Caspase-3的一抗进行过夜孵育,充分漂洗后随后孵育二抗,最后进行显影和半定量分析。GAPDH抗体作为内参照物。
1.9 统计学分析
采用SPSS 20.0软件进行统计分析。数据以x¯±s表示,3组的全部实验数据采用单因素方差分析与Benferoni post-hoc检验结合法进行分析比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 低强度交变EMF治疗对于丙泊酚诱发的认知功能障碍大鼠学习记忆能力的影响
通过水迷宫实验检测3组大鼠学习记忆能力的实验结果比较见表1。丙泊酚组大鼠的逃逸潜伏期和游泳距离均显著高于对照组(P<0.05),而穿越平台次数显著低于对照组(P<0.05);与丙泊酚组相比,丙泊酚+EMF组大鼠的逃逸潜伏期和游泳距离显著减少(P<0.05),而穿越平台次数显著增加(P<0.05)。对照组与丙泊酚+EMF组大鼠在逃逸潜伏期、游泳距离和穿越平台次数上均无统计学差异(P>0.05)。
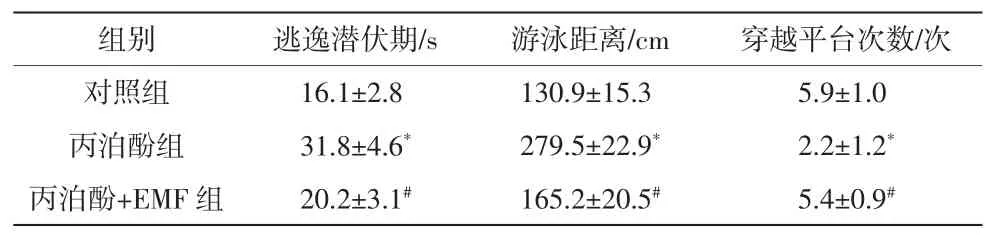
表1 3组大鼠学习记忆能力的实验结果比较
2.2 低强度交变EMF治疗对于丙泊酚诱发的认知功能障碍大鼠血清Aβ和NSE表达水平的影响
通过ELISA法检测得到的3组大鼠血清Aβ和NSE表达水平的实验结果比较见表2。丙泊酚组大鼠的血清Aβ、NSE表达水平均显著高于对照组(P<0.05);相比于丙泊酚组,丙泊酚+EMF组大鼠的血清Aβ、NSE的表达水平均显著降低(P<0.05)。对照组与丙泊酚+EMF组大鼠的血清Aβ、NSE表达水平比较均无统计学差异(P>0.05)。

表2 3组大鼠血清Aβ和NSE表达水平的实验结果比较
2.3 低强度交变EMF治疗对于丙泊酚诱发的认知功能障碍大鼠海马组织中NGF和BDNF表达水平的影响
通过ELISA法检测得到的3组大鼠海马组织中NGF和BDNF表达水平的实验结果比较见表3。与对照组相比,丙泊酚组大鼠海马组织中NGF和BDNF的表达水平均显著降低(P<0.05);而丙泊酚+EMF组大鼠海马组织中NGF和BDNF的表达水平均显著高于丙泊酚组大鼠(P<0.05)。对照组与丙泊酚+EMF组大鼠海马组织中的NGF和BDNF表达水平比较均无统计学差异(P>0.05)。

表3 3组大鼠海马组织中NGF和BDNF表达水平的实验结果比较
2.4 低强度交变EMF治疗对于丙泊酚诱发的认知功能障碍大鼠海马组织细胞凋亡的影响
基于TUNEL免疫荧光染色对3组实验大鼠海马组织细胞凋亡情况的检测结果如图1所示。与对照组相比,丙泊酚组大鼠海马组织中细胞的凋亡数量明显增加;而丙泊酚+EMF组大鼠海马组织中细胞的凋亡数量显著少于丙泊酚组大鼠。通过蛋白质印迹法对3组大鼠海马组织细胞凋亡标志物的检测结果如图2所示。丙泊酚组大鼠海马组织中的抗凋亡因子Bcl-2的表达水平显著低于对照组(P<0.05),而凋亡标记物Caspase-3的表达水平显著高于对照组(P<0.05);与丙泊酚组相比,丙泊酚+EMF组大鼠海马组织中的Bcl-2表达水平显著升高(P<0.05),而Caspase-3表达水平显著降低(P<0.05)。对照组与丙泊酚+EMF组大鼠海马组织中的Bcl-2和Caspase-3表达水平比较无统计学差异(P>0.05)。

图1 基于TUNEL免疫荧光染色评价3组实验大鼠海马组织细胞凋亡情况(图中比例尺为50μm)

图2 基于蛋白质印迹法对3组大鼠海马组织细胞凋亡标志物的检测结果
3 讨论
作为一种无创、经济、安全的物理因子干预方法,低强度交变EMF已广泛应用于骨骼肌和软组织损伤修复、疼痛缓解、炎症抑制等临床治疗[9]。近年来,低强度交变EMF对神经系统的调控作用也得到了研究者们的广泛关注[10-12],有新的证据支持低强度交变EMF在治疗包括痴呆症在内的各种神经疾病方面的生物学效应[11]。而低强度交变EMF对于认知功能的积极作用效果也有一系列的文献报道[13-14]。学者们通过大量的行为研究发现了低强度交变EMF可以影响人类和动物的认知和记忆功能[7-8]。但是,低强度交变EMF是否能够对麻醉后认知功能障碍产生积极的作用效果,目前国内外尚未见研究报道。
丙泊酚是临床上应用最广泛的静脉麻醉剂之一,该药具有疗效快、作用时间短、清除快、不良反应少等优点,具有重要的应用价值。然而,已有研究证实丙泊酚抑制海马的长期增强,而海马是记忆和学习的基础[15]。此外,丙泊酚还可以影响人脑中的许多正常神经递质,这可能导致患者术后认知功能障碍。而研究也发现,丙泊酚对于儿童和老年人的认知功能损伤更为明显[16]。本研究中,水迷宫实验结果显示,经丙泊酚麻醉的大鼠逃逸潜伏期和游泳距离显著升高,而穿越平台次数显著降低,提示经过6 h丙泊酚注射的大鼠在7 d后的学习认知能力显著降低,提示丙泊酚诱发的老年性认知损伤模型构建成功。而本研究也发现,6 h/d的低强度交变EMF治疗能够显著减少大鼠逃逸潜伏期和游泳距离,并增加其穿越平台的次数,提示丙泊酚麻醉剂应用后进行低强度交变EMF干预能够改善老年大鼠的学习认知功能。
血清Aβ是神经系统损伤和持续炎症反应的潜在标志之一。学者们的研究发现,麻醉所诱发的认知功能障碍与血清Aβ的表达有关[17]。而血清Aβ浓度的变化可间接反映蛋白印迹法Aβ在脑组织中的聚集情况。NSE是糖酵解过程中烯醇化酶的一种同工酶,它在神经元和神经内分泌细胞中特异性分布,是神经元的特异性标记物[18]。正常情况下,脑脊液和血清中有少量NSE;当患者发生脑缺血、缺氧、中毒或外伤时,神经细胞膜完整性受损,血脑屏障通透性增加,NSE蛋白渗漏到血清或脑脊液中,导致含量增加[19]。本研究结果表明,与对照组相比,丙泊酚组大鼠血清Aβ和NSE表达水平显著升高;而与丙泊酚组比较,丙泊酚+EMF组大鼠血清Aβ和NSE表达水平均显著降低。提示低强度交变EMF治疗缓解麻醉后认知功能障碍的机制可能与其降低体内血清Aβ和NSE表达水平有关。
神经营养因子是在神经组织中发挥特殊作用的小分子多肽因子,其能促进中枢神经系统发育过程中神经细胞的增殖、生长、分化和存活,调节突触的可塑性。NGF和BDNF是最重要的神经营养因子。NGF与特定的TrkA受体结合,激活细胞代谢,进而促进神经细胞的增殖和分化,调节中枢和外周神经细胞的存活和轴突的生长,从而在神经细胞损伤的修复中起着非常重要的作用[20]。BDNF通过结合其特异性高亲和力受体TrkB发挥神经营养作用。研究发现,NGF和BDNF在改善认知功能方面起着重要作用,它们能提高阿尔茨海默病大鼠的学习记忆能力,促进神经元生长[21]。本研究发现,丙泊酚诱发大鼠海马组织中NGF和BDNF表达水平显著降低,而低强度交变EMF治疗能够有效提升丙泊酚注射大鼠海马组织中NGF和BDNF的表达水平,提示低强度交变EMF对于丙泊酚诱发的认知功能障碍的改善效应与海马组织中增加的NGF和BDNF表达水平相关。
海马组织中细胞凋亡的增加是造成认知功能损伤的关键因素[22]。而Bcl-2能够抑制线粒体中的细胞色素C的释放,阻断其下游的信号级联反应,抑制Caspase-3的活化,从而抑制细胞凋亡。本研究TUNEL染色结果发现,丙泊酚组大鼠海马组织中凋亡显著高于对照组;而蛋白质印迹法检测结果进一步揭示丙泊酚大鼠海马组织中的Bcl-2表达水平显著降低而Caspase-3表达水平显著升高,进一步证实了丙泊酚能够诱导海马组织的细胞凋亡,这与前人的研究结果一致[23]。本研究结果进一步发现,低强度交变EMF治疗能够显著降低丙泊酚注射的大鼠海马组织中凋亡细胞的数量,并且其也能够显著提升丙泊酚大鼠海马组织中Bcl-2的表达水平并抑制Caspase-3蛋白表达。本研究结果表明,低强度交变EMF治疗能够显著缓解丙泊酚诱发的认知功能障碍大鼠海马组织的细胞凋亡。
综上所述,本研究发现低强度交变EMF治疗能够显著改善丙泊酚诱发的大鼠认知功能障碍,其机制可能与其对细胞凋亡的调控、血清Aβ和NSE表达水平的降低以及NGF和BDNF的表达水平升高有关。后续的实验将主要关注对于低强度交变EMF治疗调节认知功能障碍窗口参数的探讨,并通过体外及在体基因沉默技术进一步揭示低强度交变EMF改善认知功能障碍的分子信号机制。
