COPD合并呼吸衰竭患者血清HMGB1、IL-27水平变化及其与预后的关系
2021-08-26甘庆唐勇
甘庆,唐勇
(成都市第二人民医院急诊科,四川 成都 610000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)为呼吸道慢性非特异性炎症,随病程进展可导致进行性呼吸道气流受限和肺功能障碍,引起呼吸衰竭[1]。COPD患者发生呼吸衰竭的主要原因包括机体缺氧、慢性炎症及营养不良等,多种炎症细胞和介质在其中发挥着重要作用[2]。高迁移率族蛋白B1(high mobility group box 1,HMGB1)是广泛分布于真核细胞的非组蛋白,通过调控基因转录和翻译发挥多种生物学功能[3]。HMGB1介导的炎症信号通路可参与COPD患者病情进展并增加患者的死亡风险[4]。白细胞介素27(interleukin-27,IL-27)为IL-6/IL-12家族成员,具有促炎和抗炎双重调节作用,在COPD患者中其表达水平可明显升高并影响疾病进展[5]。本研究拟探讨HMGB1和IL-27在COPD合并呼吸衰竭患者中的表达水平及其与预后的关系。
1 资料与方法
1.1 一般资料
选取2018年6月至2020年6月成都市第二人民医院收治的102例COPD合并呼吸衰竭患者为研究对象(COPD合并呼衰组)进行横断面研究。其中男性53例,女性49例;年龄47~82岁,平均(67.04±9.15)岁;体重指数(BMI)平均(23.19±3.46)kg/m2;COPD病程平均(12.76±3.05)年。纳入标准:(1)符合COPD临床诊断[8];(2)静息状态下动脉血氧分压(PaO2)<60 mmHg,伴或不伴动脉血二氧化碳分压(PaCO2)>50 mmHg;(3)患者意识清醒并能配合完成相关检查;(4)患者及家属签署知情同意书。排除标准:(1)伴红斑狼疮等系统性疾病;(2)伴心肾等重要器官功能不全;(3)伴感染、肿瘤或结核等其它肺部疾病;(4)伴呼吸系统手术或外伤病史;(5)伴精神疾病或认知功能障碍;(6)伴其它影响患者预后的病变。另选取同期100例COPD患者(COPD组)和100名健康体检者(健康对照组)进行对照研究,其中COPD患者纳入和排除标准同前,并排除合并呼吸衰竭者。
1.2 研究方法
采用Cobasb 123型全自动血气分析仪(瑞士罗氏公司)检测PaO2和PaCO2。采集三组晨起空腹肘静脉血5 mL,室温静置20 min后以3 000 rpm离心10 min,并取上清液冷冻保存。采用酶联免疫吸附测定(ELISA)法(美国R&D公司)检测HMGB1和IL-27水平,比较三组各项检查结果。COPD患者按《慢性阻塞性肺疾病诊治指南(2013年修订版)》[6]给予化痰、吸氧以及抗感染等对症支持治疗。随访COPD合并呼吸衰竭患者28 d死亡率,并根据结果将患者分为存活组和死亡组进行对比分析;比较两组血清HMGB1和IL-27水平,分析其与患者动脉血气指标的相关性;同时探讨两者对COPD合并呼吸衰竭患者28 d死亡率的预测价值。
1.3 统计学分析
采用了SPSS 22.0软件进行统计分析。计数资料组间比较采用χ2检验;计量资料,多组间比较采用单因素方差分析,两组比较采用独立样本t检验,采用Pearson积差进行相关性分析,作受试者工作特征曲线(ROC)并计算曲线下面积(AUC)分析血清HMGB1和IL-27水平对COPD合并呼吸衰竭预后诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 三组临床基本资料比较
三组性别、年龄、BMI及个人史等基本资料比较,差异无统计学意义(P>0.05)。见表1。
表1 三组临床基本资料比较
2.2 三组血清检测结果比较
三组血清HMGB1、IL-27和CRP水平及外周血单核细胞计数比较,差异有统计学意义(P<0.05);COPD合并呼衰组和COPD组HMGB1、IL-27和CRP及外周血单核细胞计数高于对照组,且COPD合并呼衰组高于COPD组,差异有统计学意义(P<0.05)。见表2。
表2 三组血清检测结果比较
2.3 COPD合并呼衰组患者存活组和死亡组的各项检查结果比较
COPD合并呼吸衰竭组患者28 d死亡29例(28.43%),死亡组PaO2低于存活组,但PaCO2和血清HMGB1、IL-27和CRP水平及外周血单核细胞计数高于存活组,差异有统计学意义(P<0.05)。见表3。
表3 COPD合并呼吸衰竭组患者存活组和死亡组各项检查结果比较
2.4 HMGB1和IL-27与动脉血气指标的相关性分析
COPD合并呼吸衰竭患者血清HMGB1和IL-27水平与PaO2呈负相关(P<0.05)。见表4。
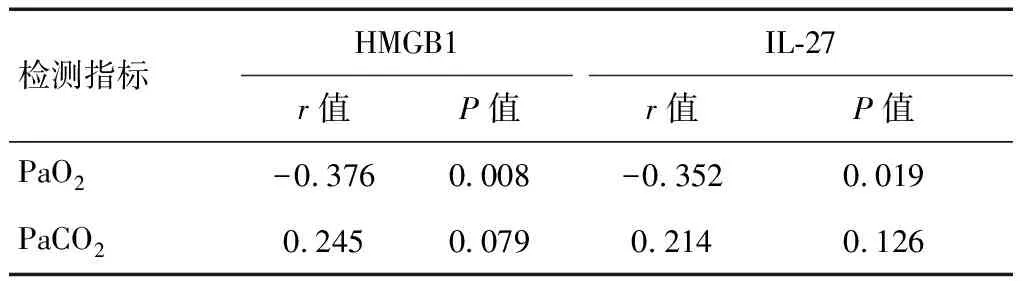
表4 血清HMGB1和IL-27水平与动脉血气指标的相关性分析
2.5 HMGB1和IL-27对COPD合并呼吸衰竭患者预后的评估价值
HMGB1、IL-27及两者联合诊断预测COPD合并呼吸衰竭患者28 d死亡率的AUC分别为0.776、0.787和0.863,灵敏度分别为63.01%、45.21%和64.38%,特异度分别为86.21%、96.55%和96.55%。见表5。
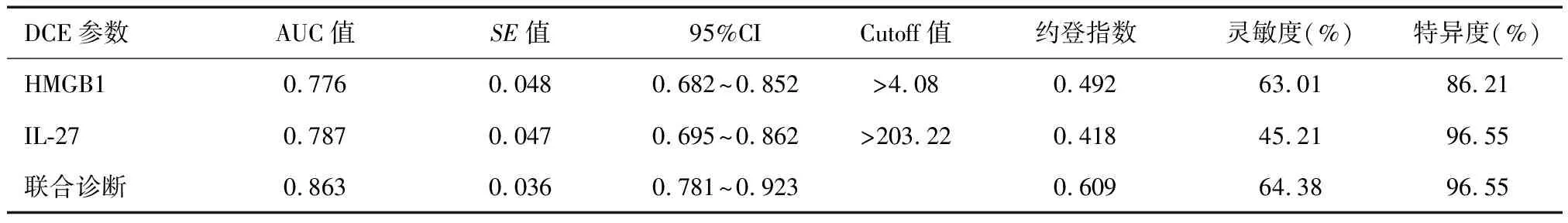
表5 HMGB1和IL-27对COPD合并呼吸衰竭患者预后的评估价值
3 讨论
呼吸衰竭是COPD常见并发症,可导致患者病情迅速恶化,治疗难度增加且病死率明显升高,既往研究[7]认为,COPD的发生与长期慢性炎症引起的气道重塑紧密相关。HMGB1是对炎症反应、氧化应激和损伤修复均具有广泛调节作用的晚期细胞因子,由单核细胞等在接受刺激后约16~20 h释放或自凋亡细胞中被动释放,在血液中可持续存在1~3 d,可参与调解机体免疫和炎症,启动和维持炎症反应瀑布式级联放大,故检测血清HMGB1对评估炎症水平有较良好的参考价值。IL-27是主要表达于树突状细胞、单核细胞及巨噬细胞的异源二聚体,包括EBI3和gp130两类亚基,通过调节Th淋巴细胞增殖和炎症介质分泌来调控机体的炎症反应,以减轻炎症引起的组织损伤[8]。本研究中,COPD患者血清HMGB1、IL-27和CRP水平及外周血单核细胞计数较健康对照组升高,且COPD合并呼吸衰竭患者中上述指标的表达水平进一步升高,可见随着COPD患者病情进展,单核细胞大量增殖并活化,促进HMGB1和IL-27表达并加重炎症反应。炎症反应级联放大导致气道重塑是COPD疾病进展的关键环节,其中HMGB1通常在感染和炎症条件下释放,与晚期的糖基化终产物受体(RAGE)和Toll样受体(Toll-like receptors,TRLs)结合,启动下游ERK/MAPK、MyD88/NF-κB及syk/PI3K信号通路,与IL-1、IL-6和肿瘤坏死因子α(TNF-α)等多种炎症因子形成正反馈环路并促进肺泡内炎症介质聚集,放大炎症效应,引起气道平滑肌增生和纤维化,导致呼吸功能逐渐减退和呼吸衰竭发生[9-10]。
COPD合并呼吸衰竭患者因肺通气或换气功能障碍,可导致缺氧和代谢障碍,严重者可诱发微循环障碍和酸中毒,从而造成患者预后不良[11]。本研究随访结果显示,102例COPD合并呼吸衰竭患者28 d死亡29例,死亡率为28.43%,较李文文等[12]报道的住院死亡率高,可能与本研究随访时间更长有关。同时,本研究显示,死亡组PaO2低于存活组,而PaCO2和血清HMGB1、IL-27和CRP水平及外周血单核细胞计数却高于存活组,表明死亡患者肺功能相对更差并导致机体缺氧和二氧化碳潴留,其中单核细胞活化以及HMGB1、IL-27表达水平升高可能发挥着重要作用。Pearson积差系数分析显示COPD合并呼吸衰竭患者血清HMGB1和IL-27水平与PaO2呈负相关,可见COPD合并呼吸衰竭患者肺功能随着HMGB1和IL-27表达水平增加而减退,因此,对重症患者常规检测肺功能的难度较大,可尝试采用HMGB1和IL-27等实验室指标进行替代。本研究中HMGB1和IL-27预测COPD合并呼吸衰竭患者28 d死亡率的AUC分别为0.776和0.787,灵敏度分别为63.01%和45.21%,特异度分别为86.21%和96.55%,灵敏度相对偏低但特异度较高,对排除患者死亡风险具有良好的参考价值。由于HMGB1和IL-27在促进炎症反应发生中的作用机制不同,本研究将两者联合进行预测,结果显示AUC为0.863,灵敏度为64.38%,特异度为96.55%,其中灵敏度较单独检测有所提升,但仍难以满足临床诊断需求。因此,后续研究中还需要积极探寻更多实验室指标进行综合评估,以为早发现高死亡风险患者并进行干预。
综上,HMGB1和IL-27可通过调节肺部炎症反应影响COPD合并呼吸衰竭患者病情进展和预后,但仅依据血清HMGB1和IL-27水平判断患者预后还存在不足,后续仍需寻求更多的指标以进行综合评估。
