光谱法测定电子烟液中的游离烟碱
2021-08-26黄延俊方钲中张廷贵黄华发韩书磊叶剑良蓝洪桥刘泽春
黄延俊,方钲中,张廷贵,黄华发*,韩书磊,叶剑良,蓝洪桥,刘泽春,谢 卫
1.福建中烟工业有限责任公司技术中心,福建省厦门市集美区滨水路298号 361021
2.国家烟草质量监督检验中心,郑州高新技术产业开发区翠竹街6号 450001
3.厦门大学化学化工学院,福建省厦门市思明区思明南路422号 361005
烟碱结构中包含吡啶和吡咯两个含N基团,因此在不同pH条件下存在3种形态:双质子态、单质子态和游离态(图1),解离常数p Ka1和p Ka2分别为3.12和8.02[1]。通常条件下,烟碱主要以单质子态和游离态形式存在[2]。烟碱形态与卷烟烟气的刺激性显著相关[3-4],游离态烟碱容易穿透上呼吸道黏膜,产生强烈的生理感受或“击喉感”[5];质子态烟碱产生的感受平顺,因此普遍认为含质子态比例高的烟气烟碱容易进入呼吸道深处,给吸烟者带来更强的生理满足感[6]。随着JUUL等电子烟产品的流行,为了提供与传统卷烟相当的烟碱摄入量,电子烟烟液中烟碱的质量分数被提高至5%甚至更高[7];与此同时添加于烟液中的有机酸(苯甲酸、乳酸、丙酮酸等)与烟碱生成盐[8],可调控烟碱形态。

图1 烟碱的3种形态(双质子态、单质子态和游离态)Fig.1 Nicotine in three forms:diprotonated,monoprotonated and free-base
利用烟碱的不同性质均可达到测定游离态烟碱(Free-base nicotine,FBN)的目的,比如通过测定烟草制品的pH,再经过Henderson-Hasselbach公式可快速换算FBN的质量百分比(αfbn)[9]。此外利用烟碱在水相-有机相或液相-气相中的分配,液液萃取法[10-11]或SPME萃取法[12]也可实现游离态和质子态烟碱的分离,但操作较为繁琐,且温度和水分均会干扰测定结果[13]。文献[2,14-15]中所使用的1H NMR方法是一种非破坏性手段,其通过烟碱吡啶环上Ha~Hd和吡咯环上甲基He的化学位移差,可计算得到αfbn。由于测试前不经过前处理,1H NMR方法可较为真实地反映电子烟烟液或烟气中烟碱的形态分布。光谱方法较少应用于烟碱的表征,主要原因是烟碱分子结构中不带有生色团,难以通过直接测量光谱获得质量分数信息。为了更简便直观地表征电子烟液中的FBN,前期工作已应用可溶性的指示分子茜素红S(ARS)开展FBN的测量[16]。由于该方法基于指示分子和烟碱分子中吡咯环N的亲和性,指示分子与有机酸存在竞争关系,即指示分子的p Ka需满足其与烟碱反应显色的需要,又不影响业已形成的烟碱-有机酸络合反应平衡。因此,本研究中选取结构相似但吸电子能力不同的溴甲酚绿(Bromocresol green,BCG,p Ka=4.24)[17]和氯酚红(Chlorophenol red,CPR,p Ka=6.11)(图2)[18],比较了不同显色分子与烟碱的亲和性对电子烟液FBN测定结果的影响,并采用pH法和1H NMR法对结果进行比对验证,旨在建立一种快速准确测定电子烟液FBN的方法。
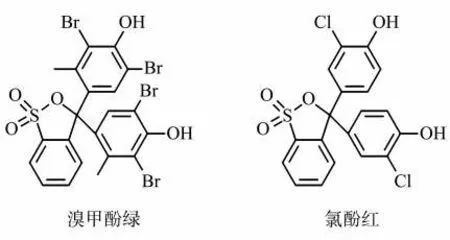
图2 溴甲酚绿(BCG)和氯酚红(CPR)的分子结构Fig.2 Molecular structures of bromocresol green(BCG)and chlorophenol red(CPR)
1 材料与方法
1.1 材料、试剂和仪器
16种商品化电子烟液样品(表1)由福建中烟工业有限责任公司技术中心提供,包括装填式和烟弹式,其中烟弹式经过破拆吸出烟液,有棉芯的取出棉芯后使用针筒挤出烟液。
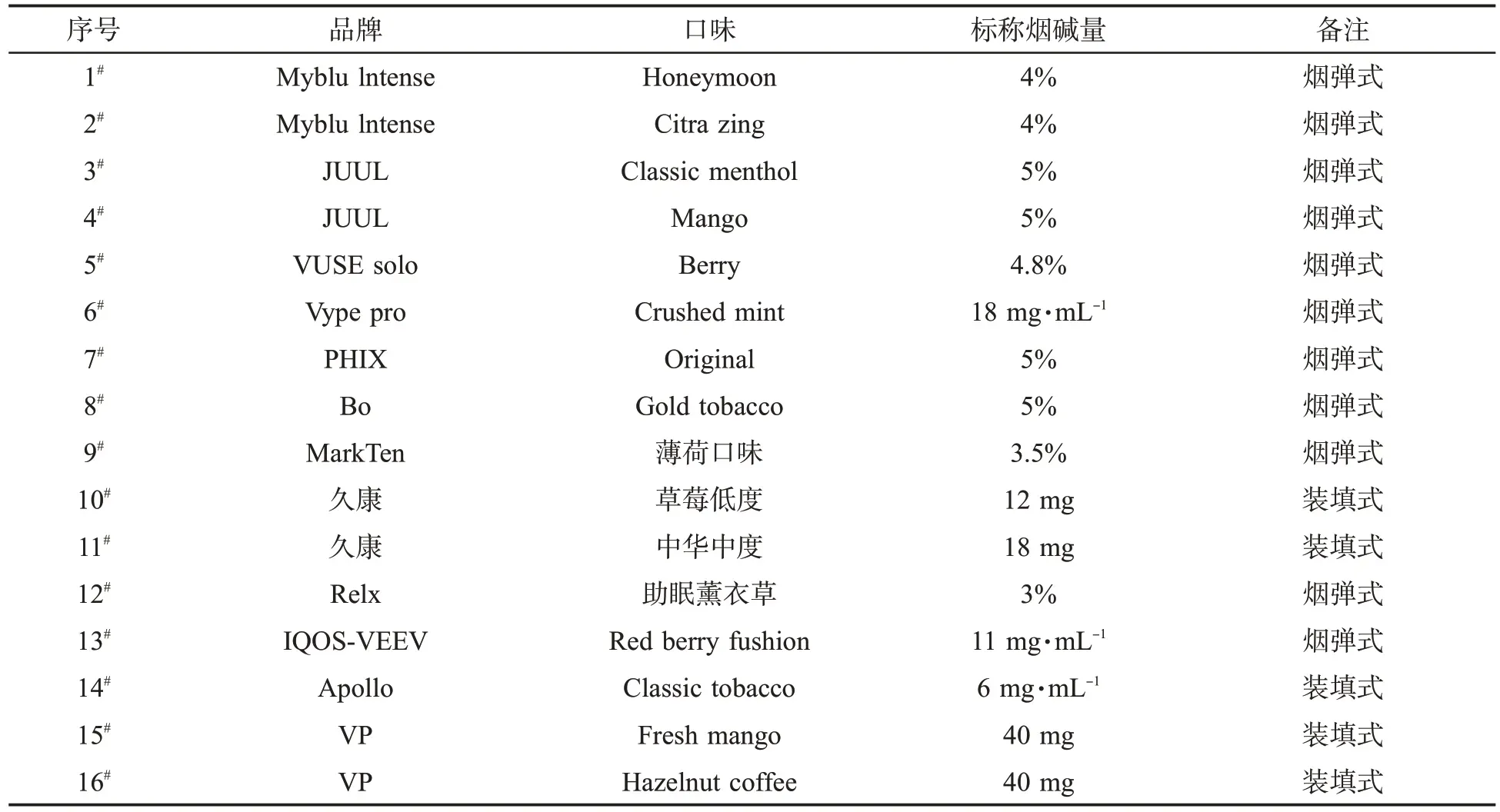
表1 16种商品化电子烟液样品信息Tab.1 Information of 16 commercial e-liquid samples
溴甲酚绿(95%)、氯酚红(95%)、无水乙醇(HPLC级)、异丙醇(HPLC级)、1,2-丙二醇(99.8%)、丙三醇(99%)和DMSO-d6(99.8%D,含TMS内标,VTMS∶VDMSO=3∶10 000)(北京百灵威科技有限公司);烟碱(标准品,国家烟草质量监督检验中心);烟碱(99.9%,湖北和诺生物工程股份有限公司);正十七烷(标准品,阿拉丁生化科技股份有限公司);苯甲酸(99.0%)、柠檬酸(98.0%)、乙酸(99.5%)和三乙胺(99.0%)[梯希爱(上海)化成工业发展有限公司];纯水(自制,电阻率18.2 MΩ·cm)。
Lambda 35紫外-可见分光光度计(美国Perkin Elmer公司);AVANCE III核磁共振波谱仪(500 MHz,瑞士Bruker公司);7890A气相色谱仪(美国Agilent公司);Excellence T7电位滴定仪(装配DGi111-SC玻璃pH电极,瑞士Mettler Toledo公司);ML204电子天平(感量0.000 1 g)(瑞士Mettler Toledo公司);Milli-Q纯水系统(美国Millipore公司);NI5CCI-B同轴核磁管(5 mm,美国Norell公司)。
1.2 方法
1.2.1 溶液配制
烟碱溶液:准确称取1.622 3 g烟碱,用无水乙醇定容至50.0 mL,得到0.2 mol/L烟碱母液;准确移取2.0 mL烟碱母液,用纯水定容至50.0 mL,得到8 mmol/L烟碱溶液。
指示剂(BCG或CPR)溶液:准确称取一定量的指示剂,用纯水定容至50.0 mL,得到1 mmol/L指示剂母液;再移取2.0 mL该母液,用纯水定容至100.0 mL,得到20μmol/L指示剂测试溶液。
1.2.2 烟碱滴定
移取2.0 mL指示剂(BCG或CPR)测试溶液至若干4 mL离心管中,用10.0μL微量进样器注射适量8 mmol/L烟碱溶液,得到系列含0~80μmol/L烟碱的混合溶液。将混合溶液摇匀,静置2 min后进行光谱测试。测试条件:光程10 mm,狭缝宽度1 nm,波长扫描范围300~700 nm。
1.2.3 Job’s Plot结合比测定
分别配制60μmol/L烟碱溶液和60μmol/L指示剂(BCG或CPR)溶液。控制总浓度为60μmol/L,按照摩尔浓度c烟碱∶c指示剂=0∶10、1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1、10∶0混合,将溶液摇匀,静置2 min后进行光谱测试。测试条件同1.2.2节。
1.2.4 电子烟液游离烟碱的光谱测定
称取约100 mg电子烟液,用1.0 mL无水乙醇溶解,移取5.0μL该溶液至2.0 mL指示剂测试溶液(20μmol/L)中,将溶液摇匀,静置2 min后进行光谱测试。测试条件同1.2.2节。
1.2.5 烟液中αfbn的核磁共振法测定
配制烟碱质量分数为20 mg/g的溶液(溶剂:m甘油∶m丙二醇=4∶6)。取适量该溶液,加入等倍于烟碱摩尔数的三乙胺,得到游离烟碱标准溶液;另取适量该溶液,加入5倍于烟碱摩尔数的冰醋酸,得到单质子态烟碱标准溶液。使用同轴核磁管制备样品,外管中加入适量DMSO-d6作为锁场溶剂,内管中加入适量电子烟液(或游离烟碱标准溶液、单质子烟碱标准溶液),进行1H NMR测试。
1.2.6 烟液pH的测定
使用pH 4.00邻苯二甲酸氢钾缓冲液、pH 7.00磷酸二氢钾-磷酸氢二钠缓冲液和pH 10.00碳酸钠-碳酸氢钠缓冲液进行校正。将500 mg电子烟液溶解于5 mL去离子水中,取15 min内3次pH测量结果的平均值。
1.2.7 烟液烟碱总量的测定
称取约200 mg电子烟液,溶解于50 mL异丙醇(含正十七烷内标),溶液摇匀后直接进行气相色谱测试。色谱条件:
色谱柱:J&W DB-WAX毛细管柱(30 m×250 μm×0.25μm);进样口温度:250℃;进样量:2.0μL;分流比:30∶1;载气:He,流速1.4 mL/min;升温程序:检测器:250℃。
使用烟碱的异丙醇标准溶液(含正十七烷内标)绘制标准工作曲线并计算电子烟液烟碱的总量。
2 结果与讨论
2.1 溴甲酚绿和氯酚红的光谱性质
BCG在水溶液中呈现透明的淡绿色,随烟碱质量分数增加,溶液发生由淡绿色-蓝绿色-蓝色的转变,与之对应的光谱(图3a)中,442 nm处的吸光度逐渐降低,616 nm处的吸光度逐渐升高。CPR在水溶液中呈现透明的淡黄色,随烟碱质量分数增加,溶液呈现由淡黄色-橙红色-玫红色的转变,与之对应的光谱(图3b)中,439 nm处的吸光度逐渐降低,587 nm处的吸光度逐渐升高,最大吸收波长逐渐向短波长移动至577 nm。颜色的改变说明BCG和CPR分子与烟碱发生反应,脱质子而呈现离子态的颜色。
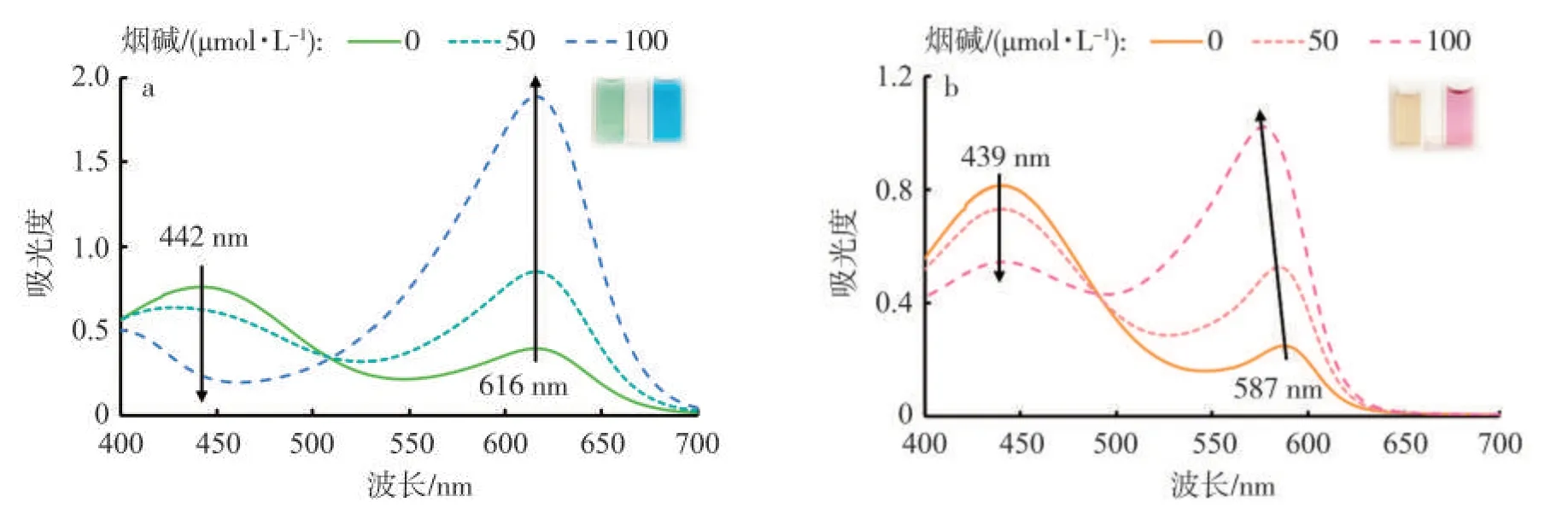
图3 添加不同浓度烟碱的BCG溶液(a,50μmol/L)和CPR溶液(b,50μmol/L)的紫外-可见吸收光谱Fig.3 UV-vis spectra of BCG(a,50μmol/L)solution and CPR(b,50μmol/L)solution in presence of nicotine
固定BCG和烟碱总浓度为60μmol/L,按照不同BCG-烟碱摩尔浓度比例配制溶液,并绘制吸收光谱。取光谱中616 nm(BCG)或587 nm(CPR)的吸光度与摩尔浓度比作图(Job’s Plot图,图4)并考察结合比。结果表明,当c烟碱∶cBCG=1.5~2.3(6∶4~7∶3)时,616 nm处的吸光度最强,可认为BCG与烟碱的结合比为1∶2;同理,当c烟碱∶cCPR=1.5~2.3时,587 nm处的吸光度最强,可认为CPR与烟碱的结合比为1∶2。
向BCG和烟碱的混合溶液中添加0.5倍于BCG摩尔数的苯甲酸或柠檬酸,两种有机酸均可使溶液颜色改变,且柠檬酸的作用更加明显(图5)。CPR呈现与BCG类似的光谱变化,说明由于有机酸的酸性高于两个指示剂,能够竞争与烟碱分子中吡咯环N的作用位点,从而使显色分子回到其分子形态。
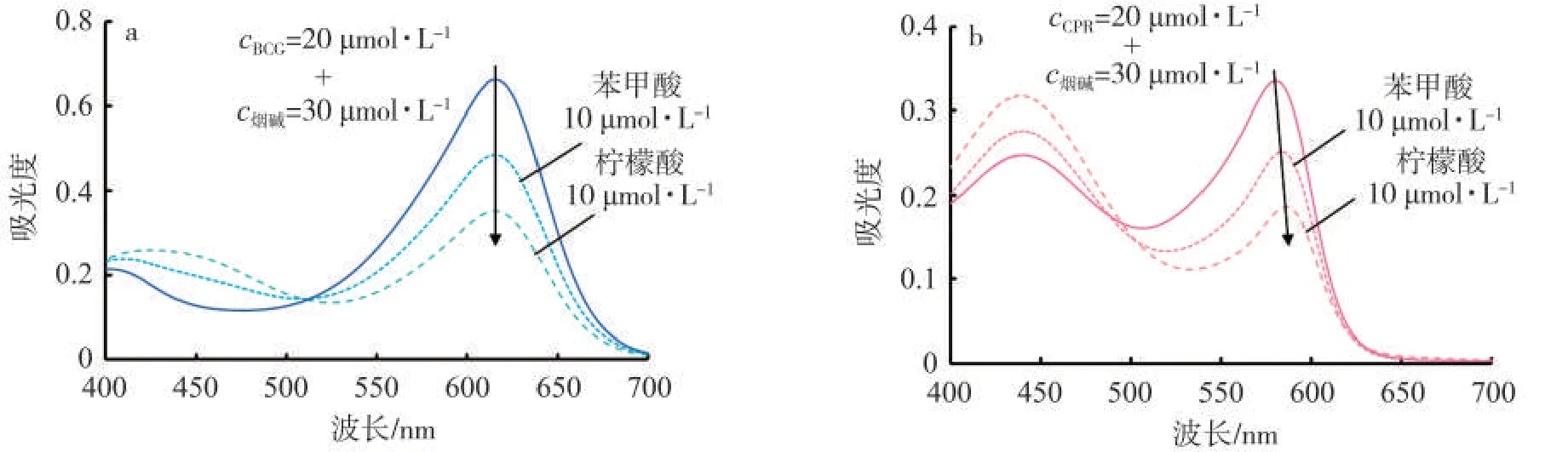
图5 添加或不添加苯甲酸或柠檬酸(10μmol/L)的BCG-烟碱混合溶液(a,20μmol/L+30μmol/L)和CP R-烟碱混合溶液(b,20μmol/L+30μmol/L)的紫外-可见吸收光谱Fig.5 UV-vis spectra of BCG-nicotine(a,20μmol/L+30μmol/L)mixture solution and CPR-nicotine(b,20μmol/L+30 μmol/L)mixture solution in absence and presence of benzoic acid(10μmol/L)or citric acid(10μmol/L)
弱酸性的显色分子能够与烟碱反应脱质子变色。但是当有机酸共存于体系中时,由于有机酸较高的亲和性,其优先与烟碱反应形成离子对,因此显色分子只能与未结合的烟碱即游离烟碱反应显色,从而指示共存体系中游离烟碱的质量分数(图6)。
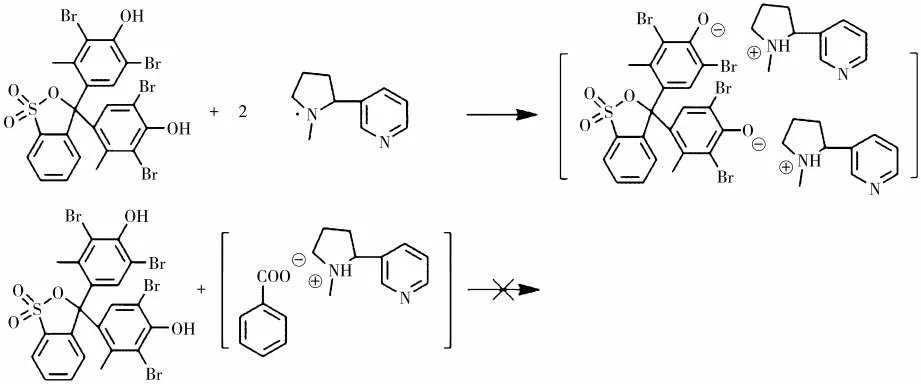
图6 有机酸共存体系中BCG与烟碱的作用机理Fig.6 Proposed interaction mechanism of BCG and nicotine in absence and presence of organic acid
2.2 定量方法的建立
根据以上原理在20μmol/L BCG溶液中添加不同质量分数的烟碱并绘制光谱图,以616 nm处的吸光度建立了BCG测试FBN的工作曲线:lg A616=0.017 2c-0.537 8,r2=0.998 9(图7)。其中A616为BCG溶液在616 nm的吸光度,c为电子烟液中FBN的质量分数,单位mg/g。称量约100 mg电子烟液,用1.0 mL无水乙醇溶解,再移取5μL注射于2.0 mL 20μmol/L的BCG溶液中,混匀后测试光谱。将最低烟碱浓度的溶液重复测试11次,计算其标准偏差,分别以3倍和10倍标准偏差得到方法的检出限(LOD,0.11 mg/g烟液)和定量限(LOQ,0.37 mg/g烟液),可测量电子烟液FBN的质量分数范围为0.37~23.36 mg/g。采用相同方法建立了CPR测试FBN的工作曲线:lg A587=0.015 4c-0.813 0,r2=0.993 6,其中A587为CPR溶液在587 nm的吸光度。LOD和LOQ分别为0.19和0.63 mg/g烟液,可测量电子烟液FBN的质量分数范围为0.63~23.36 mg/g。
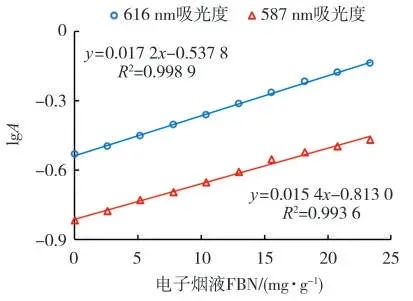
图7 BCG溶液(20μmol/L)和CPR溶液(20μmol/L)用于测试电子烟液FBN质量分数的标准工作曲线Fig.7 Calibration curves for determination of FBN in e-liquids using BCG(20μmol/L)solution and CPR(20μmol/L)solution
2.3 商品化电子烟液的测试
分别测定16个商品化电子烟烟液烟碱总量和烟液pH。运用以上建立的工作曲线,使用BCG和CPR分别测定了电子烟液FBN的质量分数。不同方法所获得的FBN质量分数及αfbn如表2所示。烟液烟碱<20 mg/g时,pH法测得的αfbn平均值为65.8%,光谱法测得的αfbn平均值为76.1%;烟液烟碱>20 mg/g时,pH法测得的αfbn平均值为10.7%,光谱法测得的αfbn平均值为19.2%。这说明电子烟液厂商在提供较高烟碱摄入量时采用了低游离烟碱的策略以降低生理冲击感。

表2 16个商品化电子烟液游离烟碱(FBN)质量分数和游离烟碱质量百分比(αfbn)Tab.2 Mass fractions of free-base nicotine(FBN)and proportions of FBN(αfbn)in 16 commercial e-liquid samples
总体而言,pH方法测试的结果与光谱方法存在一定的偏离,特别是游离态烟碱比例较低时,pH换算所得αfbn明显低于光谱方法(表2和图8),可能是由于pH测试前用水稀释烟液。烟液溶剂多为甘油和丙二醇,用电极进行pH测试时溶剂组成的不确定容易带来测试结果的误差[19]。采用本研究中所建立的光谱方法测试时,将电子烟液浓度稀释为原来的1/4 000,可保证溶剂体系的一致性。由图8还可知,使用BCG所获得的αfbn值高于CPR,可能是由于BCG(p Ka=4.24)的吸电子能力高于CPR(p Ka=6.11),BCG与有机酸的竞争能力更强,因此在低αfbn时BCG所能结合的烟碱多于CPR。
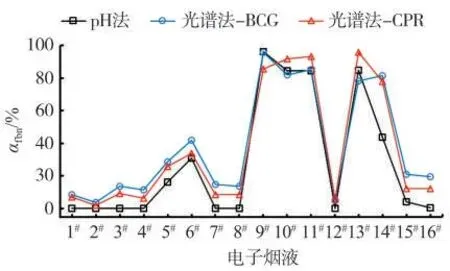
图8 不同测试方法所获得的电子烟液游离烟碱质量百分比(αfbn)Fig.8 Proportions of free-base nicotine(αfbn)in e-liquid samples obtained by p H method and by spectroscopic methods
2.4 测试结果的验证
按照Duell等[14]的方法,将烟碱-三乙胺(1∶1,摩尔比)溶于甘油-丙二醇(m甘油∶m丙二醇=4∶6)中制得游离烟碱标准烟液,将烟碱-冰醋酸(1∶5,摩尔比)溶于甘油-丙二醇(m甘油∶m丙二醇=4∶6)中制得单质子态烟碱标准烟液。利用1H NMR谱图,通过烟碱吡啶环Ha~Hd的化学位移δHa~δHd和吡咯环甲基He的化学位移δHe[21],换算得到电子烟液的αfbn,如表3所示。光谱法测得6个电子烟液的αfbn与1H NMR方法具有较好的相关性(图9),其中使用CPR的测定值与1H NMR法的R2=0.985 5,优于使用BCG的测定值(R2=0.961 4)。由于1H NMR测定过程不涉及烟液样品的前处理,保留了烟碱在电子烟液中的形态分布信息,因此使用CPR进行αfbn的光谱测定,可更真实地反映电子烟液中烟碱的游离状态。

表3 标准烟液和商品化电子烟液中烟碱化学位移(δ)和游离烟碱质量百分比(αfbn)①Tab.3 Chemical shifts(δ)and proportions of free-base nicotine(αfbn)in standard and commercial e-liquid samples
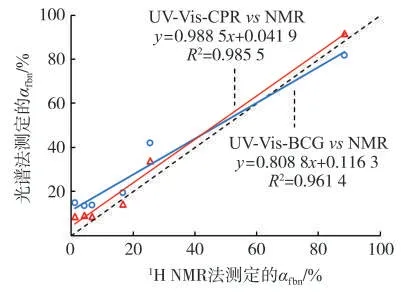
图9 光谱方法和NMR方法测定的游离烟碱质量百分比(αfbn)比较Fig.9 Proportions of free-base nicotine(αfbn)determined by UV-vis method and by 1H NMR method
3 结论
①指示分子溴甲酚绿(BCG)和氯酚红(CPR)与游离烟碱发生显色反应,不与质子态烟碱反应,因此能够建立光谱信号与游离烟碱的定量关系。②16个商品化电子烟液烟碱大于20 mg/g时,αfbn平均值为19.2%;烟液烟碱小于20 mg/g时,αfbn平均值为76.1%。③烟液中游离烟碱质量百分比(αfbn)较低时,光谱方法测定结果与pH方法存在较大差异,且BCG测得的αfbn高于CPR。④用1H NMR法对测定结果进行验证,CPR的测定结果与1H NMR法具有较好的相关性,可更真实地反映电子烟液中烟碱的游离状态。
