左归降糖解郁方对模拟糖尿病并发抑郁症环境下海马NVU结构蛋白的作用及机制研究❋
2021-08-25韩远山赵洪庆王宇红
凌 佳, 柳 卓, 刘 检, 朱 青, 韩远山, 赵洪庆, 孟 盼, 杨 蕙, 王宇红△
(1.湖南中医药大学科技创新中心, 长沙 410208;2.湖南省中医研究院附属医院, 长沙 410006;3.湖南中医药大学第一附属医院, 长沙 410007;4.中南大学湘雅医学院附属肿瘤医院, 长沙 410007)
糖尿病并发抑郁症(diabetes mellitus with depression,DD)是糖尿病患者常见的以认知功能障碍为主要特征表现的慢性并发症。据报道,60%~75%糖尿病患者有抑郁情绪[1],且DD患者的死亡率明显高于单纯糖尿病患者[2],因此开展DD的发病机制及防治应用研究很有意义。神经血管单元(neurovascular unit,NVU)主要包含微血管、周围星形胶质细胞及其突起的周围神经元等部分[3-4]。前期研究发现,DD大鼠血脑屏障(blood-brain barrier, BBB)相关蛋白表达下降,提示BBB损伤[5],在此基础上推测NVU结构也可能受损。胶质原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)、间隙连接蛋白-43(connexin-43, CX43)和紧密连接蛋白(occluding)分别是星形胶质细胞的骨架蛋白,星形胶质细胞与神经元之间、星形胶质细胞与微血管内皮细胞之间的连接通道。故本研究建立神经元(neuron,NE)、星形胶质细胞(Astroglia,AS)、脑微血管内皮细胞(The brain microvascular endothelial cells,BMECs)三细胞体外共培养体系,采用高糖联合皮质酮模拟DD环境,拟从NVU角度探讨左归降糖解郁方对模拟DD环境下GFAP、CX43及occluding的影响,并初步探讨中药复方对DD大鼠海马NVU的保护作用。
1 材料
1.1 药物
左归降糖解郁方(以下简称左归方)组成:黄芪、牛膝、山茱萸、枸杞子、丹参、熟地黄、菟丝子、姜黄、杜仲、牡丹皮、贯叶金丝桃,购自湖南中医药大学第一附属医院,并按比例水煎浓缩后制成口服液。盐酸二甲双胍片(吉林省东北亚药业股份有限公司,国药准字H22020508,0.25 g/片);盐酸氟西汀(西南药业股份有限公司,国药准字J20160029,20 mg/片)。
1.2 动物
SPF级SD大鼠,其中新生1 d和10 d的乳鼠各5只,雌性成年大鼠(受孕18 d)3只(400~450 g),9只雄性成年大鼠(200~220 g),均购自湖南斯莱克景达实验动物有限公司,实验动物许可证号SCXK(湘)2015-0003。AS原代取材于1 d新生乳鼠中。BMECs原代取材于10 d新生乳鼠,海马NE原代取材于受孕雌性大鼠。雄性实验大鼠饲养于湖南中医药大学第一附属医院SPF级实验动物中心,适应性饲养5 d,温度(25±5)℃,湿度40%。
1.3 试剂
皮质酮(Sigma,货号CCAD300161)、L-多聚赖氨酸(Sigma,货号25988-63-0)、DMSO(Sigma,货号67-68-5);Ⅰ型胶原酶(Amresco,货号C0130),兔抗大鼠神经元特异性烯醇化酶(nerve-specific enolase,NSE)多克隆抗体(Bioworld,货号6813-50);兔抗大鼠GFAP抗体、DAPI(Abcam,货号ab218309、ab104139);兔抗大鼠occluding抗体(Proteintech,货号13409-1-AP)、兔抗大鼠CX43抗体(Proteintech,货号15386-1-AP)、小鼠抗大鼠GAPDH抗体(Proteintech,货号10494-1-AP)。
1.4 仪器
ABI3500型高内涵成像分析系统(PerkinElmer);3422,3412,3450,3460型Transwell小室(Corning);Galaxy 48 R型三气细胞培养箱(Eppendorf);GR-60DA/GR型高压蒸汽灭菌锅(Zealway);6406型体视显微镜(Leica)。
2 方法
2.1 海马NVU模型的建立
2.1.1 NE、As及BMECs原代培养及鉴定
(1)NE原代培养及鉴定:10 %水合氯醛腹腔麻醉18 d 受孕SD大鼠,取胎鼠全脑中海马,剪碎后加0.25%胰蛋白酶和0.2%胶原酶(1:1)混合液消化、离心、重悬、过筛、计数,6 × 104/孔接种于96孔培养板(预包被),4 h后全量换成维持液(Neurobassal:B27补充剂:Glutamax:双抗=96∶2:1∶1),第3天半量更换维持液。待NE生长5 d后,室温固定30 min,0.25% TritonX-100孵育,30 min封闭(5% BSA),滴加兔抗大鼠NSE,4 ℃过夜;加FITC标记的二抗37 ℃孵育1 h,加DAPI室温20 min,50 μL PBS,Operetta型高内涵成像分析(high content analysis,HCA)系统观察、拍照并分析。
(2)As原代培养及鉴定:将新生3 d乳鼠脱臼处死后无菌取出大脑,去血管和脑膜保留皮质,剪碎、消化、离心、重悬、过筛、计数,5×105/瓶接种至预包被的25 cm2培养瓶中,30 min后转移上清培养液至另一培养瓶中继续培养。每3 d换液1次,振荡弃除脱落细胞,正常培养基继续培养即可。培养2代后将细胞混悬液接种到96孔培养板中(5×105/mL),待细胞生长基本融合后,根据上述操作,以GFAP抗体和DAPI作为标记,采用HCA系统观察分析。
(3)BMECs:原代培养及鉴定:根据上法取出新生10 d乳鼠大脑皮质,离心后弃上清;在沉淀的组织中等量加入25% 牛血清白蛋白后反复吹悬,离心2次,将所得血管沉淀按1∶2比例加入0.1% Ⅱ型胶原酶,消化、重悬后离心,再次重悬后按1×104/mL密度接种至预包被培养瓶中备用。将培养至第2代、密度为1×105/mL的细胞混悬液接种到24孔培养板中,待生长基本融合后,根据以上操作,以PECAM-1/CD31和DAPI作为染色剂,采用HCA系统观察分析。
2.1.2 海马NVU体外培养体系的构建 将原代海马NE接种于6孔培养板内;将AS纯化、消化、重悬,于Transwell小室外侧接种1×105细胞悬液,继续培养1 d;接种1×105个BMECs细胞纯化、消化、重悬,并向小室内侧培养1 d后,将接种有AS和BMECs的小室转移到接种有NE的6孔板内,即得NVU体外共培养体系[6]。
2.2 含药血清的制备
SD大鼠随机分为左归方含药血清组、阳性药含药血清组、空白血清组,每日分别对应给予临床有效3倍量的左归方(32.8 g/kg)、氟西汀+二甲双胍(1.8 mg/kg,0.18 g/kg)、蒸馏水[7],连续3 d(每日2次)灌胃给药,末次给药后取血静置2 h后离心,小心吸取上清,56 ℃水浴30 min灭活,0.22 μm滤膜过滤,分装后低温保存备用。
2.3 模拟DD环境的构建及分组、药物干预
待NVU共培养体系构建3 d后,给予高糖(150 mmol/L)联合皮质酮(200 μmol/L)进行干预18 h[8],构建模拟DD状态下NVU模型。随机分为空白血清对照组、正常对照组、模型组、左归方含药血清组、阳性药含药血清组,依次加入10%的空白血清、阳性药(氟西汀+二甲双胍)含药血清及左归方含药血清,同时向模型组与正常组中分别加入等量培养液以补齐液面。
2.4 海马NVU屏障功能的测定
2.4.1 跨内皮细胞电阻值(trans-epithelial electrical resistance,TEER)检测 在共培养Transwell小室内外侧的AS和BMECs分别基本融合为单层时,根据仪器说明书采用Millipore ERS-2电阻仪测量TEER。
2.4.2 NVU体系渗透性检测 待细胞共培养基本融合为单层时(3 d左右),加培养液保证Transwell小室内外侧液面高度差为0.5 cm,将共培养体系置于培养箱中正常培养4 h,观察并测量Transwell小室内外侧液面高度变化情况。
2.5 Western blot检测海马NVU结构蛋白的表达
干预18 h后去除体系所有培养液,PBS清洗后分别裂解并收集AS、BMECs细胞,冰上裂解60 min,离心取上清得到蛋白提取液定量备用。根据目的蛋白分子量选择对应浓度的分离胶,上样、电泳,加入一抗(GFAP、CX43、Occluding)稀释液(1∶1000) 4 ℃孵育过夜,二抗缓冲液(1: 1000)室温孵育1 h显影。应用ImageJ软件对条带进行分析,并得到相应灰度值。
2.6 统计学方法
3 结果
3.1 海马NVU各细胞形态及鉴定结果
图1示,倒置相差显微镜下,对单独培养的BMECs、AS和NE进行形态学观察。可见BMECs胞体纺锤形,呈铺路石样簇状生长;AS多呈卵圆形或圆形,胞体凸起较多较长,胞体圆润光滑,折光性好;NE纵横交错形成神经元网络,折光性较好。采用HCA系统检测发现,3种细胞分别经特异性标志物染色后,可见绿色荧光在胞浆中呈阳性表达,随机选取10个视野,结果表明阳性细胞率均达95%以上。
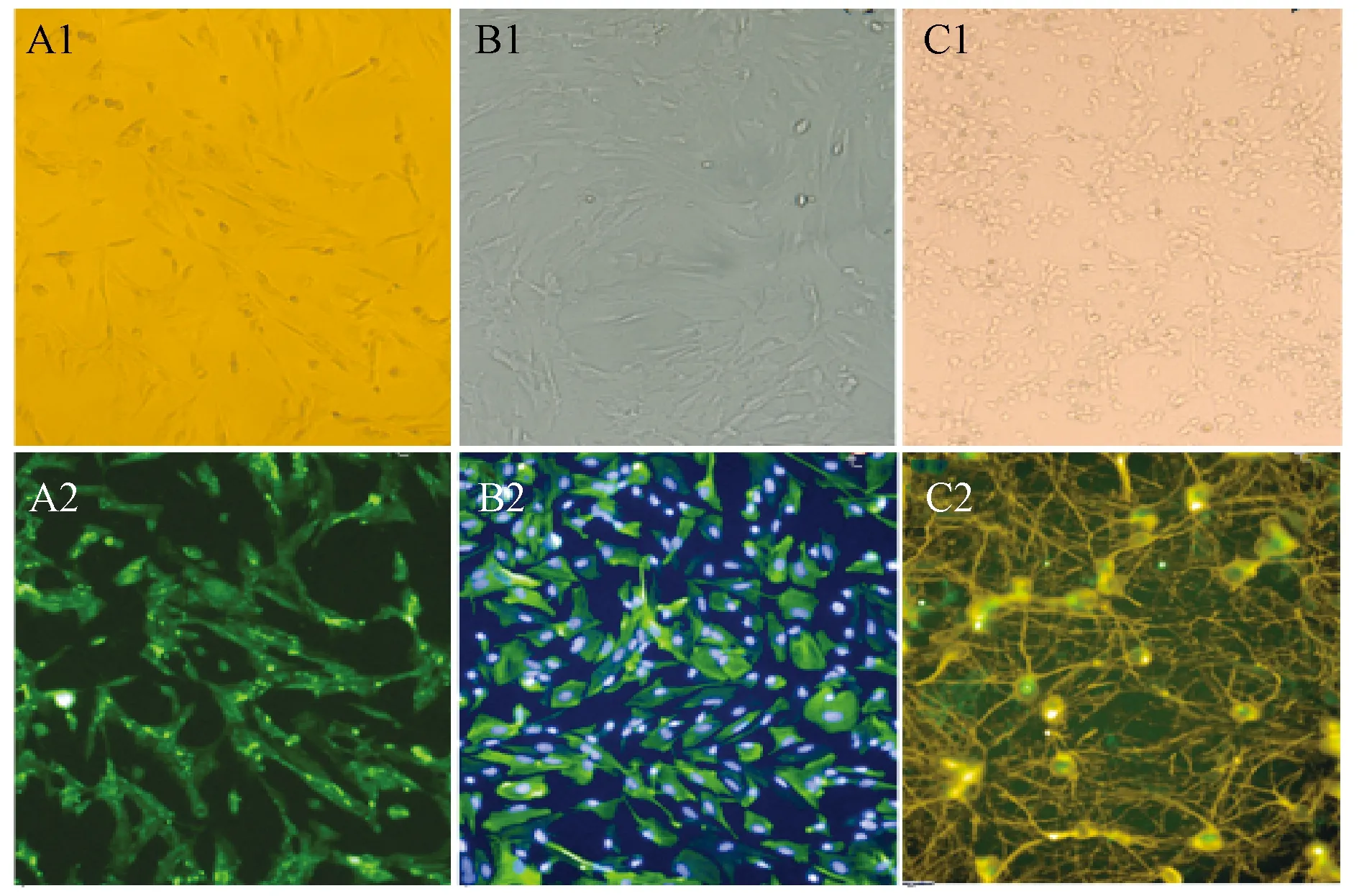
注:A1.BMECs第二代培养5 d;A2.BMECs荧光鉴定;B1.AS第二代培养5 d;B2.GFAP荧光鉴定;C1.NE原代培养5 d;C2.NE荧光鉴定;神经元(neuron,NE)、星形胶质细胞(astroglia,AS)、脑微血管内皮细胞(The brain microvascular endothelial cells,BMECs)、胶质原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)
3.2 左归降糖解郁方对模拟DD环境下海马NVU屏障功能的影响
图2示,与正常对照组比较,模型组TEER值显著降低(P<0.05)。与模型组比较,阳性药含药血清组和左归方含药血清组TEER值均显著升高(P<0.05),提示左归方对模拟DD环境下海马NVU体外模型屏障功能有一定的保护作用。
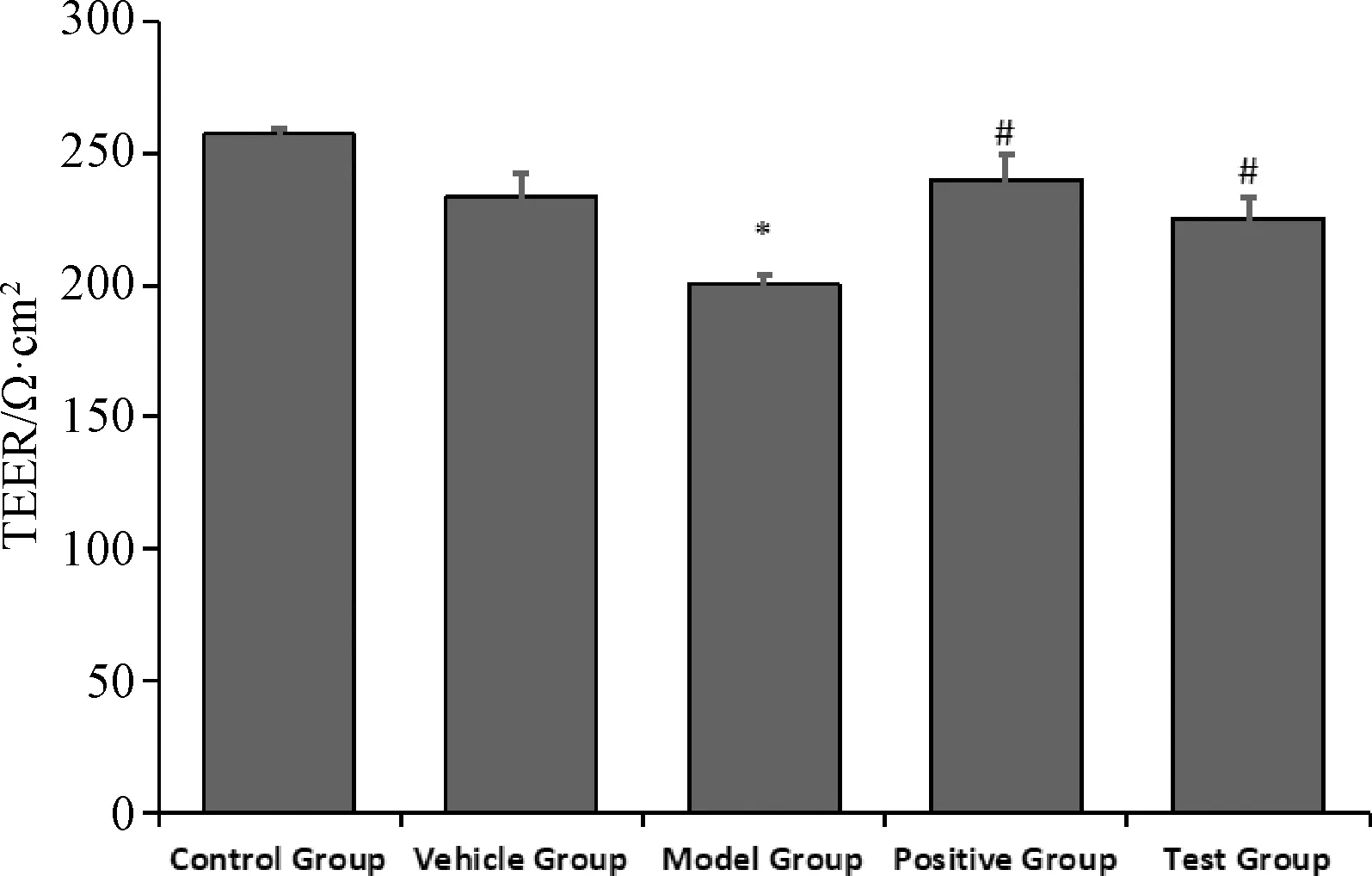
注:与正常组比较:*P<0.05;与模型组比较:#P<0.05;正常对照组(Control Group);空白血清对照组(Vehicle Group);模型组(Model Group);阳性药(二甲双胍+氟西汀)含药血清组(Postive Group);左归方含药血清组(Test Group)
图3示,与正常对照组比较,模型组4 h渗漏试验液面差值显著升高(P<0.01)。与模型组比较,阳性药含药血清组和左归方含药血清组4 h渗漏试验液面差值均显著降低(P<0.05),同样表明左归方对模拟DD环境下海马NVU体外模型屏障功能具有一定保护作用。

注:与正常组比较:**P<0.01;与模型组比较:#P<0.05;正常对照组(Control Group);空白血清对照组(Vehicle Group);模型组(Model Group);阳性药(二甲双胍+氟西汀)含药血清组(Postive Group);左归方含药血清组(Test Group)
3.3 左归方对模拟DD环境下海马NVU结构蛋白表达的影响
图4示,与正常对照组比较,AS细胞GFAP、CX43积分光密度值均显著降低(P<0.05);与模型组比较,阳性药含药血清组和左归方含药血清组AS细胞GFAP、CX43积分光密度值均显著升高(P<0.05),提示在模拟DD环境下海马NVU体外模型中,左归方能上调GFAP、CX43蛋白的表达。

注:与正常对照组比较:*P<0.05,与模型组比较:#P<0.05;A.正常对照组(Control Group);B.空白血清对照组(Vehicle Group);C.模型组(Model Group);D.阳性药(二甲双胍+氟西汀)含药血清组(Postive Group);E.左归方含药血清组(Test Group);胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP),间隙连接蛋白(Connexin43,Cx43)
图5示,与正常对照组比较,模型组BMECs细胞occluding积分光密度值均显著降低(P<0.01);与模型组比较,阳性药含药血清组和左归方含药血清组BMECs细胞occluding积分光密度值均显著升高(P<0.05),提示左归方能逆转模拟DD环境下海马NVU体外模型中occluding的蛋白表达。
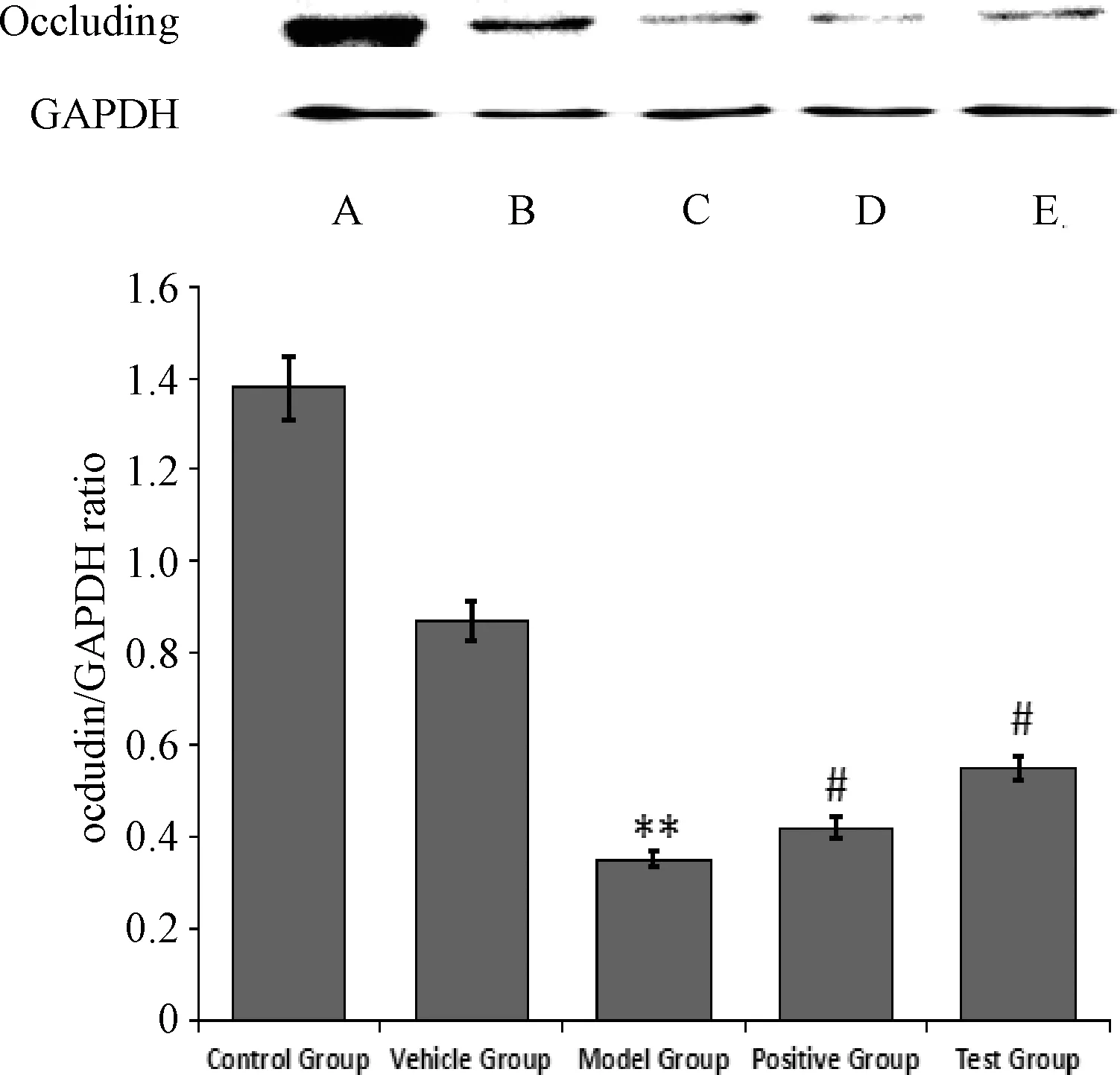
注:与正常对照组比较:**P<0.01;与模型组比较:#P<0.05;A.正常对照组(Control Group);B.空白血清对照组(Vehicle Group);C.模型组(Model Group);D.阳性药(二甲双胍+氟西汀)含药血清组(Postive Group);E.左归方含药血清组(Test Group);occluding为紧密连接蛋白
4 讨论
左归方由经方左归丸化裁而来,去龟甲胶、鹿角胶、山药3味大补阴之品,新增贯叶连翘以疏肝解郁,加丹参、牡丹皮以活血祛瘀,添黄芪以补气健脾,再辅以杜仲以增牛膝之补肝肾之功。
NVU涵盖神经元和BBB 2个部分,并重点强调神经元、神经胶质细胞及脑微血管之间的相互作用[9],故可从整体角度阐述神经系统相关疾病的发病机制与治疗机制。TEER和4 h渗漏试验均是检测BBB通透性的经典方法,其中TEER测量反映生物屏障对带电离子对的通透性,是检测血脑屏障通透性最敏感的指标之一[10]。而4 h渗漏试验则可直接反映血脑屏障的完整性。从本实验结果可知,经左归方含药血清处理后,模拟DD环境下NVU模型中的TEER值提高,表明该方对模拟DD环境下NVU模型的屏障结构具有一定保护作用。AS骨架蛋白GFAP的表达反映AS的功能状态。CX-43主要存在于AS和NE,是成年哺乳类动物中枢神经系统中表达最强的缝隙连接蛋白[11]。有丝分裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)和蛋白激酶C(protein kinase C,PKC)可通过控制CX43等磷酸化过程而保持半通道关闭状态[12]。occluding是BMECs与AS之间的中间桥梁蛋白,具有栅栏功能和屏障调节功能[13]。本实验结果表明,DD组GFAP、CX-43和occluding 3种结构蛋白表达均有下降,提示BMECs与AS之间、AS与NE之间的连接均受到损伤,同时AS的数目也呈下降趋势。而阳性药(二甲双胍+氟西汀)和左归方均可恢复连接蛋白的表达,提示左归方对模拟DD环境下NVU模型具有保护作用,且可能是通过影响GFAP、CX-43以及occluding的表达,保护NVU各环节之间的连接功能而发挥的。
综上所述,左归方可通过上调GFAP、CX43和occluding蛋白表达,维持海马NVU的完整性,实现对DD状态下海马NVU的修复作用。本研究结果证明了NVU可作为研究DD的一个靶点,但其具体的信号通路及传导过程还需做进一步的深入研究。
