自噬诱导、抑制的人三阴性乳腺癌细胞系MDA-MB-231中ATG2A和ATG9A表达观察
2021-08-25杨鑫娇邹迪熊喆张海珠夏从龙赵红业
杨鑫娇,邹迪,熊喆,张海珠,夏从龙,赵红业
1 大理大学药学院,云南大理671000;2 云南省动物基因编辑与体细胞克隆技术重点实验室;3 云南省异种器官移植工程研究中心
乳腺癌是女性死亡的主要原因之一,2021年乳腺癌新诊断病例数占女性癌症新诊断病例数的30%,由于肿瘤异质性、治疗耐药、转移和疾病复发,患者的治愈仍然面临巨大挑战[1-2]。乳腺癌根据肿瘤组织病理学检查,可分为Luminal A 型、Luminal B型、HER-2 过表达型和三阴型[3],其中三阴性乳腺癌占乳腺癌的10%~20%,其侵袭性强、远处转移率高、预后差,迄今治疗仅限于非转移性疾病的化疗,并缺乏有效的治疗方案[4]。自噬在乳腺癌活性方面发挥作用,并由自噬相关基因(ATG基因)调控,ATG基因是潜在的预后生物标志物和治疗靶点[5]。在营养缺乏时,自噬使细胞内溶酶体大量降解,消除受损的细胞器和蛋白质聚集体并加以回收利用,这对肿瘤细胞存活至关重要[6-7]。ATG2 是一种定位于自噬前体液泡周围的点状蛋白,分为A、B 两型,其中ATG2A 可以促进自噬体的延伸和闭合[8-11]。ATG9是自噬体形成核心机制中惟一的多次跨膜蛋白,在营养缺乏时,ATG9 以囊泡结合形式被运输至内质网自噬起始部位,为自噬体形成提供膜源[12-13]。巴弗洛霉素A1(Baf-A1)是一种自噬抑制剂,通过阻止自噬体和溶酶体的融合从而抑制自噬[9]。2019年4月25日—2020年12月13日,本研究观察了自噬诱导、抑制人三阴性乳腺癌细胞系MDA-MB-231 中ATG2A、ATG9A 表达变化,为开发新的乳腺癌治疗策略、相关靶向药物和临床研究提供理论基础。
1 材料与方法
1.1 细胞及试剂 人三阴性乳腺癌细胞系MDAMB-231 购于上海中科院细胞库。DMEM 培养基、Earle's平衡盐溶液(EBSS)购于美国Gibco公司,Baf-A1 购于上海生工生物工程有限公司,双抗(青霉素-链霉素)购于Biological industries,胎牛血清购于Ex⁃Cell Bio 公司,抗-自噬相关蛋白LC3B 兔抗、抗P62/SQSTM1 兔抗和抗β-actin 鼠抗均购于美国Sigma 公司,抗ATG2A 兔抗购于美国CST 公司,抗ATG9A 兔抗购于英国Abcam 公司,TRIzol 购于TransGen Bio⁃tench 公司,Prime-Script RT 试剂盒、SYBR 酶购于美国Takara公司,BCA蛋白浓度检测试剂盒、发光显色液、蛋白提取试剂(RiPA Lysis Buffer)、蛋白Marker和Western blotting 一抗稀释液均购于碧云天生物科技有限公司,血清蛋白购于北京索莱宝有限公司。
1.2 细胞自噬诱导、抑制处理及分组 乳腺癌MDA-MB-231细胞接种于10 cm细胞培养皿中,培养于10 mL 含10%热灭活胎牛血清、100 IU/mL 青霉素的DMEM 培养基中,置于37 ℃、5% CO2的培养箱中培养,12 h换液一次,待细胞长至培养皿80%左右进行细胞传代,取对数生长期的细胞分别接种于10 cm 细胞培养皿,待细胞密度长至70%左右,将细胞分为4 组,对照组加入DMEM 培养液正常培养,Baf-A1组在DMEM培养液中加100 nmol/L的Baf-A1进行自噬阻断,EBSS 组加入EBSS 培养液进行饥饿诱导,EBSS + Baf-A1 组在EBSS 培养液中加入100 nmol/L的Baf-A1,四组均处理4 h,备用。
1.3 各组细胞中ATG2A、ATG9A mRNA 检测 采用实时荧光定量(Q-PCR)法。取各组细胞,TRIzol法提取总RNA,cDNA 使用Prime-Script RT试剂盒合成,获得的cDNA 作为SYBR Greenbased Q-PCR 的模板,采用定量聚合酶链反应检测各组细胞中ATG2A、ATG9A mRNA。引物序列由深圳华大基因有限公司合成,以甘油-3-磷酸脱氢酶(GAPDH)为内参,基 因 序 列 见 文 献[23]。以2-ΔΔCt表 示 细 胞 中 目的mRNA的相对表达量。实验重复3次,取平均值。
1.4 各组细胞中ATG2A、ATG9A、P62、微管蛋白1轻链3(LC3)蛋白检测及LC3B-Ⅱ/LC3B-Ⅰ测算采用Western Blotting 法。取各组细胞,用PBS洗涤2次,收集细胞,加入等体积通用蛋白裂解液(内含1µmol/L 的蛋白酶抑制剂),4 ℃裂解30 min;4 ℃条件下13 500 r/min离心15 min提取细胞总蛋白,BCA蛋白检测试剂盒测定总蛋白浓度。蛋白变性后,取30µg总蛋白上样,根据蛋白质分子量用8%、10%和15%凝胶电泳分离后转移至聚偏二氟乙烯膜,放入5%血清白蛋白(BSA)中,常温封闭2 h,轻轻摇动以阻断非特异性结合,加入一抗LC3B(1︰2 000)、P62(1︰2 000)、ATG2A(1︰5 000)、ATG9A(1︰5 000)、βactin(1︰5 000),4 ℃孵育过夜,磷酸缓冲盐溶液(PBST)洗膜3 次,每次10 min,加入配好的二抗(兔抗或鼠抗),室温下摇床孵育2 h,PBST 洗涤3 次,每次10 min,化学发光ECL 孵育1 min 后成像系统进行显影,以β-actin 为内参,使用Image Lab 软件对目的条带进行灰度值分析,计算目的蛋白灰度值与β-actin 灰度值的比值,即为目的蛋白的相对表达量,并计算LC3B-Ⅱ/LC3B-Ⅰ。实验重复3 次,取平均值。
1.5 统计学方法 采用SPSS 17.0统计软件。计量资料以±s表示,多组间比较采用单因素方差分析,两两比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞中ATG2A、ATG9A mRNA 相对表达量比较 各组细胞中ATG2A、ATG9A mRNA 相对表达量比较见表1。由表1 可知,与对照组、Baf-A1 组相比,EBSS 组、EBSS + Baf-A1 组细胞中ATG2A、ATG9A mRNA相对表达量均显著升高(P均<0.05),且EBSS+Baf-A1 组细胞中ATG9A mRNA 相对表达量高于EBSS组(P均<0.05)。
表1 各组细胞中ATG2A、ATG9A mRNA相对表达量比较(±s)
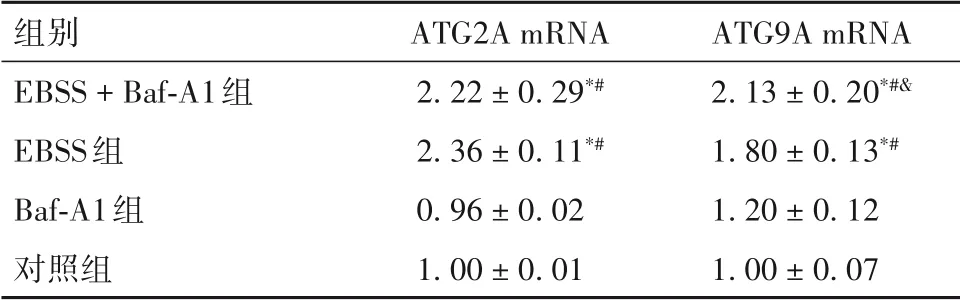
表1 各组细胞中ATG2A、ATG9A mRNA相对表达量比较(±s)
注:与对照组相比,*P<0.05;与Baf-A1组相比,#P<0.05;与EBSS组相比,&P<0.05。
组别EBSS+Baf-A1组EBSS组Baf-A1组对照组ATG2A mRNA 2.22±0.29*#2.36±0.11*#0.96±0.02 1.00±0.01 ATG9A mRNA 2.13±0.20*#&1.80±0.13*#1.20±0.12 1.00±0.07
2.2 各组细胞中ATG2A、ATG9A、P62 蛋白相对表达量及LC3B-Ⅱ/LC3B-Ⅰ比较 各组细胞中ATG2A、ATG9A、P62 蛋白相对表达量及LC3B-Ⅱ/LC3B-Ⅰ比较见表2。由表2可知,与对照组、Baf-A1组相比,EBSS组、EBSS+Baf-A1组细胞中ATG2A蛋白相对表达量均显著升高(P均<0.05);EBSS 组细胞中ATG9A 蛋白相对表达量均高于其余三组(P均<0.05);EBSS 组细胞中P62 蛋白相对表达量均低于其余三组(P均<0.05),EBSS+Baf-A1组P62蛋白相对表达量低于对照组(P均<0.05);EBSS 组细胞中LC3B-Ⅱ/LC3B-Ⅰ均低于其余三组(P均<0.05),EBSS + Baf-A1 组LC3B-Ⅱ/LC3B-Ⅰ均高于其余三组(P均<0.05)。
表2 各组细胞中ATG2A、ATG9A、P62蛋白相对表达量、LC3B-Ⅱ/LC3B-Ⅰ蛋白表达比值比较(±s)

表2 各组细胞中ATG2A、ATG9A、P62蛋白相对表达量、LC3B-Ⅱ/LC3B-Ⅰ蛋白表达比值比较(±s)
注:与对照组相比,*P<0.05;与Baf-A1组相比,#P<0.05;与EBSS组相比,&P<0.05。
组别EBSS+Baf-A1组EBSS组Baf-A1组对照组ATG2A 1.59±0.19*#1.60±0.02*#0.91±0.26 1.00±0.00 ATG9A 1.43±0.10&2.40±0.69*#1.24±0.17 1.00±0.00 P62 0.87±0.04*&0.63±0.09*#0.90±0.07 1.00±0.00 LC3B-Ⅱ/LC3B-Ⅰ2.29±0.19*#&0.67±0.14*#1.19±0.01 1.00±0.00
3 讨论
研究[14-15]显示,LC3的蛋白水解切割是自噬体形成的必要步骤,LC3 有三种亚蛋白LC3A、LC3B 和LC3C,其中LC3B 参与自噬体成熟和自噬体与溶酶体的融合过程,作为自噬的分子标志。LC3 蛋白在细胞内有两种存在形式,分别为胞浆可溶性的LC3-Ⅰ和脂质化形式LC3-Ⅱ,LC3-Ⅱ是惟一一种在吞噬体到溶酶体降解的整个过程中特异性定位于自噬结构的蛋白质,LC3-Ⅱ/LC3-Ⅰ比值的大小可评估自噬水平的高低[16-17]。在自噬过程中,LC3B-Ⅱ在溶酶体中降解是监测自噬过程的标记物,其中结合的LC3B-Ⅱ的增加可能是结合在自噬体上的LC3B-Ⅱ增加或溶酶体降解LC3B-Ⅱ减少,所以需要用Baf-A1 来监测LC3B-Ⅰ和LC3B-Ⅱ的水平变化,输送至溶酶体LC3B-Ⅱ的量反映了正在进行的自噬流的量[18]。P62 是自噬流的重要指标,通过直接结合自噬膜上的LC3B 并被自噬选择性降解[19]。本研究结果显示,饥饿可诱导自噬,饥饿时LC3B-Ⅱ/LC3B-Ⅰ和P62 蛋白表达水平下降,LC3B-Ⅱ和P62 蛋白通过溶酶体途径降解,Baf-A1 对自噬体和溶酶体结合的抑制导致LC3B-Ⅱ积累和P62 蛋白表达水平恢复至对照组水平,这种积累代表着在饥饿期间通过自噬降解的LC3B-Ⅱ和P62 的量。本研究结果与以下研究发现相符:短时间饥饿后,LC3-Ⅰ的量减少,LC3-Ⅱ的量增加,当细胞遭受更长时间的饥饿,LC3-Ⅰ和LC3-Ⅱ都会消失[20];饥饿期间P62表达显著减少,加入自噬抑制剂Baf-A1 后P62 积累[21,16]。同时LC3B-Ⅱ的增加与P62 的降低并不具有一致性,要想正确评价自噬流受阻或自噬系统受损应当检测LC3B 的转化,也要检测可溶性和不可溶性P62 的变化[22]。由此表明,EBSS 可成功诱导MDA-MB-231 细胞发生自噬。
ATG2A 定位于吞噬泡和内质网的交界处,参与自噬膜形成,促进自噬体的延伸与闭合[9,23]。本研究结果中,在MDA-MB-231 细胞中ATG2A 促进自噬,这与YUSUKE 等[11,24]的研究结果一致,在HeLa 细胞中,ATG2A 是惟一上调的ATG 基因,且ATG2A 的缺乏将HeLa 细胞和白血病细胞从细胞保护性自噬转变为凋亡。在哺乳动物细胞中,ATG2A 的缺失会导致自噬流量的阻断并积累未成熟自噬体膜,这些膜通过细胞内死亡诱导信号复合物促进Caspase-8 激活以响应营养缺乏,通过抑制自噬体的形成来选择性地阻断自噬通量,将细胞保护性自噬转化为细胞凋亡[11]。研究[25]表明,高水平的ATG2A 与肝癌患者的生存期差有关,而ATG2A 沉默显著抑制肝癌细胞的恶性程度,ATG2A 作为肝癌的一个潜在的新型治疗靶点。自噬通过提供肿瘤微环境中细胞增殖和代谢所需能量来促进肿瘤生长,高自噬通量与患者预后差、转移增强和化疗耐药有关。因此,通过靶向ATG2A 对自噬体膜形成的作用,抑制自噬体膜闭合可能是一种新的癌症治疗靶点。
ATG9 是ATG 核心蛋白中惟一的跨膜蛋白,对自噬体膜的形成和延伸具有重要作用[26]。ATG9 分为A、B两型,其中ATG9A 一般存在于高尔基体膜和内体中,在饥饿期间,被运输到自噬体形成位点[27]。本研究发现在饥饿诱导的MDA-MB-231 细胞自噬中,ATG9A mRNA 和蛋白相对表达量显著上升。分析其原因,有以下两个方面:第一是PI3P 促进ATG9A 运载并定位膜到自噬小体[28],本实验中饥饿诱导后自噬水平升高,因此ATG9A 表达上升;第二是饥饿或雷帕霉素处理期间ATG9 囊泡合成增加可能有助于自噬活性的上调[29],与本研究结果一致。因此,ATG9A 在自噬小体形成阶段起着重要的作用,因此在本研究中ATG9A 可作为自噬检测的重要影响因子,同时也作为三阴性乳腺癌治疗的潜在靶点。
综上所述,EBSS 成功诱导MDA-MB-231 细胞发生自噬,饥饿诱导的MDA-MB-231 细胞自噬过程中ATG2A、ATG9A 基因表达升高,可作为三阴性乳腺癌治疗的潜在靶点。本研究对ATG2A 和ATG9A 在EBSS 处理MDA-MB-231 细胞自噬过程中的作用进行了初步的探讨,但是两个基因在该细胞中自噬的分子机制需要进一步研究。我们将进一步探索其蛋白后修饰对自噬的调控作用,以及借用siRNA 干扰技术分别敲降以上两个基因的表达水平,探索其在不同乳腺癌细胞的具体分子机制,进一步找出三阴性乳腺癌MDA-MB-231细胞的分子靶点。自噬可以支持细胞在各种应激如饥饿或缺氧的反应中存活,同时自噬也有作为抗癌靶点的潜力。靶向自噬相关蛋白和自噬可以为靶向易受内质网应激影响的肿瘤细胞提供一种新的协同机制[30]。
