β-桉叶醇体外对IEC-6细胞增殖和迁移的影响*
2021-08-25任燕罗春丽蒋雯文黄明进谢丹
任燕 罗春丽 蒋雯文 黄明进 谢丹
(贵州大学,贵州 贵阳 550025)
白术RhizomaAtractylodisMacrocephalae能益气健脾且燥湿,是一种对不明原因肠炎有效的传统中药,β-桉叶醇是白术中一种活性成分。为了证实β-桉叶醇具有修复肠膜的功效,本文选取IEC-6细胞作为实验对象,IEC-6细胞是胃肠粘膜修复药理实验的适宜细胞模型[1],肠上皮细胞IEC-6细胞来源于大鼠小肠隐窝细胞,是肠道屏障的关键组成部分,具有阻止抗原、毒素和有害微生物从肠腔转移到循环中的作用[2-3]。IEC-6细胞常用于体外建立胃肠粘膜损伤修复模型[4]。本研究我们假设β-桉叶醇可能通过多胺介导的信号通路调节Ca2+,从而调节IEC-6的增殖和迁移,为β-桉叶醇胃肠黏膜损伤修复作用机制研究提供参考。为了证实这一假设,我们采用MTT法、划痕法、流式细胞术及蛋白印迹法等研究β-桉叶醇对IEC-6细胞增殖和迁移的影响,通过检测细胞内ODC和Ca2+浓度、TRPC1mRNA和蛋白的表达,以及对细胞周期的影响探讨β-桉叶醇对胃肠粘膜损伤的修复作用的可能机制。
1 实验材料
1.1细胞系 IEC-6细胞系,购自中国模式培养收集中心(CCTCC)。
1.2试剂 β-桉叶醇(10 mg,批号:ZT-70925)购于中国四川省药检所;RPM 1640培养基(美国圣路易斯Sigma化工公司);0.25%胰蛋白酶/EDTA;双抗;胰蛋白酶(美国大岛Gibco Life Technologies);胎牛血清(中国兰州民海生物科技有限公司);MTT和DMSO(Sigma Chemical Co.);TNF-α及ODC酶联免疫吸附试剂盒(上海甄准生物科技有限公司);二甲基亚砜(DMSO);PBS缓冲液;甲氨蝶呤(MTX);EB(溴化乙锭)。
2 实验方法
2.1对IEC-6细胞增殖的影响 培养细胞是在37℃的含5%CO2的加湿空气中进行。在RPM 1640培养基中添加10%热灭活胎牛血清(FBS)和庆大霉素。取对数生长期的细胞,PBS洗涤2次,胰蛋白酶消化,1000 rpm离心5 min,吸除上清液,加入适量培养基使其成为单细胞悬液;用血球计数板对该单细胞悬液所含细胞进行计数,调节细胞密度5×104mL,100 μL/孔接种于96孔板中,每组设置6个重复,37℃,5% CO2恒温培养,待细胞贴壁后,分别将已稀释的不同浓度(0 mol·L-1、10 mol·L-1、20 mol·L-1、40 mol·L-1、80 mol·L-1、160 mol·L-1)的 β-桉叶醇(无血清培养基配药)加入各相应孔中,放入孵箱,培养24 h后,吸弃上清,每孔加入200μL终浓度为0.5 mg·mL的MTT溶液;并轻轻晃动培养板数次,37℃,5% CO2恒温继续培养4h;吸弃液体,每孔加入150 μL DMSO,避光振荡10 min,用酶标仪测定其在492 nm处的吸光度值。用以下公式计算细胞增殖率:增殖率(%)=[1-A492 nm(处理细胞)/A492 nm(对照细胞)]×100%。
2.2对IEC-6细胞增殖的影响 取对数生长期的细胞,用PBS清洗,胰蛋白酶消化,1000 rpm离心5 min,吸除上清液,加入适量培养基使其成为单细胞悬液;用血球计数板对该单细胞悬液所含细胞进行计数,调节细胞密度1×105mL,2 mL/孔接种于6孔板中,每组设置3个重复,37℃,5% CO2恒温培养,待细胞贴壁后,将实验组分为2组(β-桉叶醇组和空白对照组),分别加入相应的药物成分,放入孵箱,培养24 h后,吸弃上清,用PBS洗涤细胞2次,终止消化,将细胞液移入1.5 mL管中,1000 rpm离心5 min,吸除上清液,PBS洗涤2次,吸除上清液,用于ELISA检测ODC。
2.3对IEC-6细胞内Ca2+浓度的影响 细胞培养同上,加入适量培养基使其成为单细胞悬液;用血球计数板对该单细胞悬液所含细胞进行计数,调节细胞密度1×105mL,2 mL/孔接种于6孔板中,每组设置3个重复,37℃,5% CO2恒温培养,待细胞贴壁后,将实验组分为2组(β-桉叶醇组和空白对照组),放入孵箱,培养24 h后,吸弃上清,用PBS洗涤细胞2次,终止消化,将细胞液移入1.5 mL管中,1000 rpm×5 min离心,吸除上清液,采用不含Ca2+、Mg2+的D-Hanks缓冲液洗涤2次,吸除上清,然后加入适量含有fluo-3/AM的D-Hanks缓冲液(fluo-3/AM终浓度为1μM),置于37℃避光孵育30 min,用-Hanks缓冲液轻洗2次,再加入D-Hanks缓冲液,37℃,继续孵育20 min,将每个样品移入流式细胞仪反应杯,用流式细胞仪测定细胞内Ca2+含量。
2.4对IEC-6细胞各组间冲沟距离的影响 用PBS清除对数生长的IEC-6细胞,胰蛋白酶消化,吸入15 mL塑料离心管,1000 rpm×5 min离心,吹打成单细胞悬液。用血球计数板对该单细胞悬液所含细胞进行计数,将细胞密度调至2×105mL-1,接种于6孔板中,6孔培养板背面每隔0.5 cm划横线,然后将6孔培养板置于37℃和5%CO2培养箱中过夜,待贴壁细胞后,取上清液,用200 μL移液管吹扫垂直沟道,用PBS清洗两次,清除脱落细胞,取对数生长期的细胞, PBS洗涤,胰蛋白酶消化,1000 rpm离心5 min,吸除上清液,加入适量培养基使其成为单细胞悬液;用血球计数板对该单细胞悬液所含细胞进行计数,调节细胞密度2×105mL-1,2 mL/孔接种于6孔板中,6孔板背面提前用马克笔每隔0.5 cm划线,每孔至少5条线,每组设置3个重复,37℃,5% CO2恒温培养,待细胞长至单层,吸除上清液,使用200 μL枪头比着直尺,垂直于背后横线划痕,用PBS洗涤2次,去除划下细胞,加入β-桉叶醇和2%FBS,放入孵箱,在100 μx0005 μ显微镜下拍摄,随机取5个场,于0 h、24 h拍照。利用PS软件和motic软件计算各间沟间距离。
2.5对IEC-6细胞周期的影响 取对数生长期的细胞,用PBS清洗,胰蛋白酶消化,1000 rpm离心5 min,吸除上清液,加入适量培养基使其成为单细胞悬液;用血球计数板对该单细胞悬液所含细胞进行计数,调节细胞密度1.3×105mL-1,2 mL/孔接种于6孔板中,每组设置3个重复,37℃,5% CO2恒温培养,待细胞贴壁后,将实验组分为2组(β-桉叶醇组和空白对照组),分别加入相应的药物成分,放入孵箱,培养24 h后,吸弃上清,用PBS洗涤细胞2次,用细胞上清液终止消化,将细胞液移入1.5 mL管中,1000 rpm离心5 min,吸除上清液,PBS洗涤2次,吸除上清液,加入500 μL体积分数为70%的冷乙醇,4℃固定过夜;27000 rpm离心5 min,吸弃上清,用PBS洗涤2次,加入配制好的500 μL PI/RNase A 染色工作液(临用时将 Rnase A:PI 工作液按 1:9 体积配制),室温避光 30 min后,用流式细胞仪分析结合量。
2.6对细胞TRPC1蛋白基因表达的影响 细胞培养同上,收集细胞离心,将细胞重新悬浮在1毫升的PBS中,分成4个微管离心。去除上清液,洗涤细胞两次,后向每管加入RIPA 裂解液,置碎冰上裂解10 min;收集裂解液,4℃,离心,取上清液,用BCA蛋白定量试剂盒测定蛋白浓度。并将细胞裂解液与5个SDS-PAGE加载缓冲液混合。将等量的蛋白质在95℃下加热10分钟,然后在预制的7-15%十二烷基硫酸钠聚丙烯酰胺凝胶上分离。将蛋白质电转移到硝酸纤维素膜中,该膜在Tris缓冲盐水加含5%脱脂奶粉的0.05%吐温-20(TBS-T)中封闭1 h。将膜在TBS-T中洗涤,并在含1%脱脂牛奶的TBS-T中与原代单克隆抗体在4℃下孵育过夜。将PVDF膜放入一抗中,4℃孵育过夜;用TBST将PVDF膜洗3次,每次5 min;后将PVDF膜放入二抗中,室温孵育2-3 h;用TBST将PVDF膜洗3次,每次10 min。将PVDF膜平铺到保鲜膜上,将ECL发光液的A、B两种试剂等体积混合后,均匀的滴加到膜上,反应1 min后,将膜移至另一保鲜膜上,去尽残液,包好,放入暗室中,曝光,用凝胶图像分析成像系统进行扫描分析,结果以目的蛋白相对表达量表示。目的蛋白相对表达量=目的蛋白积分光密度值(IOD)/内参积分光密度值(IOD),各样本蛋白质水平与GAPDH相关。
2.7对细胞TRPC1蛋白基因表达的影响 细胞培养同上,收集细胞,离心,将颗粒重新悬浮在PBS中,分成4个微管离心。将上清液丢弃。从每个样本中提取总RNA,然后使用定量PCR(QPCR)cDNA动物总RNA分离试剂盒将等量RNA反向转录成cDNA。从美国国家生物技术信息中心(NCBI)数据库中搜索基因全序列,使用Primer Premier引物设计软件设计筛选各基因特异性引物。所有引物均交由上海生工生物工程技术服务有限公司设计合成,并以ULTRAPAGE纯化。所有引物在使用前须检查一个扩增产物。将样品在95℃下加热10 min,然后熔化,退火。以GAPDH为参考基因,利用Microsoft Excel软件对实时数据进行采集和分析。在标准的基础上,通过相对定量计算拷贝数。
3 结果
3.1β-桉叶醇对IEC-6细胞增殖的影响 MTT结果显示,与空白组相比,β-桉叶醇浓度在80 μm、160 μm的细胞培养24 h、48 h、72 h,增殖率均无显著性差异(p>0.05)。在10 μm、40 μm(24 h)、10 μm、20 μm(48 h)、10 μm、20 μm(72 h)(p<0.05)上有差异,与空白组比较,β-桉叶醇的20 μm(24 h)浓度有显著差异(p<0.01),结果见表1。
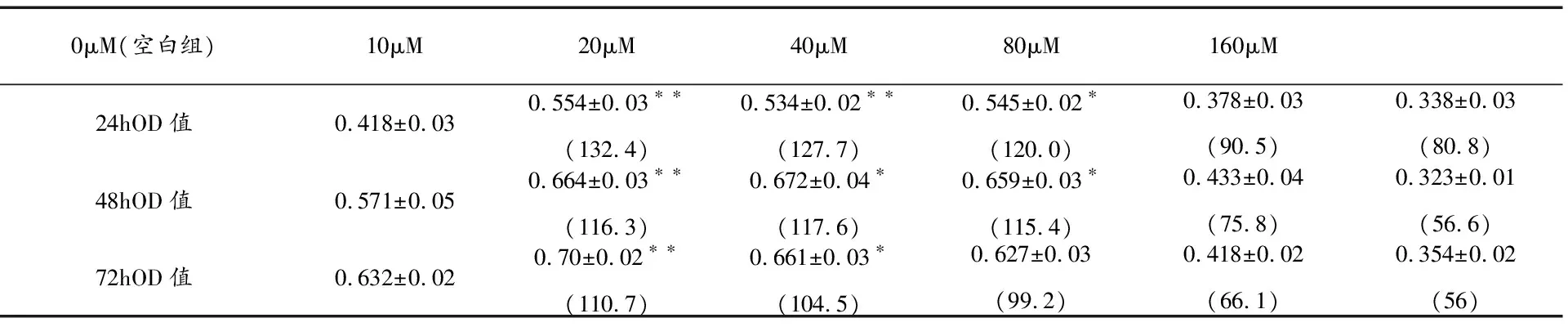
表 1 β-桉叶醇对IEC-6 细胞增殖影响(OD值及增殖率)
3.2β-桉叶醇对IEC-6细胞内ODC含量的影响 ELISA实验结果显示,与空白组比较,IEC-6细胞中ODC浓度β-桉叶醇组(20μm,24 h)有显著性差异(p<0.01)。见表2。
3.3β-桉叶醇对IEC-6细胞内Ca2+浓度的影响结果表明与空白组比较,β-桉叶醇组(20 μm,24 h)有显著性差异(p<0.05)。各组IEC6细胞内Ca2+浓度见表2。
3.4β-桉叶醇对IEC-6细胞各组间冲沟距离的影响 细胞划痕实验结果显示,与0 h相比,β-桉叶醇组(20μM,24 h)有显著性差异(p<0.05),空白组(24 h)与0 h相比无显著性差异(p<0.05)。各组冲沟距离见表2。
表 2 IEC-6细胞内ODC含量
3.5β-桉叶醇对IEC-6细胞周期的影响 结果表明β-桉叶醇组在G1期的OD值明显高于空白组(p<0.01),S期β-桉叶醇组OD值明显低于空白组,数据见表3。
表 3 β-桉叶醇对细胞周期的影响(OD值)
3.6β-桉叶醇对细胞TRPC1蛋白基因表达的影响(Western blot) Western blotting和PCR分析显示(图1)在IEC6细胞中,β-桉叶醇组TRPC1的表达明显高于空白组(p<0.05),结果见表4。
表 4 TRPC1蛋白基因表达值
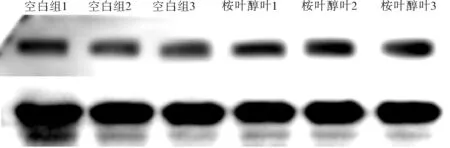
图1 β-桉叶醇对ICE-6细胞TRPC1蛋白基因表达影响的Western印迹结果
4 讨论
本论文研究了β-桉叶醇对IEC-6细胞增殖和迁移的影响。体外MTT结果表明β-桉叶醇处理的IEC-6细胞增殖率明显高于空白组,如表1所示;ELISA实验结果表明,与空白对照组相比,β-桉叶醇处理的IEC-6细胞中ODC浓度高于空白对照组,如表2所示;采用流式细胞仪分析显示细胞内钙离子的含量,结果显示β-桉叶醇组明显高于空白组,如表3所示。划痕实验结果表明β-桉叶醇能快速刺激损伤后IEC-6细胞迁移,对细胞迁移的促进作用明显,如表4所示;采用流式细胞技术研究细胞周期,结果表明,与空白对照组相比,β-桉叶醇(10mol·L-1)处理的IEC-6细胞具有更多的二倍体,在细胞复制中起重要作用,如表5所示;Western blot实验和RT-PCR实验结果表明TRPC1蛋白在β-桉叶醇组中的表达明显高于空白对照组,如表6和表7所示。
鸟氨酸脱羧酶(ODC)是多胺生物合成的限速酶,介导上皮细胞增殖,在胃粘膜损伤的最佳修复中发挥关键作用。精胺、亚精胺、腐胺等多胺可介导胃肠道细胞的生长和分化,并在胃十二指肠粘膜损伤的最佳修复中发挥重要作用[5]。ODC调节多胺的生物合成,它在胃肠道的细胞生长和分化中起着重要的作用,从而促进损伤后的修复[6-7],在高渗氯化钠给药后胃粘膜愈合等条件下,ODC活性增加[8],当细胞内多胺增加时,Kv1.1通道被激活,导致细胞膜电位超极化。研究表明,肠上皮细胞Kv1.1通道的表达依赖于多胺的调节[9-12],细胞膜电位的超极化可增强钙离子内流[13-14],多胺的增加可以增加Ca2+的驱动力,Ca2+通过激活Kv通道而侵入[12],因此增加[Ca2+]cyt,[Ca2+]cyt的增加可促进细胞迁移,这解释了较高浓度的ODC在β-桉叶醇处理的细胞中可增加细胞中Ca2+的浓度,同时也解释了β-桉叶醇促进细胞增殖和迁移,并与影响细胞内多胺合成和细胞内[Ca2+]cyt浓度的增加。TRPC1是调节钙池的钙通道之一,TRPC1介导的CCE(由于储存耗竭引起的钙离子进入称为电容性钙离子进入)是[Ca2+]cyt的重要来源,调节粘膜损伤的早期修复[15],[Ca2+]cyt可刺激细胞迁移并促进早期修复过程。由于非兴奋性细胞不表达VDCC(一种有效的电压依赖性钙通道),[Ca2+]Cyt细胞的增加主要依赖于离子跨膜通道和细胞内钙库介导的Ca2+内流的释放[16,17]。如果[Ca2+]cyt减少,细胞迁移将受到抑制[18-20];当细胞受到相应的刺激时,细胞内游离Ca2+离子浓度增加,[Ca2+]Cyt的相应增加在激活细胞分化、增殖、迁移、蛋白质分泌和免疫应答等生理过程中起着重要的触发和第二信使作用[21]。维持细胞迁移需要稳定升高的[Ca2+]Cyt,这主要取决于细胞外Ca2+的流入。细胞周期[Ca2+]cyt的增加与TRPC1mRNA和蛋白的高表达有关。在分化的肠上皮细胞中,TRPC1mRNA和蛋白质的表达显著高于非分化细胞[22]。CAV1蛋白也可以通过激活TRPC-1介导的Ca2+流入促进粘膜损伤后修复[23]。因此,在肠上皮细胞中,TRPC1具有SOCs(细胞因子信号抑制物)的功能,可受CCE调节,[Ca2+]cyt在损伤后肠粘膜上皮的修复中起重要作用,TRPC-l还可通过与STIMIL、RShOA等蛋白质相互作用影响细胞迁移[24,25]。
本研究结果表明,β-桉叶醇能促进肠上皮细胞的增殖和迁移,β-桉叶醇能促进TRPC1mRNA和蛋白表达,增强TRPC1介导的细胞内Ca2+,提高[Ca2+]Cyt的浓度,而Ca2+在上皮细胞增殖和迁移中发挥着重要作用[20],促进粘膜损伤后修复[23]提示β-桉叶醇是通过促进肠上皮细胞增殖和迁移而促进损伤后IEC-6细胞的修复,因此,β-桉叶醇可能通过增强TRPC1介导的细胞内Ca2+含量,在粘膜损伤修复中发挥重要作用增加细胞多胺合成,增加TRPC1 mRNA和蛋白表达,增加Ca2+流入,从而增加[Ca2+]Cyt,促进细胞增殖和迁移,这可能是β-桉叶醇促进肠黏膜损伤修复的机制之一,本实验除了证实β-桉叶醇对肠黏膜的修复作用外,还部分解释了β-桉叶醇修复肠黏膜的机制。
