平喘颗粒对哮喘小鼠Ⅱ型固有淋巴细胞及巨噬细胞M2 型极化的影响
2021-08-24袁星星田春燕李竹英
王 瑶,袁星星,田春燕,李竹英
(1. 黑龙江中医药大学,黑龙江 哈尔滨 150040;2. 黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;3. 黑龙江省中医药科学院南岗分院,黑龙江哈尔滨 150006)
哮喘是一种由多种炎症细胞、结构细胞及细胞组份共同参与的慢性异质性疾病,以气道炎症、气道高反应性和可逆性气流受限为主要特征[1]。据调查结果显示,全球每年因哮喘死亡的人数高达38万,并且随着工业化的发展和环境污染的加剧还在不断增加,因此哮喘已成为严重的公共卫生问题之一[2,3]。一项纳入67 项横断面研究的荟萃分析结果显示,我国成人哮喘的患病率为1.81%,并且呈现逐年升高的趋势[4]。因此,有效控制哮喘的发病对于提高哮喘患者生存质量和减轻社会经济负担具有重要的意义。
巨噬细胞作为抵御病原微生物入侵的第一道防线,能够通过多种途径在宿主防御、炎症反应和组织修复中发挥重要的作用[5]。肺组织巨噬细胞是呼吸系统中重要的免疫细胞之一,通过极化成不同的表型从而参与炎症的发生与控制[6]。Ⅱ型固有淋巴细胞(type 2 innate lymphoid cells,ILC2)是先天免疫系统中重要的效应细胞,有研究证实其能够通过调控肺泡巨噬细胞的M2 型极化,从而促进肺上皮干细胞的增殖和分化和肺组织发育[7-9]。因此,本研究通过观察哮喘小鼠肺组织中ILC2 和M2 型肺泡巨噬细胞数量的变化,从而进一步明确平喘颗粒抑制哮喘气道炎症、改善气道重塑的作用机制。
1 材料与方法
1.1 实验动物
清洁级C57BL/6 小鼠(雌性,6~8 周龄),体质量18~20 g,购于北京Charles River 公司(实验动物生产许可证:SCXK(京)2016-0011)。饲养条件:温度:23℃~25℃,湿度:46%~56%,自由饮水、摄食,同时给予光照12 h。实验过程严格遵循科技部颁发的《关于善待实验动物的指导性意见》中的有关规定[10]。
1.2 药物与试剂
平喘颗粒(组成:淫羊藿、炙麻黄、太子参、黄芪、五味子、款冬花、地龙、罂粟壳和知母按照4∶2∶3∶3∶3∶3∶2∶1∶2 的比例),实验灌胃前制备成含药量为1 080 g/L 的溶液;氢氧化铝佐剂购于美国赛默飞公司(货号:77161);卵清蛋白购于美国Sigma公司(货号:A5253,纯度:62%~88%);抗白介素33(interleukin 33,IL-33)、肿瘤发生抑制蛋白2(suppression of tumorigenicity 2,ST2)、Linage、干 细胞 抗 原1(stem cell antigen 1,SCA-1)、CD90.2、CD11b、F4/80、CD206 和 炎 症 区 域(found in inflammatory zone 1,FIZZ1)抗体均购于美国Abcam 公 司(货 号:ab187060、ab25877、ab93898、ab236486,ab269343,ab184307,ab16911,ab125028、ab271225);抗精氨酸酶-1(arginase-1,Arg1)、β-actin抗体和辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗均购于美国CST 公司(货号:#13120、#93668、#4970、#7076);苏木素伊红染色试剂盒(Hematoxylin-Eosin,HE)、过碘酸-雪夫染色液试剂盒(periodic acid schiff,PAS)和Masson 三色染色试剂盒均购于北京索莱宝科技有限公司(货号:G1120、G1281、G1340);小 鼠IL-4、IL-5、IL-13 和IL-33 酶联免疫吸附实验(ELISA)试剂盒购于江苏酶免实业有限公司(货号:MM-0165M2、MM-0164M2、MM-0173M2MM-0935M2);SYBR Premix Ex Taq 试剂盒和转录试剂盒购于日本Takara 公司(货号:RR420、639503)。
1.3 方法
1.3.1 分组与造模 小鼠按照体重随机分为空白组、模型组、平喘颗粒组和IL-33 组,每组10 只。除空白组外,余下3 组小鼠参照课题组前期研究造模的方法构建哮喘小鼠模型[11],具体方法如下:分别于实验的第1 天、第7 天和第14 天将含有2.5 mg 的氢氧化铝佐剂和25 μg 的OVA 的生理盐水250 μL腹腔注射,并于实验的21~27 d 采用2%OVA 连续雾化激发,1 次/d,每次30 min。而空白组小鼠则给予等剂量的生理盐水腹腔注射和雾化替代致敏和激发。同时,分别于实验的第1 天起,各组给予相应的药物进行干预,其中平喘颗粒组给予31.2 g/kg 的平喘颗粒水溶液进行灌胃治疗,IL-33 组于第1 天、第7 天 和 第14 天 致 敏 后1 h 给 予10 μg/kg 的IL33 中和抗体进行气管滴注,而空白组和模型组小鼠则给予等体积的生理盐水灌胃和气管滴注替代治疗,每日一次,连续治疗14 d。各组小鼠于末次雾化激发后24 h,以1%戊巴比妥钠40 mg/kg 腹腔注射麻醉后收集肺泡灌洗和肺组织用于指标检测。
1.3.2 肺组织病理学 取右肺组织固定于10%甲醛中,24 h 后乙醇脱水,二甲苯透明,石蜡包埋后制备切片。按照染色试剂盒说明书分别进行HE、PAS 和Masson 染色,并在光镜下观察肺组织病理学改变。参照文献[11]中方法,通过HE 染色评估支气管炎性细胞浸润并对其进行评分;同时,采用Image J 软件计算PAS 阳性染色面积和气道胶原染色面积,并对其进行评分。
1.3.3 酶联免疫吸附实验 将收集到的肺泡灌洗液静置后1 500 r/min 离心10 min,取上清,采用ELISA 法检测各组小鼠肺泡灌洗液中IL-4、IL-5、IL-13 和IL-33 的含量。实验步骤严格参照试剂盒说明书进行操作。
1.3.4 实时荧光定量聚合酶链式反应(qRT-PCR) 取适量肺组织,加入预冷的Trizol 溶液提取总RNA,凝胶电泳和分光光度计检测RNA分子量和纯度。取8 μL 总RNA,加入反转录反应液后42℃孵育60 min 合成cDNA。以cDNA 为模板进行扩增,按照SYBR Premix Ex Taq 试剂盒说明书将各试剂进行混匀后上机检测。PCR 引物序列如 下,IL-4:上 游:5′-TACCAGGAGCCA TATCCACGGATG-3′,下游:5′-TGTGGTGTTCTTCGTTGCTGTGAG-3′,长 度183 bp;IL-5:上 游:5′-GGCCACTGCCATGGAGATTCC-3′,下 游:5′-AGCCTCAT CGTCTCATTGCTTGTC-3′,长 度340 bp;IL-13:上 游:5′-CGGCAGCATGGTAT GGAGTGTG-3′,下 游:5′-GGAGGCTGGAGACCGTAGTGG-3′,长 度123 bp;IL-33:上游:5′-CAATCAGGCGACGGTGTGGATG-3′,下 游 : 5′-GGAGTAGTCCTTGTC GTTGGCATG-3′,长 度 247 bp;GAPDH:上 游:5′-GGGTGTGAACCACGAGA AAT-3′,下 游:5′-CCTTCCACAATGCCAAAGTT-3′,长度191 bp。扩增条件:95 ℃30 s,95 ℃5 s,60 ℃30 s,共40个循环。以GAPDH为内参基因,以目标基因与GAPDH扩增产物的2–ΔΔCt比值分析计算各个组的表达情况。
1.3.5 流式细胞术 取适量肺组织研磨后以细胞过滤器过滤后置于EP 管中,加入铵-氯-钾裂解缓冲液与冰上裂解细胞悬液中的红细胞,离心弃上清,加入1 mL 的磷酸缓冲盐溶液洗涤后继续离心弃上清。加入磷酸缓冲盐溶液以制备单细胞悬液,并调整细胞浓度。分别以Linage、SCA-1 和CD90.2 标记为ILC2,CD11b、F4/80 及CD206 标记M2 型巨噬细胞,4 ℃避光孵育30 min。离心弃上清,加入200 μL磷酸缓冲盐溶液后以40 μL 的多聚甲醛固定,上机检测,并应用CytExpert 软件对数据进行处理及分析。
1.3.6 蛋白免疫印迹实验(Western blot) 取适量肺组织剪碎后冰上裂解,离心取上清,BCA 法测定蛋白浓度,上样,电泳,转膜,5%脱脂牛奶室温封闭1 h,TBST 洗膜3 次,每次5 min,加入稀释的ST-2,FIZZ1、Arg-1 和β-actin 抗体,4℃孵育过夜,TBST洗膜后加入HRP 标记的二抗于37℃继续孵育1 h,加入适量ECL 显影,于凝胶成像系统中分析目的蛋白的相对表达量。
1.4 统计学处理
采用SPSS23.0 软件对实验数据进行分析,数据均以均数±标准差(±s)的形式表示。多组间的比较采用单因素方差分析(ANOVA),组间两两的比较采用LSD 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 平喘颗粒对气道炎症及胶原沉积的影响
造模后小鼠气道周围可见大量的炎症细胞浸润伴有管腔狭窄,同时可见大量的杯状细胞化生和胶原沉积,与空白组相比,模型组炎症评分、PAS 评分和胶原染色面积明显增加,差异均具有统计学意义(P<0.05)。平喘颗粒组和IL-33 组气道周围炎症细胞浸润、杯状细胞化生和胶原沉积情况明显改善,其中炎症评分、PAS 评分和胶原染色面积与模型组比较明显降低,差异均具有统计学意义(P<0.05)。见图1、表1。
表1 平喘颗粒对哮喘小鼠气道炎症及胶原沉积的影响(n=10,±s)Tab 1 Effect of Pingchuan granules on airway inflammation and collagen deposition in asthmatic mice(n=10,±s)
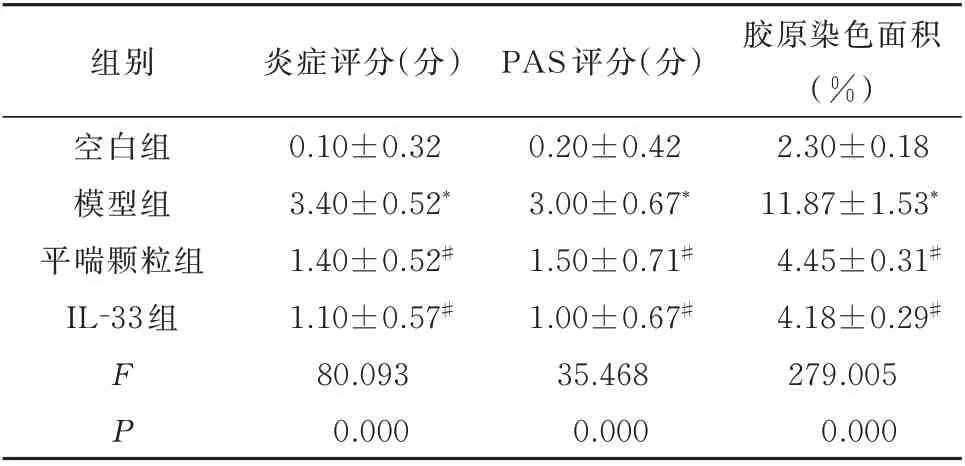
表1 平喘颗粒对哮喘小鼠气道炎症及胶原沉积的影响(n=10,±s)Tab 1 Effect of Pingchuan granules on airway inflammation and collagen deposition in asthmatic mice(n=10,±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。
组别空白组模型组平喘颗粒组IL-33 组胶原染色面积(%)2.30±0.18 11.87±1.53*4.45±0.31#4.18±0.29#279.005 0.000 FP炎症评分(分)0.10±0.32 3.40±0.52*1.40±0.52#1.10±0.57#80.093 0.000 PAS 评分(分)0.20±0.42 3.00±0.67*1.50±0.71#1.00±0.67#35.468 0.000

图1 平喘颗粒对哮喘小鼠气道炎症及胶原沉积的影响Fig 1 Effect of Pingchuan granule on airway inflammation and collagen deposition in asthmatic mice
2.2 平喘颗粒对肺泡灌洗液中IL-4、IL-5、IL-13 和IL-33 蛋白表达的影响
与空白组相比,模型组肺泡灌洗液中IL-4、IL-5、IL-13 和IL-33 的含量显著增加,差异均具有统计学意义(P<0.05)。平喘颗粒和IL-33 均能明显抑制肺泡灌洗液中炎性细胞因子的含量,与模型组比较,平喘颗粒组和IL-33 组肺泡灌洗液中IL-4、IL-5、IL-13 和IL-33 的含量明显降低,差异均具有统计学意义(P<0.05)。见表2。
表2 平喘颗粒对肺泡灌洗液中IL-4、IL-5、IL-13 和IL-33 蛋白表达的影响(pg/mL,n=10,±s)Tab 2 Effect of Pingchuan granules on IL-4,IL-5,IL-13 and IL-33 protein expression in alveolar lavage fluid(pg/mL,n=10,±s)
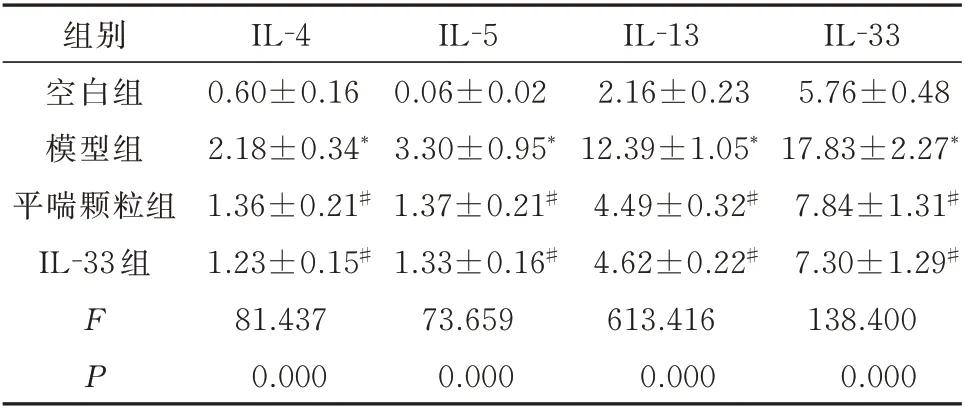
表2 平喘颗粒对肺泡灌洗液中IL-4、IL-5、IL-13 和IL-33 蛋白表达的影响(pg/mL,n=10,±s)Tab 2 Effect of Pingchuan granules on IL-4,IL-5,IL-13 and IL-33 protein expression in alveolar lavage fluid(pg/mL,n=10,±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。
组别空白组模型组平喘颗粒组IL-33 组IL-33 5.76±0.48 17.83±2.27*7.84±1.31#7.30±1.29#138.400 0.000 FP IL-4 0.60±0.16 2.18±0.34*1.36±0.21#1.23±0.15#81.437 0.000 IL-5 0.06±0.02 3.30±0.95*1.37±0.21#1.33±0.16#73.659 0.000 IL-13 2.16±0.23 12.39±1.05*4.49±0.32#4.62±0.22#613.416 0.000
2.3 平喘颗粒对肺组织中IL-4、IL-5、IL-13 和IL-33 mRNA 表达的影响
与肺泡灌洗液中炎症细胞因子的趋势相同,模型 组 肺 组 织 中IL-4、IL-5、IL-13和IL-33mRNA 的表达较空白组明显增加,差异均具有统计学意义(P<0.05)。而平喘颗粒组和IL-33 组肺组织中IL-4、IL-5、IL-13和IL-33mRNA 的表达明显降低,差异均具有统计学意义(P<0.05)。见表3。
表3 平喘颗粒对肺组织中IL-4、IL-5、IL-13 和IL-33 mRNA 表达的影响(n=10,±s)Tab 3 Effect of Pingchuan Granules on the expression of IL-4,IL-5,IL-13 and IL-33 mRNA in lung tissue(n=10,±s)
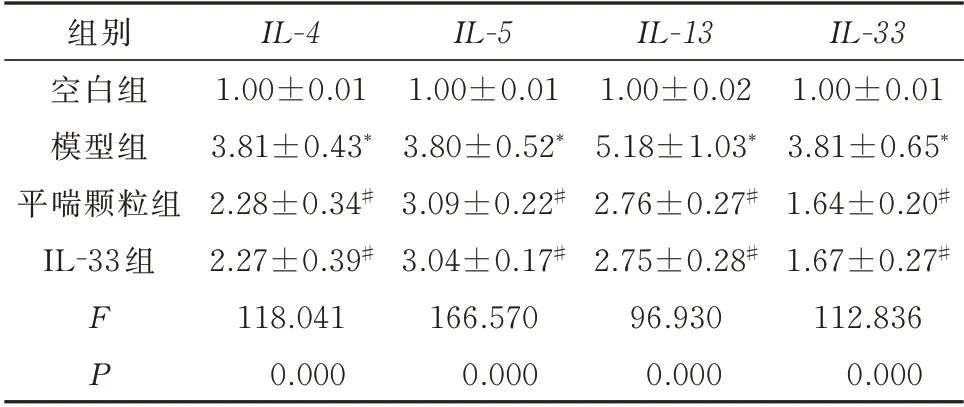
表3 平喘颗粒对肺组织中IL-4、IL-5、IL-13 和IL-33 mRNA 表达的影响(n=10,±s)Tab 3 Effect of Pingchuan Granules on the expression of IL-4,IL-5,IL-13 and IL-33 mRNA in lung tissue(n=10,±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。
组别空白组模型组平喘颗粒组IL-33 组IL-33 1.00±0.01 3.81±0.65*1.64±0.20#1.67±0.27#112.836 0.000 FP IL-4 1.00±0.01 3.81±0.43*2.28±0.34#2.27±0.39#118.041 0.000 IL-5 1.00±0.01 3.80±0.52*3.09±0.22#3.04±0.17#166.570 0.000 IL-13 1.00±0.02 5.18±1.03*2.76±0.27#2.75±0.28#96.930 0.000
2.4 平喘颗粒对肺组织中ILC2 和M2 型巨噬细胞数量的影响
与空白组比较,模型组小鼠肺组织中ILC2 和M2 型巨噬细胞的数量显著增加,差异均具有统计学意义(P<0.05)。平喘颗粒和IL-33 均能明显降低肺组织中ILC2 和M2 型巨噬细胞的数量,与模型组比较,差异均具有统计学意义(P<0.05)。见图2、表4。
表4 平喘颗粒对肺组织中ILC2 和M2 型巨噬细胞数量的影响(%,n=10,±s)Tab 4 Effect of Pingchuan granules on the number of ILC2 and M2 macrophages in lung tissue(%,n=10,±s)
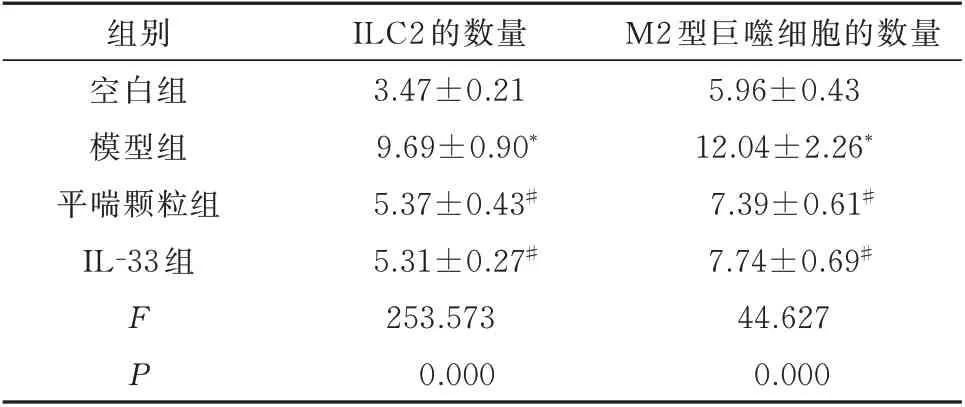
表4 平喘颗粒对肺组织中ILC2 和M2 型巨噬细胞数量的影响(%,n=10,±s)Tab 4 Effect of Pingchuan granules on the number of ILC2 and M2 macrophages in lung tissue(%,n=10,±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。
组别空白组模型组平喘颗粒组IL-33 组M2 型巨噬细胞的数量5.96±0.43 12.04±2.26*7.39±0.61#7.74±0.69#44.627 0.000 FP ILC2 的数量3.47±0.21 9.69±0.90*5.37±0.43#5.31±0.27#253.573 0.000
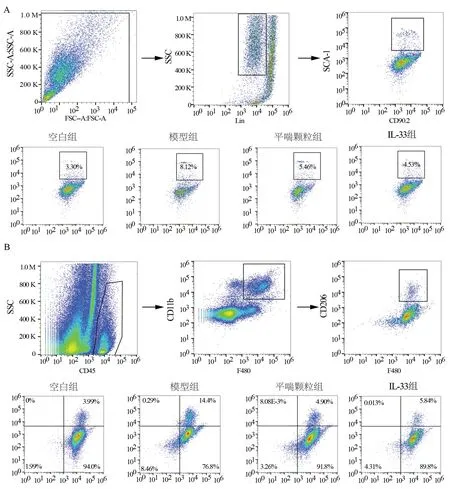
图2 平喘颗粒对肺组织中ILC2 和M2 型巨噬细胞数量的影响Fig 2 The effect of Pingchuan granule on the number of ILC2 and M2 macrophages in lung tissue
2.5 平喘颗粒对ST-2、FIZZ1 和Arg-1 蛋白表达的影响
与空白组相比,模型组肺组织中ST-2、FIZZ1和Arg-1 蛋白的表达显著增加,差异均具有统计学意义(P<0.05)。平喘颗粒和IL-33 均能明显降低肺组织中ST-2、FIZZ1 和Arg-1 蛋白的表达,与模型组比较,差异均具有统计学意义(P<0.05)。见表5、图3。
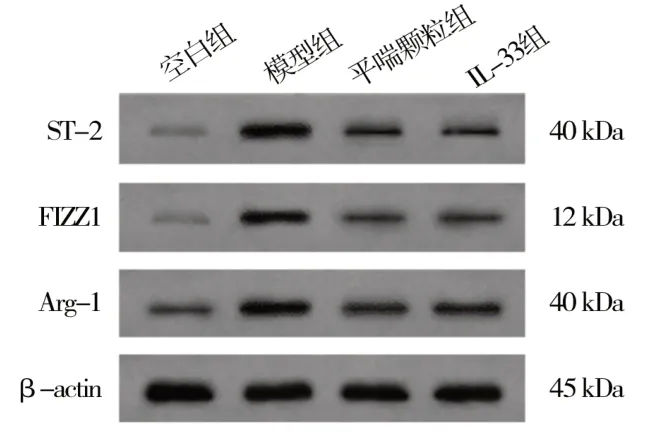
图3 平喘颗粒对ST-2、FIZZ1 和Arg-1 蛋白表达的影响Fig 3 Effect of Pingchuan granules on the expression of ST-2,FIZZ1 and Arg-1 protein
表5 平喘颗粒对ST-2、FIZZ1 和Arg-1 蛋白表达的影响(n=10,±s)Tab 5 Effect of Pingchuan granules on ST-2,FIZZ1 and Arg-1 protein expression(n=10,±s)
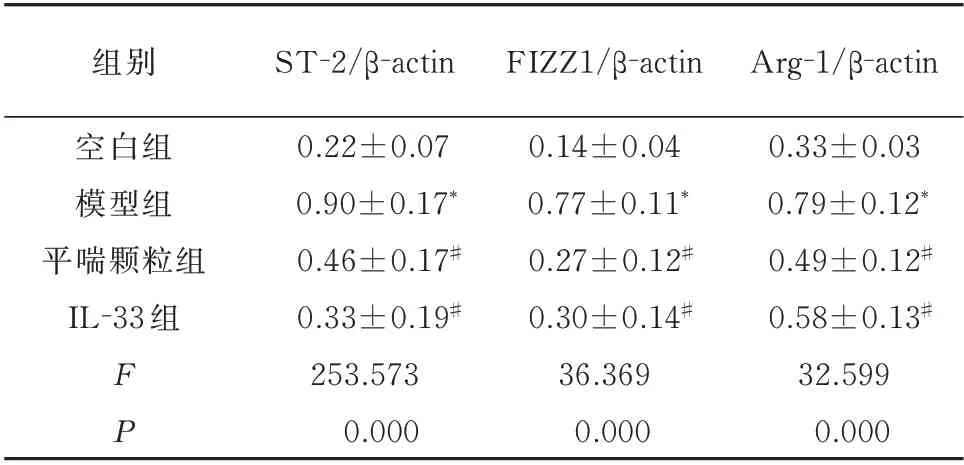
表5 平喘颗粒对ST-2、FIZZ1 和Arg-1 蛋白表达的影响(n=10,±s)Tab 5 Effect of Pingchuan granules on ST-2,FIZZ1 and Arg-1 protein expression(n=10,±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。
组别空白组模型组平喘颗粒组IL-33 组Arg-1/β-actin 0.33±0.03 0.79±0.12*0.49±0.12#0.58±0.13#32.599 0.000 FP ST-2/β-actin 0.22±0.07 0.90±0.17*0.46±0.17#0.33±0.19#253.573 0.000 FIZZ1/β-actin 0.14±0.04 0.77±0.11*0.27±0.12#0.30±0.14#36.369 0.000
3 讨论
固有淋巴细胞(innate lymphoid cells,ILCs)是一类新发现的具有淋巴细胞特征而又不同于B 细胞和T 细胞的淋巴细胞群体,主要分布于淋巴器官、非淋巴器官、黏膜组织及血液中,作为Th2 的“镜像细胞”在哮喘气道炎症中发挥着重要的作用[12]。ILC 起源于共同淋巴样祖细胞并在多种细胞因子的作用下,经过自然杀伤细胞前体细胞和共同辅助性固有淋巴样细胞前体细胞阶段后,最终发育成ILCs。根据转录因子的不同,ILCs 可分为ILC1、ILC2 和ILC3 三个亚群,其中ILC2 以不表达或者低表达Lineage 识别分子和高表达SCA1、CD90.2 和c-Kit 等 表 面 分 子 为 主 要 特 征[13-15]。ILC2 亚 群 通 过表达转录因子维甲酸相关孤儿受体γt(retinoid-related orphan receptor γt,RORγt)并 分 泌IL-4、IL-5和IL-13 等Th2 型炎性细胞因子从而影响哮喘的发生与发展。作为ILC2 的经典活化因子,IL-33 通过与细胞表面的ST-2 受体结合,从而激活ILC2 并分泌大量Th2 型炎症因子[16]。本研究结果显示,平喘颗粒能够减少哮喘小鼠模型肺泡灌洗液中和肺组织中IL-4、IL-5、IL-13 和IL-33 的表达,下调肺组织中ST-2 蛋白和ILC2 的数量,从而抑制ILC2 的活化。
巨噬细胞是肺组织中最丰富的免疫细胞群,主要包括肺间质巨噬细胞和肺泡巨噬细胞,其中肺泡巨噬细胞与哮喘的关系最为密切[17]。免疫微环境对肺泡巨噬细胞的功能具有主要的作用,呼吸道过敏原通过激活肺上皮细胞或其他免疫细胞群从而释放多种细胞因子影响肺泡巨噬细胞的迁移与极化。根据巨噬细胞激活的后的功能状态,可以将其分为经典激活型(M1 型)和替代激活型(M2 型)两种类型,其中M2 型巨噬细胞主要由IL-4 和IL-13 诱导。有研究证实,M2 型巨噬细胞过度活化会增加炎症细胞募集、增加黏液分泌以及气道高反应性,而抑制M2 巨噬细胞的活化能够明显减轻曲霉孢子所引起的气道高反应性和气道炎症[18]。此外,还有研究表示,M2 型巨噬细胞还可以通过高表达FIZZ1及Arg-1 从而参与哮喘气道重塑[19]。因此研究巨噬细胞的极化在哮喘中的作用,尤其是平喘颗粒对M2 型巨噬细胞的影响,对了全面阐释平喘颗粒抑制哮喘气道重塑的作用具有十分重要的意义。本研究结果显示,平喘颗粒能够显著降低肺组织中M2 型巨噬细胞的数量,同时下调肺组织中FIZZ1和Arg-1 蛋白的表达。
平喘颗粒由淫羊藿、炙麻黄、太子参、黄芪、五味子、款冬花、地龙、罂粟壳和知母组成,是导师李竹英教授治疗哮喘缓解期的经验处方,具有益气温阳、化痰平喘的功效[20]。方中以炙麻黄和淫羊藿共同作为君药,具有宣肺温阳平喘的作用;以太子参、黄芪补气生津,不仅可助君药温阳又不会引起津液耗伤,共为臣药。五味子、款冬花、地龙敛肺止咳、化痰平喘,作为佐药。罂粟壳助五味子敛肺止咳,知母润肺止咳,专入肺肾二经,共为使药。本研究结果显示,平喘颗粒能够降低哮喘小鼠模型气道炎症水平,并且抑制上皮杯状细胞化生和胶原沉积,对气道重塑具有较好的改善作用。
综上所述,平喘颗粒可以改善哮喘气道重塑,其作用机制主要是通过抑制ILC2 介导的M2 型巨噬细胞极化实现的。
作者贡献度说明:
王瑶:指标检测及论文撰写;袁星星:动物造模及药物干预,数据分析;田春燕:动物造模及药物干预;李竹英:课题设计及校审。
