基于多元统计分析和网络药理学的炒酸枣仁饮片质量标志物预测分析
2021-08-24解玉军衡依然段慧竹裴香萍杜晨晖
李 泽,杜 鹤,解玉军,衡依然,段慧竹,裴香萍,闫 艳,杜晨晖*
基于多元统计分析和网络药理学的炒酸枣仁饮片质量标志物预测分析
李 泽1,杜 鹤1,解玉军1,衡依然1,段慧竹1,裴香萍1,闫 艳2*,杜晨晖1*
1. 山西中医药大学中药与食品工程学院,山西 太原 030619 2. 山西大学 中医药现代研究中心,山西 太原 030006
基于多元统计分析和网络药理学分析预测炒酸枣仁饮片潜在的质量标志物(Q-Marker)。利用超高效液相色谱-四极杆-静电场轨道阱质谱联用(ultra performance liquid chromatography-quadrupole-electrostatic field orbital trap mass spectrometry,UHPLC-Q-Orbitrap-MS)解析生、炒酸枣仁饮片的主要成分,运用多元统计分析结合VIP>1和<0.05筛选出炮制前后潜在的差异化学成分。结合网络药理学筛选核心靶点构建“成分-靶点-通路”网络关系,预测炒酸枣仁潜在的Q-Marker,以潜在Q-Marker为指标对市售样品进行含量测定,验证Q-Marker的科学性。生、炒酸枣仁共鉴定54个化学成分,包括斯皮诺素、当药黄素等黄酮类成分,酸枣仁皂苷A、酸枣仁皂苷B等皂苷类成分,以及木兰花碱、乌药碱等生物碱类成分;结合多元统计分析共找到木兰花碱、6ʹʹʹ-阿魏酰斯皮诺素、酸枣仁皂苷A、白桦脂酸等28个差异性成分;经网络药理学分析筛选出包括17个差异成分的Q-Marker库,分别为酸枣仁皂苷A、酸枣仁皂苷B、美洲茶酸、白桦脂酸、木兰花碱、乌药碱、去甲荷叶碱、巴婆碱、斯皮诺素、当药黄素、维采宁II、6ʹʹʹ-对-香豆酰斯皮诺素、6ʹʹʹ-阿魏酰斯皮诺素、芹菜素、桦木酮酸、牡荆素、异牡荆素;结合课题组前期研究及市售样品测定结果,最终确定木兰花碱、乌药碱、斯皮诺素、6ʹʹʹ-阿魏酰斯皮诺素、酸枣仁皂苷A和B作为炒酸枣仁的Q-Marker。分析预测的Q-Marker为炒酸枣仁的整体质量控制及临床应用提供科学依据,同时也为其功效关联物质的研究及作用机制的阐释奠定基础。
多元统计分析;网络药理学;酸枣仁;炒酸枣仁;质量标志物;UHPLC-Q-Orbitrap-MS;成分-靶点-通路;木兰花碱;乌药碱;斯皮诺素;6ʹʹʹ-阿魏酰斯皮诺素;酸枣仁皂苷;整体质量控制
酸枣仁(ZSS)来源于鼠李科植物酸枣Mill. var.(Bunge) Hu ex H. F. Chou的干燥成熟种子,其味甘酸、性平,归心、肝、胆经,具有养心益肝、安神、敛汗之功[1]。现代研究表明,酸枣仁主要药理作用有镇静催眠[2-3]、抗惊厥[4]、抗焦虑[5]、改善心肌缺血[6]、改善学习记忆能力[7]等。在传统中医的临床用药中,《本草图经》:“今医家两用,睡多生使,不得睡炒熟,生熟便尔顿异”,即酸枣仁生品与炮制品用来治疗不同的疾病。现代研究表明酸枣仁生品和炮制品均具有镇静安神作用,以炒酸枣仁fried(FZSS)的作用更强,且目前临床使用最多的亦是炒酸枣仁。《中国药典》2020年版中生、炒酸枣仁的质量标准相同,但现代文献研究发现酸枣仁在炒制后斯皮诺素[8]、酸枣仁皂苷A、酸枣仁皂苷B[9]等有效化学成分的含量及溶出率[10]存在差异,化学成分的改变是否会在一定程度上造成生、炒酸枣仁的临床应用有所不同?基于此,通过研究生、炒酸枣仁中药效物质基础差异,从而预测炒酸枣仁饮片的质量标志物是非常有必要的。
中药质量标志物(Q-Marker)是近年来由刘昌孝院士团队提出的中药质量评价与质量控制的核心概念[11-12]。中药Q-Marker是代表某种中药特征的标志物,其来源明确,与功效用途相关联,是反映一味中药质量特征的化合物组合,也是近年来开展中药质量控制和药效物质基础研究的一个重要方向。因此,进一步明确炒酸枣仁饮片的Q-Marker,对于炒酸枣仁饮片的质量控制是十分必要的。本课题组前期对酸枣仁的化学成分[13]、体内代谢[14]、物质基础[15]、作用机制[16]进行深入研究,并在研究其质量标志物方面取得一定进展[17-18]。本研究结合课题组已有成果,利用超高效液相色谱-四极杆-静电场轨道阱质谱联用(ultra performance liquid chromatography-quadrupole-electrostatic field orbital trap mass spectrometry,UHPLC-Q-Orbitrap-MS)与多元统计分析相结合的方法,筛选出生、炒酸枣仁潜在的差异化学成分,并运用网络药理学方法对这些潜在的化学标记物进行验证,预测炒酸枣仁潜在的Q-Marker,阐明“成分-靶点-通路”之间的关系,为炒酸枣仁饮片的整体质量控制及临床应用提供科学依据。
1 仪器与材料
1.1 仪器
Thermo fisher U3000超高效液相色谱仪,配置在线脱气机、四元梯度泵、柱温箱、紫外检测器、自动进样器,美国Thermo Fisher Scientific公司;Thermo ScientificTMQ ExactiveTMOrbitrap质谱仪,美国Thermo Fisher Scientific公司;Waters e 2695高效液相色谱仪,配自动进样器、四元梯度泵、柱温箱、UV检测器以及Empower色谱工作站,美国Waters公司;ELSD 6000蒸发光散射检测器,美国奥泰公司;油浴锅,江苏科析仪器有限公司;Neofuge 13R高速冷冻离心机,上海力申科学仪器有限公司;涡旋仪,Thermo Scientifc公司;FA3204B电子天平,上海精科天美科学仪器有限公司;DNA120离心浓缩仪,美国Thermo Fisher Scientific公司。
1.2 药材和试剂
收集市售不同产地生酸枣仁、炒酸枣仁各10批,详细信息见表1。由山西中医药大学杜晨晖教授鉴定为鼠李科枣属植物酸枣Mill. var.(Bunge) Hu ex H. F. Chou的干燥成熟种子。样品保存于山西中医药大学中药资源与鉴定实验室。
对照品:乌药碱(批号HC225036198)、木兰花碱(批号20160710)、维采宁II(批号HV187847198)、斯皮诺素(批号20160314)、6ʹʹʹ-阿魏酰斯皮诺素(批号20160303)、酸枣仁皂苷A(批号20160315)均购于宝鸡市辰光生物科技有限公司;酸枣仁皂苷B(批号20170210)购于南京春秋生物工程有限公司;所有对照品经HPLC测定质量分数均大于98%;色谱级、质谱级甲醇、乙腈和甲酸购自美国Fisher公司;其他试剂均为分析纯。
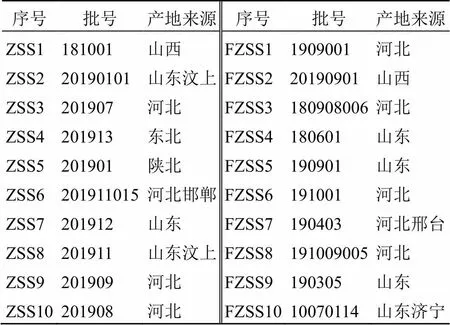
表1 市售生、炒酸枣仁样品来源
2 方法与结果
2.1 炒酸枣仁饮片制备方法
生酸枣仁(ZSS6)经检验质量符合《中国药典》2020年版一部酸枣仁项下规定。称取50 g,锅温设置为170 ℃,稳定10 min后将酸枣仁平铺于锅底,不断翻炒,炒制5 min后取出,放凉,即得炒酸枣仁,平行制备6份。酸枣仁粉碎过筛(60目)。
2.2 生、炒酸枣仁化学成分分析
2.2.1 样品制备 精密称定生、炒酸枣仁粉末2 g,置于索氏提取器中,加石油醚50 mL浸泡过夜,再加入40 mL,90 ℃加热回流4 h,药渣挥去溶剂转移至圆底烧瓶,加50 mL 70%乙醇回流提取2 h,过滤,药渣用70%乙醇5 mL洗涤,合并滤液挥干,甲醇复溶并定容至10 mL,过0.22微孔滤膜即得UPLC-MS供试品溶液。分别从各样品溶液中取等量溶液,混匀作为质量控制(quality control,QC)样品。
2.2.2 色谱条件 色谱柱为Acquity UPLC®HSS T3柱(150 mm×2.1 mm,1.8 μm),流动相为0.1%甲酸水溶液-乙腈,洗脱梯度:0~8 min,5%~17%乙腈;8~10 min,17%乙腈;10~11 min,17%~18%乙腈;11~12 min,18%~20%乙腈;12~17 min,20%~23%乙腈;17~22 min,23%~33%乙腈;22~30 min,33%~60%乙腈;30~32 min,60%~100%乙腈;32~34 min,100%乙腈;34~36 min,100%~5%乙腈;36~40 min,5%乙腈;体积流量为0.3 mL/min;柱温为40 ℃;进样量3 μL。
2.2.3 质谱条件 离子源为ESI源;正、负离子切换扫描;工作模式Full MS/dd MS2;质谱参数为鞘气流速40 arb(ESI+)、38 arb(ESI−);辅助气流速5 arb(ESI+)、10 arb(ESI−);喷雾电压3.2 kV(ESI+)、2.5 kV(ESI−);毛细管温度320 ℃;离子源温度350 ℃(ESI+)、300 ℃(ESI−);一级全扫描分辨率70 000 FWHM,二级扫描分辨率为17 500 FWHM,质荷比窗口宽度为/2.0;扫描范围/100~1500;动态排除持续时间8 s。
2.2.4 统计方法 UPLC-MS数据采用Thermo自带的Compound Discoverer 2.0软件对LC-MS数据进行峰的解卷积、峰对齐、峰校准和归一化等数据预处理,生成包含保留时间(retention time)和峰面积(peak area)的两维数据矩阵。此外,利用Thermo Xcalibur 3.0工作站同时匹配mzCloud、ChemSpider、PlantCyc在线数据库和自建化合物数据库对化合物进行鉴定。整理数据格式后,导入SIMCA-P(Umetrics公司)软件进行多元统计分析(PCA、OPLS-DA、S-plot)。采用SPSS 16.0软件对差异代谢物进行检验,采用GraphPad Prism(version 8.0,GraphPad Software,Inc.)软件对差异代谢物进行半定量分析。
2.2.5 化学成分鉴定 结合文献检索及课题组前期研究成果[19-20],在本次生、炒酸枣仁中共鉴定出54个成分,见表2,其中正离子模式下鉴定出35个,负离子模式下鉴定出42个。54个成分包括12个生物碱、15个皂苷和27个黄酮类化合物。对比生、炒酸枣仁的图谱(图1)可直观发现两者的化学成分基本相同,其中原酸枣仁皂苷A(S-33)、芹菜素(F-40)、桦木酮酸(S-54)仅在生酸枣仁中可被鉴定,而牡荆素(F-7)、异牡荆素(F-15)、异当药黄素(F-17)、6ʹʹʹ-(β--glucopyranosyl)-2ʹʹʹʹ,3ʹʹʹʹ- dihydro-2ʹʹʹʹ-oxo-3ʹʹʹʹ-yl-acetatespinosin(F-23)、6ʹʹ-阿魏酰-6ʹʹʹ-香豆酰斯皮诺素(F-39)只在炒酸枣仁中检测到。由此可知,酸枣仁在炒制过程中部分化学成分发生变化。
2.2.6 多元统计分析 拟采用多元统计分析的方法对生、炒酸枣仁中差异性成分进行分析。主成分分析(principal component analysis,PCA)的得分散点图能直观地显示不同样品之间的整体差异,由图2-A和图3-A所示,正、负离子模式下,QC样本均紧密的聚集在一起,表明实验过程仪器精密度良好。正离子模式下,由主成分1(58.7%)和主成分2(20.4%)为坐标构建PCA得分散点图,生、炒酸枣仁可沿t1轴分开;负离子模式下,由主成分1(54.8%)和主成分2(27.4%)为坐标构建PCA得分散点图,生、炒酸枣仁可沿t2轴分开,直观表明出生、炒酸枣仁之间具有良好的分离趋势,说明生、炒酸枣仁中化学成分存在一定差异。
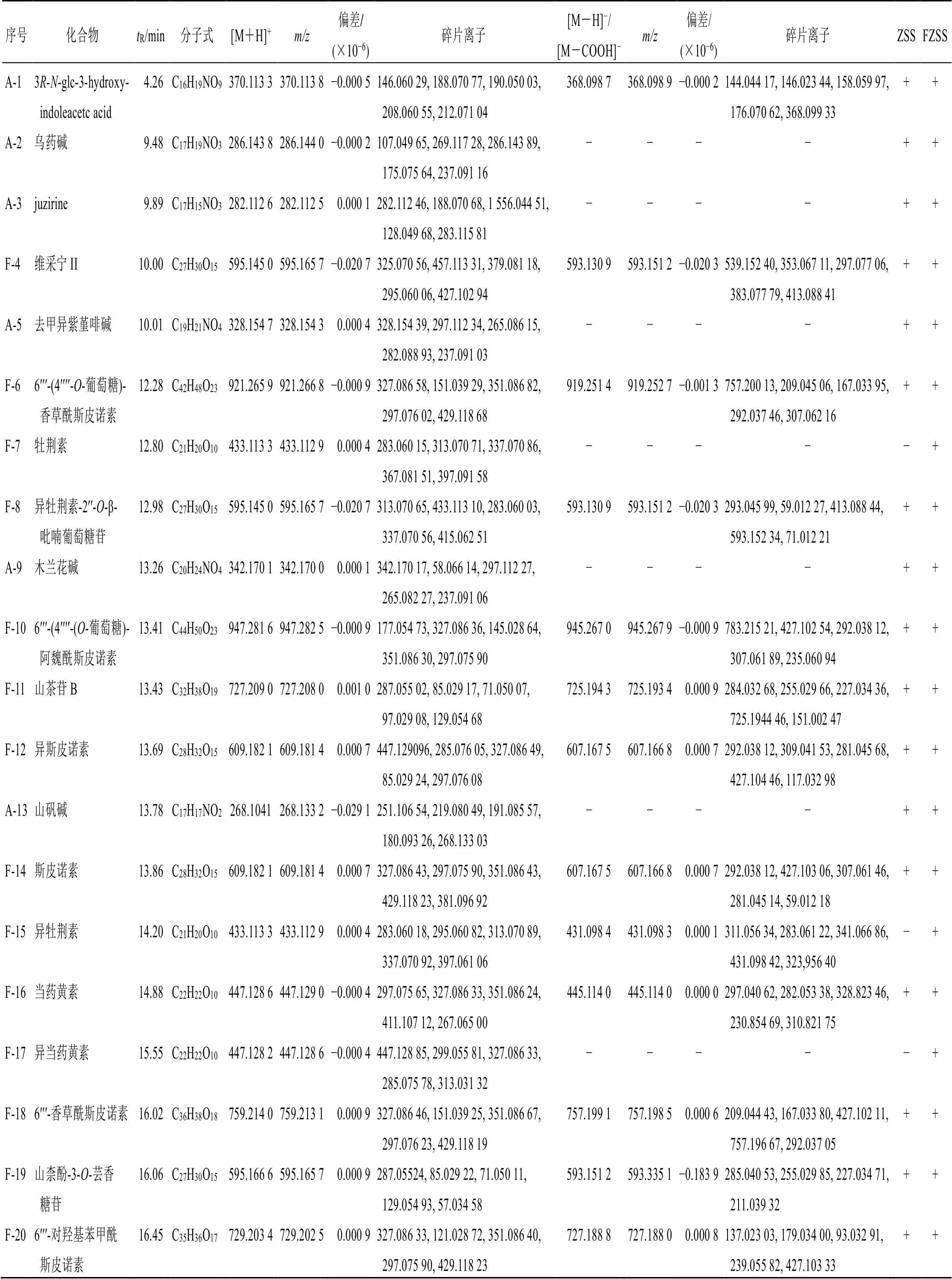
表2 UPLC-MS技术鉴定生、炒酸枣仁化学成分
续表2

序号化合物tR/min分子式[M+H]+m/z偏差/(×10−6)碎片离子[M-H]−/[M-COOH]−m/z偏差/(×10−6)碎片离子ZSSFZSS F-21异牡荆素-2ʹʹ-O-(6-对香豆酰)-吡喃葡萄糖苷16.70C36H36O17741.203 5741.202 50.001 0147.044 27, 313.070 80, 283.060 18, 337.070 71, 433.112 88739.188 5739.188 00.000 5293.045 78, 413.088 71, 161.059 43, 593.155 82, 205.050 00++ F-22异牡荆素-2″-O-(6-阿魏酰)-吡喃葡萄糖苷16.85C37H38O18771.213 3771.213 10.000 2177.054 75, 313.070 62, 145.028 59, 283.060 06, 337.070 86769.199 2769.198 50.000 7293.045 81, 413.088 50, 235.060 62, 193.050 02, 134.036 07++ F-236ʹʹʹ-(N-β-D-glucopyranosyl)-2ʹʹʹʹ,3ʹʹʹʹ-dihydro-2ʹʹʹʹ-oxo-3ʹʹʹʹ-yl-acetate spinosin17.60C44H49NO22−−−−958.262 3958.263 1−0.000 8649.178 59, 469.114 59, 292.039 25, 146.023 77, 307.062 44−+ A-24巴婆碱17.84C17H17NO2268.104 3268.103 30.001 0251.106 86, 219.080 78, 191.085 83, 252.110 20, 286.083 36−−−−++ F-256′′′-芥子酰斯皮诺素17.94C39H42O19815.240 5815.239 30.001 2207.065 48, 327.086 55, 175.039 23, 351.083 80, 297.075 90813.225 3813.224 80.000 5427.104 00, 292.038 21, 190.026 23, 311.079 50, 265.071 96++ F-266′′′-二羟苯基酰斯皮诺素17.95C43H52O19873.317 6873.318 4−0.000 8327.086 40, 351.086 36, 297.075 93, 323.091 55, 331.122 04871.303 0871.304 1−0.001 1427.103 24, 307.061 28, 607.161 68, 292.038 09, 309.041 78++ F-276′′′-对香豆酰斯皮诺素18.29C37H38O17755.218 9755.218 20.000 7147.044 28, 327.086 43, 351.068 62, 297.075 78, 429.116 94753.203 7753.203 60.000 1145.028 15, 753.204 10, 163.038 88, 292.038 02, 119.048 65++ F-286′′′-阿魏酰斯皮诺素18.48C38H40O18785.228 6785.228 7−0.000 1177.054 52, 327.085 97, 145.028 43, 351.086 00, 297.075 56783.215 1783.214 20.000 9783.216 67, 134.035 98, 292.037 96, 427.103 94, 193.049 73++ A-29mucronine J20.39C27H40N4O4485.312 4485.312 20.000 2114.128 14, 72.081 64, 485.312 41, 58.066 10, 115.131 45−−−−++ A-30去甲荷叶碱20.61C18H19NO2282.112 7282.148 8−0.036 1265.122 28, 250.098 83, 234.103 39, 266.125 85, 282.149 08−−−−++ F-316ʹʹʹ-(−)-phaseoylspinosin21.18C43H50O19871.301 9871.303 0−0.001 1327.086 43, 351.086 73, 297.075 81, 393.097 44, 429.118 29869.287 4869.288 1−0.000 7427.104 74, 292.037 72, 307.061 49, 607.162 60, 325.073 94++ F-326′′-阿魏酰异斯皮诺素21.87C38H40O18785.228 6785.228 7−0.000 1117.054 76, 447.128 94, 327.086 40, 145.028 63, 285.075 87783.215 1783.214 20.000 9161.023 50, 783.213 38, 175.038 97, 325.070 74, 607.166 99++ S-33原酸枣仁皂苷A22.90C64H106O32−−−−1 385.659 21 385.659 4−0.000 2949.466 86, 1 081.508 54, 1 385.660 52, 625.360 84, 787.414 86+− F-34槲皮素23.19C15H10O7−−−−301.035 4301.035 30.000 1310.035 49, 151.002 47, 178.997 50, 107.012 11, 65.001 66++ A-35sanjoinine A23.38C31H42N4O4535.292 1535.327 9−0.035 8148.112 27, 149.115 72, 133.088 84, 105.070 53, 72.607 95−−−−++ S-36酸枣仁皂苷H23.54C58H96O27−−−−1 223.607 11 223.606 60.000 5787.413 45, 625.360 35, 1 223.607 67, 919.456 12, 131.033 63++ S-37酸枣仁皂苷G24.86C52H86O22−−−−1 107.558 21 107.558 10.000 11 061.560 55, 929.511 90, 911.490 54, 749.445 98, 625.358 46++ A-38lotusanine A25.02C31H42N4O4535.292 1535.327 9−0.035 8148.112 21, 149.115 83, 133.088 84, 287.175 66, 86.097 08−−−−++ F-396ʹʹ-阿魏酰-6ʹʹʹ-香草酰斯皮诺素25.41C46H46O21−−−−933.245 9933.249 0−0.003 1577.134 64, 292.038 54, 235.061 55, 175.039 25, 134.035 90−+ F-40芹菜素25.71C15H10O5−−−−269.045 5269.045 7−0.000 2225.054 78, 151.002 53, 117.032 50, 133.813 17, 107.012 12+−
续表2

序号化合物tR/min分子式[M+H]+m/z偏差/(×10−6)碎片离子[M-H]−/[M-COOH]−m/z偏差/(×10−6)碎片离子ZSSFZSS A-41amphibine D25.83C36H49N5O5632.381 4632.380 60.000 8148.112 24, 289.191 13, 261.196 26, 344.196 96, 149.115 75630.366 6630.366 10.000 5342.182 46, 630.367 68, 273.124 60, 134.059 60, 247.144 60++ F-426ʹʹ,6ʹʹʹ-对阿魏酰斯皮诺素26.28C48H48O21961.276 1961.277 2−0.001 1177.054 79, 327.086 52, 145.028 66, 393.097 11, 351.086 15959.261 5959.262 3−0.000 8160.015 41, 175.038 88, 134.035 81, 603.150 51, 235.060 68++ S-43酸枣仁皂苷A27.06C58H94O26−−−−1 205.597 81 205.596 10.001 7107 3.554 44, 749.448 73, 101.022 76, 113.022 87, 911.501 16++ S-44酸枣仁皂苷C27.12C59H96O27−−−−1 281.612 41 281.611 00.001 4123 5.606 81, 107 3.554 57, 749.449 16, 105 5.543 70, 108 9.544 31++ S-45酸枣仁皂苷A127.53C58H94O26−−−−1 251.601 01 251.600 40.000 6120 5.595 95, 107 3.554 20, 749.449 28, 101.022 77, 125.022 93++ S-46酸枣仁皂苷B28.17C52H84O21−−−−1 043.544 61 043.542 10.002 5911.502 44, 749.449 16, 101.022 82, 603.391 24, 893.491 76++ S-47酸枣仁皂苷I28.24C53H86O22−−−−1 119.558 21 119.558 10.000 1107 3.554 44, 911.503 30, 749.448 85, 603.393 49, 101.022 79++ S-48乙酰酸枣仁皂苷B29.49C54H86O22−−−−1 131.558 21 131.558 10.000 1749.449 46, 102 5.532 96, 911.500 49, 893.489 44, 104 3.547 73++ S-4924-羟基美洲茶酸31.25C30H46O6−−−−501.322 4501.322 10.000 3501.323 03, 471.312 71, 427.323 97, 91.979 80, 472.315 37++ S-50表美洲茶酸33.11C30H46O5−−−−485.327 2485.327 20.000 0485.327 36, 423.327 55, 486.330 93, 609.911 46, 265.754 12++ S-5127-羟基美洲茶酸33.25C30H46O6−−−−501.322 4501.322 10.000 3501.322 72, 471.312 13, 427.321 93, 409.311 49, 60.991 46++ S-52美洲茶酸34.25C30H46O5−−−−485.327 2485.327 20.000 0485.327 70, 423.327 88, 60.991 55, 486.331 15, 424.329 38++ S-53白桦脂酸35.26C30H48O3−−−−455.353 1455.353 10.000 0455.353 42, 61.986 80, 456.356 96, 97.654 97, 115.919 27++ S-54桦木酮酸35.76C30H46O3−−−−455.353 1455.353 10.000 0455.353 33, 116.927 06, 100.931 76, 180.889 25, 254.850 33+−
A-生物碱类成分,F-黄酮类成分,S-皂苷类成分;“+”表示检测到,“−”表示未检测到
A-alkaloids components, F-flavonoid components, S-saponin components; “+” detected, “−” undetected

图1 生、炒酸枣仁正 (A)、负(B) 离子模式下基峰图
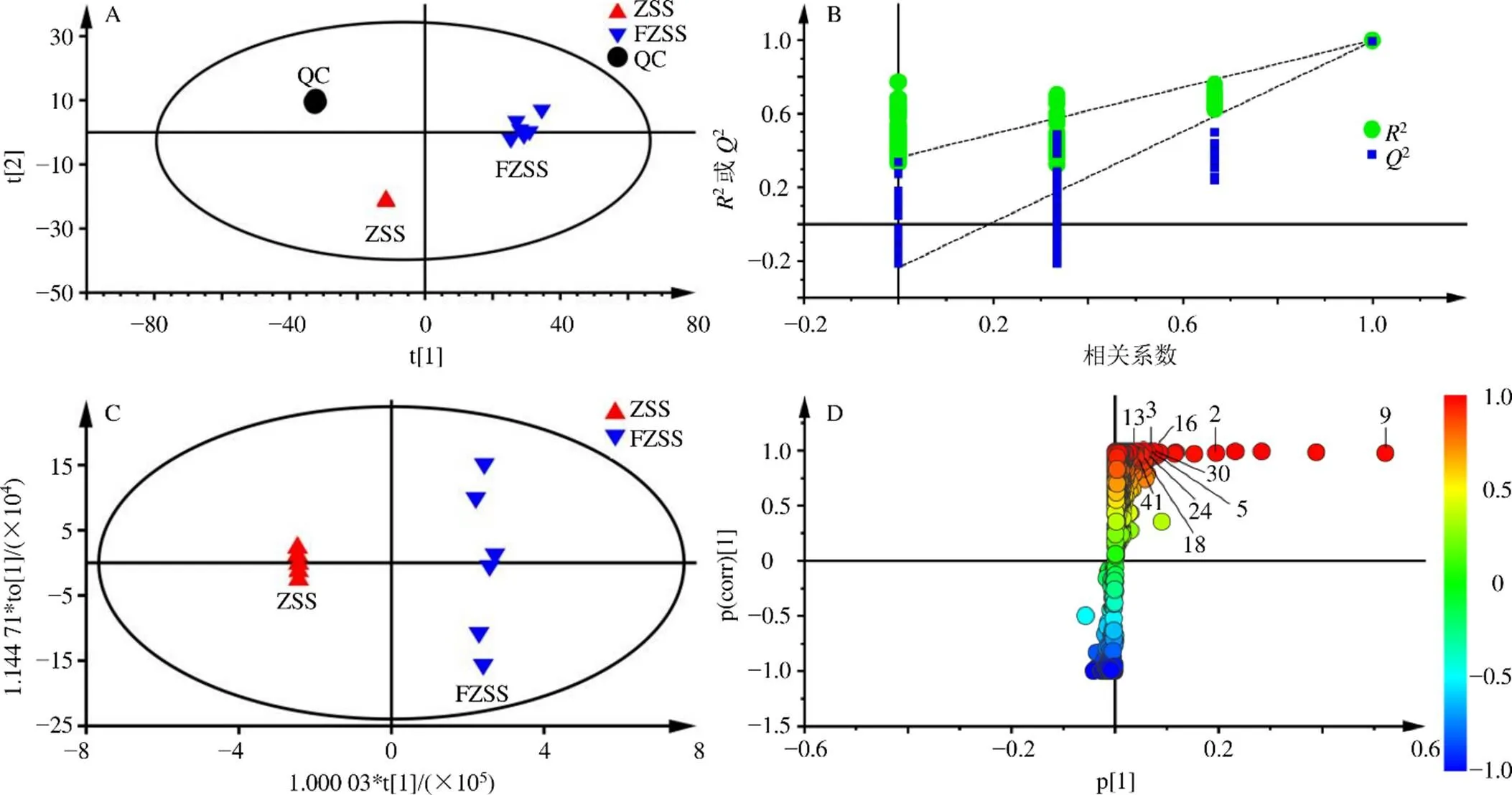
A-PCA图 B-模型验证 C-OPLS-DA图 D-S-plot图,图3同

图3 UHPLC-MS负离子多元统计分析 (n = 6)
PCA为无监督的分析方法,在确定差异成分时不能忽略组内误差,也不能消除与研究目的无关的随机误差[21]。因此,需要采用有监督的OPLS-DA,以确定生、炒酸枣仁之间的化学差异成分。首先采用排列模型验证PLS-DA模型的拟合程度,正离子模式下200个排列模型(图2-B)的参数为2=0.998、2=0.993;负离子模式下200个排列模型(图3-B)的参数为2=0.990、2=0.946,且2回归线与左边纵轴均相交于零点以下,说明模型有效,可以继续鉴定差异性化学成分。进一步采用OPLS-DA分析,寻找二者之间的差异成分,图2-C和图3-C中,在正、负离子模式下,生、炒酸枣仁之间均能明显分开。
将VIP>1和<0.05作为筛选差异化合物的判定标准,寻找生、炒酸枣仁分别在正、负离子模式下的潜在差异化合物。由图2-D和图3-D可知,在正离子模式下共找出10个差异化合物,在负离子模式下共找出10个差异化合物,包括7个黄酮类、5个皂苷类和8个生物碱类成分。
对20个差异性化合物进行相对含量分析,结果见图4,其中乌药碱(2)、木兰花碱(9)、山矾碱(13)等9个生物碱类成分在炒制之后相对含量显著上升(<0.05);斯皮诺素(14)、6′′′-阿魏酰斯皮诺素(28)、维采宁II(4)等6个黄酮类成分在炒酸枣仁中的相对含量显著高于酸枣仁(<0.05);除酸枣仁皂苷B(46)和表美洲茶酸(50)在炒制之后含量下降外,其余酸枣仁皂苷A(43)、白桦脂酸(53)等3个皂苷类化合物在炒制之后相对含量显著上升(<0.05)。生物碱、黄酮和皂苷类成分相对含量升高可能是由于炒制后酸枣仁质地酥脆,利于有效成分的溶出[8-9],且高温会造成黄酮类物质的糖苷键断裂而使结合态的黄酮游离出来[22],从而导致黄酮类成分的含量增加。

与酸枣仁生品比较:**P<0.01 ***P<0.001
2.3 潜在质量标志物的作用靶标及网络预测
通过检索中药系统药理数据库TCMSP(https:// tcmspw.com/tcmsp.php)和ETCM(http://www.tcmip. cn/ETCM/index.php/Home/)查询差异化合物的作用靶点,将获得的靶点蛋白导入在线STRING 11.0(https://string-db.org/cgi/input.pl)获得PPI网络。然后将Uniprot ID导入David 6.8数据库(https://david. ncifcrf.gov/)对潜在的核心靶点蛋白进行基因本体(gene ontology,GO)功能和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。最后,通过Cytoscape 3.8.2软件(美国Bethesda Softworks公司)分别建立化学成分及入血成分的“成分-靶点-通路”网络关系,并对结果进行综合分析。
2.3.1 靶点蛋白与蛋白互作(protein-protein interaction,PPI)网络分析 通过检索中药系统药理数据库(TCMSP,http://tcmspw.com/tcmsp.php)和(ETCM,http://www.tcmip.cn/ETCM/index.php/ Home/)查询UHPLC-Q-Orbitrap-MS直观分析和多元统计所得28个差异物的作用靶点,最终找到20个差异化合物的389个靶点蛋白(表3)。通过Uniprot数据库(http://www.uniprot.org/)将预测出的靶点蛋白名转换为对应的基因名。将获得的基因名导入STRING 11.0网站(https://string-db.org/cgi/ input.pl),物种选择为人(homo sapiens),最高置信度蛋白交互参数评分值>0.90,其他参数设置不变,去掉网络中的单一节点,获得PPI网络,导入Cytoscape 3.8.2进行作图,见图5。
将PPI网络导入Cytoscape 3.8.2进行拓扑特征分析,选取在度中心性(degree)、中介中心性(betweenness)、接近中心性(closeness)3个参数均大于中位数且degree≥10的点作为核心靶点,经筛选后共得到52个核心靶点,见表4,其主要与酸枣仁皂苷A、酸枣仁皂苷B、美洲茶酸、白桦脂酸、木兰花碱、乌药碱、去甲荷叶碱、巴婆碱、斯皮诺素、当药黄素、维采宁II、6ʹʹʹ-对香豆酰斯皮诺素、6ʹʹʹ-阿魏酰斯皮诺素、芹菜素、桦木酮酸、牡荆素、异牡荆素17个成分相关。

表3 化合物与靶点数

图5 PPI网络
2.3.2 功能富集分析与通路分析 GO功能分析主要用于描述基因靶点的功能,包括细胞功能、分子功能和生物功能。KEGG富集分析可以得到潜在靶点所富集的信号通路。GO富集分析根据<0.001、富集倍数值(FDR)<0.001的条件筛选出63个GO条目,其中生物过程(biological process,BP)占39个,主要富集于对药物的反应(response to drug)、细胞增殖调控(regulation of cell proliferation)、凋亡过程调控(regulation of apoptotic process)、炎症反应(inflammatory response)等过程;分子功能(molecular function,MF)占18个,明显富集于多巴胺、肾上腺素等神经递质受体(dopamine neurotransmitter receptor activity、alpha2-adrenergic receptor activity)和蛋白质(protein binding);细胞组成(cellular component,CC)占6个,可以看出主要富集在细胞质膜(integral component of plasma membrane)、突触(axon terminus)等区域。

表4 核心靶点
KEGG富集分析得到89条通路,以<0.001、FDR<0.001的条件筛选58条通路。选择前20条,以通路为纵坐标,FDR为横坐标构建气泡图(图6)。圆圈的大小代表核心靶点中参与此途径的基因个数,图中显示癌症途径(pathways in cancer)中参与的基因最多,为22个。此外,还包括乙型肝炎(hepatitis B)等疾病通路和环磷酸腺苷(cyclic AMP,cAMP)信号通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、神经活性配体-受体相互作用(neuroactive ligand-receptor interaction)等作用通路,表明炒酸枣仁可能通过调控这些通路达到干预疾病的作用。

图6 KEGG富集分析
2.3.3 “成分-靶点-通路”网络构建 将52个核心靶点相关的17个成分、58条通路运用Cytoscape 3.8.2软件构建“成分-靶点-通路”网络,见图7。由图可发现化合物、靶点、通路间存在错综复杂的关系,符合中药“多成分、多靶点”的特点。利用Network Aalyzer插件对该网络进行拓扑分析,获得节点度(degree)值,根据度值判断节点在网络中的重要性,推测炒酸枣仁干预疾病的机制可能是17个主要活性成分通过癌症途径(度值22)、PI3K-Akt信号传导途径(PI3K-Akt signaling pathway)(度值21)、神经活性配体-受体相互作用(度值15)、cAMP信号通路(度值13)、TNF信号通路(度值11)等多条途径,作用在RELA、NFKB1(度值42)、AKT1(度值40)、TNF、TP53(度值28)、JUN(度值22)等关键靶标。上述结果表明,本实验筛选出的化学成分可作为炒酸枣仁的活性成分进行深层次研究。
2.3.4 Q-Marker的确定 基于多元统计分析和网络药理学分析,筛选出酸枣仁皂苷A、酸枣仁皂苷B、美洲茶酸、白桦脂酸、木兰花碱、乌药碱、去甲荷叶碱、巴婆碱、斯皮诺素、当药黄素、维采宁II、6ʹʹʹ-对香豆酰斯皮诺素、6ʹʹʹ-阿魏酰斯皮诺素、芹菜素、桦木酮酸、牡荆素、异牡荆素等17个有效活性成分作为炒酸枣仁的潜在Q-Marker库。
课题组前期利用血清化学与网络药理学结合发现乌药碱、酸李碱、芹菜素、斯皮诺素和酸枣仁皂苷A可作为酸枣仁治疗失眠的体内潜在效应物质[16];通过肠道菌群代谢研究发现乌药碱、酸李碱、斯皮诺素、山柰酚-3--芸香糖苷、维采宁II、酸枣仁皂苷A和B可作为酸枣仁Q-Marker[17];且从生物合成途径角度发现酸枣仁皂苷A和B、白桦脂酸、斯皮诺素、6′′′-阿魏酰斯皮诺素、乌药碱、木兰花碱可考虑作为酸枣仁的Q-Marker[18];并开展了口服酸枣仁后大鼠血浆内的乌药碱、木兰花碱、斯皮诺素、6ʹʹʹ-阿魏酰斯皮诺素、酸枣仁皂苷A和B等Q-Marker的药代动力学研究[23]。综合前期研究基础结合Q-Marker研究的“五原则”,初步认为木兰花碱、乌药碱、斯皮诺素、6ʹʹʹ-阿魏酰斯皮诺素、酸枣仁皂苷A和B等6个成分可作为炒酸枣仁的潜在Q-Marker。

图7 “成分-靶点-通路”网络
2.4 Q-Marker可测性验证
为明确本研究确定的潜在Q-Marker科学性,以乌药碱、木兰花碱、斯皮诺素、6ʹʹʹ-阿魏酰斯皮诺素、酸枣仁皂苷A和酸枣仁皂苷B为指标,参考课题组前期研究,进行含量测定。
2.4.1 对照品溶液的制备 精密称取乌药碱、木兰花碱、斯皮诺素、6‴-阿魏酰斯皮诺素、酸枣仁皂苷A和酸枣仁皂苷B对照品适量,加70%甲醇制成质量浓度分别为80、320、200、180、200、100 μg/mL的混合对照品溶液。
2.4.2 供试品溶液的制备 同“2.2.1”项。
2.4.3 液相色谱条件 色谱柱为Apollo C18柱(250 mm×4.6 mm,5 μm);流动相为0.1%甲酸水溶液-和乙腈,梯度洗脱:0~26 min,10%~20%乙腈;26~30 min,20%~23%乙腈;30~43 min,23%~26%乙腈;43~45 min,26%~37%乙腈;45~47 min,37%乙腈;47~54 min,37%~39%乙腈;54~63 min,39%~100%乙腈;体积流量为1.0 mL/min;柱温25 ℃;进样量10 μL;紫外检测波长为227、335 nm;ELSD参数:漂移管温度105 ℃,空气体积流量为2.5 L/min。采用227、335 nm和ELSD检测器同时进行测定[24]。
2.4.4 样品测定 精密量取“2.4.1”项下混合对照品溶液,稀释成系列质量浓度的对照品溶液,按“2.4.3”项下色谱条件进样,建立标准曲线,各标准曲线的相关系数(2)值均大于0.99。方法学考察见前期研究[24],该方法专属性强、准确,具备定性和定量双重作用,可用于炒酸枣仁饮片Q-Marker的定量测定研究。将生、炒酸枣仁各10批样品按“2.4.2”项下的方法制备供试品溶液,6个潜在Q-Marker含量测定结果见表5。结果显示生、炒酸枣仁中6种化合物含量从高到低依次为木兰花碱>斯皮诺素>酸枣仁皂苷A>6ʹʹʹ-阿魏酰斯皮诺素>酸枣仁皂苷B>乌药碱,除酸枣仁皂苷A外,其余5种化合物的含量在生、炒酸枣仁中均无显著差异。结果表明6种化学成分含量在生、炒酸枣仁中均较高,可将乌药碱、木兰花碱、斯皮诺素、6ʹʹʹ-阿魏酰斯皮诺素、酸枣仁皂苷A和酸枣仁皂苷B作为炒酸枣仁饮片的Q-Marker。
3 讨论
据国内外文献记载酸枣仁的化学成分主要含皂苷类、黄酮类、生物碱类等化学成分[18],其中酸枣仁中黄酮类成分种类丰富且含量较高,具有改善睡眠[25]、抗抑郁[26]、抗焦虑[27]和改善记忆功能[28]等 重要功能;皂苷类成分与黄酮类成分发挥同样的作用[13],并对阿尔茨海默症有一定疗效[29];生物碱类成分也具有镇静催眠、抗抑郁等药理作用[30]。故本实验利用UHPLC-MS技术对生、炒酸枣仁的化学成分进行全面表征,结合多元统计分析筛选生、炒酸枣仁中20个潜在的化学标记物,19个化合物的相对含量在炒制之后上升。之后进行网络建模分析,构建“成分-靶点-通路”网络关系图,进一步结合课题组前期研究初步选择6种成分为酸枣仁的主要药效基础物质。并对其进行含量测定,明确其可测性,最终确定木兰花碱、乌药碱、斯皮诺素、6ʹʹʹ-阿魏酰斯皮诺素、酸枣仁皂苷A和B等6种成分可作为炒酸枣仁的Q-Marker。
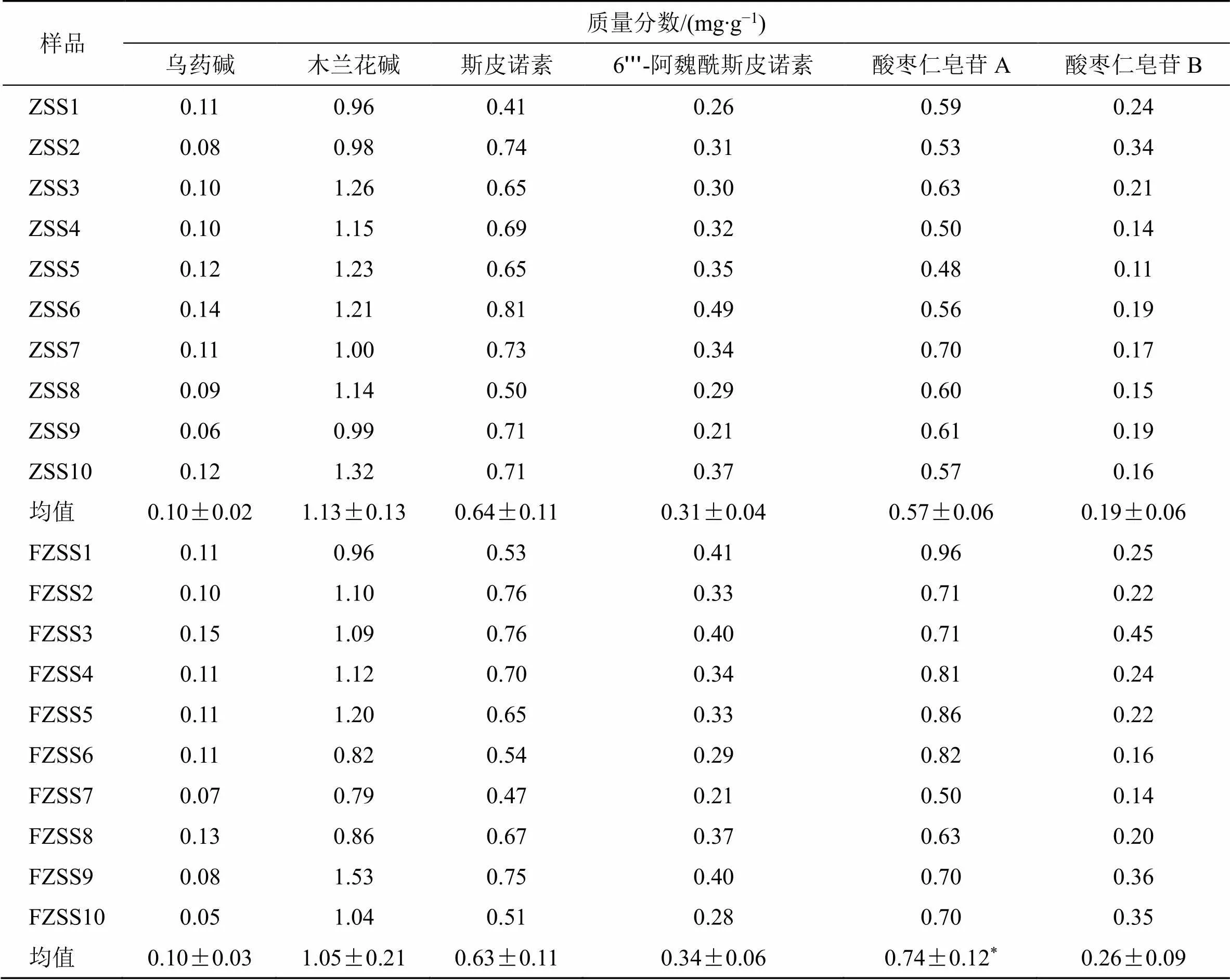
表5 生、炒酸枣仁样品含量测定结果 (n = 4)
与ZSS均值比较:*<0.05
*< 0.05ZSS mean value
本研究中市售样品测定结果表明生、炒酸枣仁中5种化合物含量无显著差异,首先可能由于生、炒酸枣仁收集于不同产地、不同生产时间,导致样本本身不均一;也可能由于目前酸枣仁炒制标准没有统一而明确的参数,导致不同饮片公司炒制酸枣仁所执行的标准不统一。后期可将本研究确定的6种Q-Marker作为指标,结合药效评价研究,对酸枣仁的炒制方法进行优化,明确炒制过程中锅温、时间、投料量等具体参数,进一步规范酸枣仁的炮制标准。此外,本研究发现生、炒酸枣仁化学成分的差异主要为化学成分含量的差异,未发现显著的化学成分结构变化。为了更加准确地将6种Q-Marker应用于酸枣仁饮片质量控制与指导临床,应通过大样本、多批次比较研究,明确6种Q-Marker分别在生、炒酸枣仁中的含量限度范围,为酸枣仁饮片的质量控制研究提供科学参考。综上,本实验为生、炒酸枣仁质量标准的提升及全程质量控制提供参考,同时也为含有生、炒酸枣仁的复方Q-Marker的筛选提供参考,但还需对Q-Marker的药效活性及作用机制进行验证和阐释,从而为炒酸枣仁饮片的质量追溯和评价体系提供更为全面的科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 382.
[2] Jiang J G, Huang X J, Chen J,. Comparison of the sedative and hypnotic effects of flavonoids, saponins, and polysaccharides extracted from Semen[J]., 2007, 21(4): 310-320.
[3] 任晓宇, 李廷利. 酸枣仁汤对慢性睡眠剥夺小鼠肝功能和特定肠道菌的影响[J]. 药物评价研究, 2020, 43(2): 226-231.
[4] 赵连红, 乔卫, 许岚. 酸枣仁中生物碱抗惊厥作用的实验研究 [J]. 天津药学, 2007, 19(1): 4-5.
[5] 荣春蕾, 代永霞, 崔瑛. 酸枣仁对阴虚小鼠焦虑行为的影响 [J]. 中药材, 2008, 31(11): 1703-1705.
[6] 张玮, 袁秉祥, 于晓江, 等. 酸枣仁总皂苷对大鼠急性心肌缺血的保护作用 [J]. 西安交通大学学报: 医学版, 2005, 26(4): 333-335.
[7] 侯建平, 张恩户, 胡悦, 等. 酸枣仁对小鼠学习记忆能力的影响 [J]. 广西中医学院学报, 2002, 5(3): 11-13.
[8] 李会军, 李萍. HPLC法测定酸枣仁不同炮制品中两种黄酮碳苷的含量 [J]. 中国中药杂志, 2002, 27(4): 23-25.
[9] 于定荣, 杨梓懿, 邹建武. 酸枣仁不同炮制品中酸枣仁皂苷A和B及浸出物含量的测定 [J]. 时珍国医国药, 2007, 18(11): 2875-2876.
[10] 刘福祥, 高剑锋. 炒制程度对酸枣仁提取物的影响(简报) [J]. 中国中药杂志, 1990, 15(5): 28-29.
[11] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[12] 刘昌孝. 基于中药质量标志物的中药质量追溯系统建设 [J]. 中草药, 2017, 48(18): 3669-3676.
[13] 杜晨晖, 崔小芳, 裴香萍, 等. 酸枣仁皂苷类成分及其对神经系统作用研究进展 [J]. 中草药, 2019, 50(5): 1258-1268.
[14] 闫艳, 张敏, 崔小芳, 等. 酸枣仁化学成分体内过程及其质量标志物研究思路探讨 [J]. 中草药, 2019, 50(2): 299-309.
[15] 杜晨晖, 裴香萍, 张敏, 等. 基于1H-NMR代谢组学的酸枣仁改善失眠大鼠睡眠作用机制研究 [J]. 中草药, 2019, 50(10): 2405-2412.
[16] 李强, 杜晨晖, 张敏, 等. 血清化学与网络药理学关联研究酸枣仁的体内效应成分 [J]. 中草药, 2017, 48(10): 1936-1943.
[17] 崔小芳, 杜晨晖, 裴香萍, 等. 基于肠道菌群转化的酸枣仁质量标志物预测分析 [J]. 中草药, 2019, 50(19): 4634-4642.
[18] 闫艳, 申晨曦, 张福生, 等. 酸枣仁与理枣仁的研究进展及质量标志物预测分析 [J]. 中草药, 2019, 50(19): 4769-4784.
[19] 杜晨晖, 李泽, 崔小芳, 等. 基于UPLC-Q-Orbitrap MS/MS技术研究酸枣仁发酵过程中的化学成分转化 [J]. 高等学校化学学报, 2019, 40(8): 1614-1620.
[20] Yan Y, Shen C X, Pei X P,. Compare the chemical profiling ofandusing untargeted metabolomics [J]., 2020, 94: 103635.
[21] 华愉教, 侯娅, 王胜男, 等. 基于1H-NMR代谢组学技术的野生与栽培太子参化学成分分析 [J]. 中国药学杂志, 2017, 52(4): 272-276.
[22] Hollman P C, Katan M B. Dietary flavonoids: Intake, health effects and bioavailability [J]., 1999, 37(9): 937-942.
[23] Du C, Yan Y, Shen C,. Comparative pharmacokinetics of six major compounds in normal and insomnia rats after oral administration ofaqueous extract [J]., 2020, 10(4): 385-395.
[24] 杨馥源, 魏洁, 王玉龙, 等. 山西产酸枣仁HPLC-UV-ELSD特征图谱及7个化学成分的含量测定 [J]. 山西医科大学学报, 2021, 52(2): 194-200.
[25] Wang L E, Cui X Y, Cui S Y,. Potentiating effect of spinosin, a C-glycoside flavonoid of, on pentobarbital-induced sleep may be related to postsynaptic 5-HT(1A) receptors [J]., 2010, 17(6): 404-409.
[26] 赵启铎, 舒乐新, 王颖, 等. 酸枣仁总黄酮抗抑郁作用的实验研究 [J]. 天津中医药, 2011, 28(4): 335-337.
[27] Liu J, Zhai W M, Yang Y X,. GABA and 5-HT systems are implicated in the anxiolytic-like effect of spinosin in mice [J]., 2015, 128: 41-49.
[28] Lee H E, Jeon S J, Ryu B,. Swertisin, a-glucosylflavone, ameliorates scopolamine-induced memory impairment in mice with its adenosine A1 receptor antagonistic property [J]., 2016, 306: 137-145.
[29] Liu Z, Zhao X, Liu B,. Jujuboside A, a neuroprotective agent fromameliorates behavioral disorders of the dementia mouse model induced by Aβ 1-42 [J]., 2014, 738: 206-213.
[30] 黄之镨, 马伟光. 酸枣仁及活性物质的药理研究进展 [J]. 中国民族民间医药, 2018, 27(3): 57-60.
Prediction and analysis of Q-Markers of friedpieces based on multivariate statistical analysis and network pharmacology
LI Ze1, DU He1, XIE Yu-jun1, HENG Yi-ran1, DUAN Hui-zhu1, PEI Xiang-ping1, YAN Yan2, DU Chen-hui1
1. College of Traditional Chinese Medicine and Food Engineering, Shanxi University of Chinese Medicine, Taiyuan 030619, China 2. Modern Research Center for Traditional Chinese Medicine, Shanxi University, Taiyuan 030006, China
To explore the potential Q-Markers of fried Suanzaoren (, ZSS) (FZSS) based on multivariate statistical analysis and network pharmacology.Ultra performance liquid chromatography-quadrupole- electrostatic field orbital trap mass spectrometry (UHPLC-Q-Orbitrap-MS) was used to analyze the main components in ZSS and FZSS, and the potential differential components between ZSS and FZSS were screened out by using multivariate statistical analysis combined with VIP > 1 and< 0.05. Further, the main action targets were analyzed to construct the “component-target-pathway” network relationship through network pharmacology, and predict the potential Q-Markers of FZSS. The scientificity of potential Q-Markers was verified by the content determination of the potential Q-Markers in commercial samples.A total of 54 chemical components, including flavonoid (such as spinosin and swertisin),saponin(jujuboside A and jujuboside B, etc.) and alkaloidcomponents (magnoflorine, coclaurine, etc.), were identified from ZSS and FZSS, and 28 differential components, such as magnoflorine, 6ʹʹʹ-feruloylspinosin, jujuboside A, and betulinic acid, were found through multivariate statistical analysis. A potential Q-Marker component library contained 17 potential bioactive components (including jujuboside A, jujuboside B, ceanothic acid, betulinic acid, magnoflorine, coclaurine, nornuciferine, asimilobine, spinosin, swertisin, vicenin II, 6ʹʹʹ--coumaroylspinosin, 6ʹʹʹ-feruloylspinosin, apigenin, betulonic acid, vitexin, isovitexin) was screened by network pharmacology. Magnoflorine, coclaurine, spinosin, 6ʹʹʹ-feruloylspinosin, jujuboside A, and jujuboside B were finally identified as the Q-Markers of FZSS combined with the preliminary research of our research group and the results of the commercial samples.The Q-Marker predicted in this study can provide a reference for the whole quality control and clinical application of FZSS. Meanwhile, it can also provide the basis for the further research on the efficacy-substance relation and mechanism of FZSS.
multivariate statistical analysis; network pharmacology;; fried; Q-Markers; UHPLC-Q-Orbitrap-MS; component-target-pathway; magnoflorine; coclaurine; spinosin; 6ʹʹʹ-feruloylspinosin; jujuboside; whole quality control
R283.6
A
0253 - 2670(2021)16 - 4811 - 14
10.7501/j.issn.0253-2670.2021.16.006
2021-04-10
国家自然科学基金项目(81603251);国家自然科学基金项目(81603289);山西省科技厅重点研发计划项目(201803D31087);山西省教育厅高等学校青年科研人员培育计划(20);山西省教育厅高等学校科技创新项目(2020L0422);2019年山西省教育厅优秀研究生创新项目(2019SY515);山西中医药大学科技创新团队项目(2018-TD-009);山西中医药大学2021年科技创新能力培育计划(2021PY-QN-07)
李 泽(1996—),女,硕士,研究方向为中药资源与开发。Tel: 18434376763 E-mail: leze163@163.com
闫 艳,女,副教授,博士,研究方向为中药质量控制及中药体内过程研究。Tel: (0351)7018379 E-mail: yanyan520@sxu.edu.cn
杜晨晖,男,教授,博士,研究方向为中药药效物质基础研究。Tel: (0351)3179982 E-mail: dch@sxtcm.edu.cn
[责任编辑 郑礼胜]
