黄芩苷脂质体凝胶制备、质量评价及其对痤疮的药效学评价
2021-08-24王佳辉陈子豪李海艳
王佳辉,陈 麟,孙 平,陈子豪,李海艳,苏 青
黄芩苷脂质体凝胶制备、质量评价及其对痤疮的药效学评价
王佳辉,陈 麟,孙 平,陈子豪,李海艳,苏 青*
成都医学院药学院,四川 成都 610500
制备黄芩苷脂质体凝胶(baicalin liposomes gels,Bai-Lip-Gels),进行体外质量评价,并考察其治疗轻、中度痤疮的疗效。首先采用单因素试验,以包封率、粒径为评价指标来考察处方工艺对脂质体制备的影响。其次,利用各因素与包封率之间的相关性选出影响脂质体制备的显著因素,并运用Box-Behnken设计-响应面法进一步优化处方工艺。然后制备Bai-Lip-Gels,采用流变学进行表征,对其稳定性进行初步考察,并通过透析袋释药试验和离体皮肤透皮试验考察Bai-Lip-Gels的释药性能。最后,对Bai-Lip-Gels进行兔耳痤疮的药效学评价。成功制备黄芩苷脂质体(baicalin liposomes,Bai-Lip),其包封率为63.9%;在透射电子显微镜(TEM)下观察可见脂质体呈规则球形,结构完整,分散均匀;其粒径为(212.300±0.424)nm,多分散性指数(polydispersity index,PDI)为0.217±0.012,Zeta电位为(−32.4±0.9)mV,制备的Bai-Lip稳定。制备的Bai-Lip-Gels流变学性质稳定,在4 ℃冷藏贮存稳定性良好。离体皮肤透皮试验结果表明,Bai-Lip-Gels在18 h内单位面积累积渗透量(18)为(81.38±2.81)μg/cm2,高于黄芩苷混悬剂凝胶(baicalin suspension gels,Bai-Sus-Gels)[18为(43.03±2.14)μg/cm2],并对Bai-Lip-Gels和Bai-Sus-Gels的释放曲线进行了方程拟合,Bai-Lip-Gels体外经皮渗透符合一级方程,Bai-Sus-Gels经皮渗透符合零级方程。初步药效学试验表明,在给药治疗后,组织病理染色结果可知,Bai-Lip-Gels组的疗效显著,主要体现在减轻角质化程度、局部组织充血、炎性程度等方面。从兔耳痤疮模型血清中肿瘤坏死因子α、白细胞介素1β、白细胞介素6、白细胞介素8分泌的影响发现,Bai-Lip-Gels能显著降低兔耳痤疮的炎症因子水平,且疗效优于阳性对照组阿达帕林凝胶。制备的Bai-Lip-Gels用于兔耳痤疮治疗,能有效减轻角质化程度,减轻局部组织充血,降低炎症因子水平,为治疗轻、中度炎症性痤疮提供制剂开发的依据。
黄芩苷;脂质体凝胶;Box-Behnken设计-响应面法;经皮渗透;痤疮;炎症;药效学
黄芩苷(baicalin,Bai)是唇形科黄芩属植物黄芩Georgi干燥根茎中提取的黄酮类活性成分[1],不仅有很强的抗炎活性[2],还具有抑制革兰氏阳性菌痤疮丙酸杆菌的作用[3],将其开发成外用抗痤疮制剂局部起效、避免全身影响、无肝脏首过效应[4],具有很大的市场潜力。但是黄芩苷存在难溶于水,皮肤透过率低等问题,限制了其在皮肤外用制剂上的应用[5]。陈遥等[6]采用促透剂促进黄芩苷凝胶中黄芩苷对皮肤的经皮透过量,在一定程度上能够增加累积透过量,但难以解决药物透过量达到一定限度时,大量的黄芩苷滞留在皮肤表面而不能持续透过皮肤表层发挥药效的问题。熊欣等[7]制备黄芩苷脂质体凝胶(baicalin liposomal gels,Bai-Lip-Gels)并对体外透皮性能进行评析,发现黄芩苷混悬剂凝胶(baicalin suspension gels,Bai-Sus-Gels)与普通脂质体凝胶具有相似的体外透皮性能,在透皮性能上无显著性优势。储晓琴等[8]对Bai-Lip-Gels体外释药与稳定性进行了研究,发现Bai-Lip-Gels具有一定的缓释性,并在低温下贮存稳定性更佳。
近年来,脂质体(liposomes,Lip)作为药用中间载体成为了一大热点,其类脂双分子层结构具有良好的生物相容性以及药物包载能力[9],但是脂质体溶液的流动性,不宜长时间滞留在皮肤表面。而将脂质体均匀混合在凝胶基质中制备的脂质体凝胶剂,能解决流动性问题[10],同时也具备提高药物滞留时间、稳定性、缓释性以及减少药物本身的刺激性等优点[11]。因此,本研究将黄芩苷制备成脂质体凝胶,对其进行质量评价,考察流变学性质、初步稳定性以及体外经皮渗透,在此基础上,以兔耳痤疮模型来评价Bai-Lip-Gels的初步药效学,为将黄芩苷开发成治疗轻、中度痤疮的外用制剂提供参考。
1 仪器与材料
1.1 仪器
千分之一电子天平、十万分之一电子天平,德国Mettler Toledo公司;pHS-4C+智能型酸度计,成都世纪方舟科技有限公司;MCR302流变仪,安东帕;DV3T粘度计,德国Brookfield公司;Agilent1260高效液相色谱仪,美国安捷伦公司;NanoZS90激光粒度仪,英国马尔文仪器有限公司;JY90-IIN超声波细胞粉碎机、ST16R高速冷冻离心机,宁波新芝生物科技股份有限公司;RV10旋转蒸发仪、RW20顶置式搅拌器,德国IKA集团;优普纯水机,四川优普超纯科技有限公司;JEM-1200EX透射电子显微镜(TEM),日本JEOL公司;Epoch酶标检测仪,美国BioTek Instruments公司。
1.2 动物
健康SPF级SD雄性大鼠,200~250 g,成都达硕实验动物有限公司,许可证号:SCXK(川)2019-031。
清洁级雄性新西兰兔,质量2.0~2.5 kg,购于成都达硕动物养殖中心。饲养于成都医学院实验动物中心动物室,使用许可证:SYXK(川)2020-196,清洁级,温度18~20 ℃,相对湿度40%。
本实验过程中所有动物实验均符合成都医学院实验动物伦理审查委员会相应的审查要求。
1.3 试剂
黄芩苷对照品,成都曼思特生物科技有限公司,批号15112909,质量分数99%;黄芩苷原料药(批号G07S11L123706,质量分数90%)、大豆卵磷脂(批号T12O10F99737)、维生素E(批号D20D9S77848),上海源叶生物科技有限公司;胆固醇,批号2020010101,成都市科隆化学品有限公司;聚山梨酯80,天津市科密欧化学试剂有限公司;卡波姆974P,批号22318012,美国Lubrizo公司;氯仿,天津市大茂化学试剂厂;甲醇,色谱纯,赛默飞世尔科技有限公司;氢氧化钠,批号190501,四川金山制药有限公司;中性树胶,批号10004160,国药集团化学试剂有限公司;痤疮丙酸杆菌,批号336443,河南省微生物菌种保藏中心;油酸,嘉兴科隆化工有限公司;兔肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、兔白细胞介素(interleukin,IL)-1β、IL-6、IL-8酶联免疫分析(批号ml0016961、ml027836、ml051629、ml027347),上海酶联生物科技有限公司;所用纯化水为实验自制超纯水。
2 方法与结果
2.1 黄芩苷含量测定
2.1.1 色谱条件 色谱柱为Welchrom-C18柱(250 mm×4.6 mm,5mm);流动相为甲醇-0.1%磷酸水溶液(47∶53,磷酸调pH值至2.20±0.05);体积流量1.0 mL/min;检测波长280 nm;柱温35 ℃;进样量20mL。
2.1.2 供试品溶液的配制 取Bai-Lip-Gels 1.0 g,置于10 mL量瓶中,加流动相溶解定容至刻度线,同法制备3份,微孔滤膜滤后,吸取滤液1 mL至10 mL量瓶中,加流动相稀释至刻度,摇匀,即得供试品溶液,待测定。
2.1.3 专属性考察 称取黄芩苷对照品10.00 mg,置于100 mL量瓶中,用流动相溶解并定容至刻度,制成100 μg/mL对照品储备液。精密量取储备液5 mL,置于10 mL量瓶中,使用流动相稀释并定容至刻度,制成50 μg/mL的对照品溶液;称取空白脂质体凝胶1.00 g,置于10 mL量瓶中,加流动相溶解并定容至刻度;称取Bai-Lip-Gels 1.00 g,置于10 mL量瓶中,加流动相溶解并定容至刻度;分别取上述溶液,按“2.1.1”项下色谱条件测定,记录色谱峰,考察系统适应性。结果见图1,结果表明,空白的脂质体凝胶基质不会干扰黄芩苷的测定,方法专属性较高。
2.1.4 线性关系考察 称取黄芩苷对照品10.00 mg于10 mL量瓶中,加甲醇溶解稀释并定容至刻度,得到1 mg/mL的对照品母液。吸取母液各50、100、200、300、400、600、800mL于10 mL量瓶中,加甲醇稀释定容至刻度,制得质量浓度分别为5、10、20、30、40、60、80 μg/mL的系列对照品溶液。采用高效液相色谱仪进行测定。以黄芩苷质量浓度为横坐标(),峰面积为纵坐标()进行线性回归,得到标准曲线为=62.171-29.414,2=0.999 8,表明黄芩苷在5~80mg/mL线性关系良好。

A-黄芩苷对照品 B-Bai-Lip-Gels C-空白凝胶基质
2.1.5 精密度试验 取黄芩苷对照品溶液,按“2.1.1”项下色谱条件,连续进样测定6次,记录峰面积,计算得黄芩苷峰面积RSD为1.38%,表明实验仪器精密度良好。
2.1.6 稳定性试验 按“2.1.2”项下方法配制10、30mg/mL黄芩苷的供试品溶液,分别在室温下于0、2、4、6、8、10、12、24 h进样测定,记录峰面积。结果显示,10、30mg/mL黄芩苷的供试品溶液在24 h内峰面积的RSD分别为0.33%、0.38%,表明在24 h内供试品溶液稳定性良好。
2.1.7 重复性试验 取Bai-Lip-Gels 6份,按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定,记录峰面积,计算黄芩苷质量分数的RSD为2.78%,表明本实验重复性良好。
2.1.8 加样回收率试验 按“2.1.2”项下方法配制低、中、高质量浓度(10、30、60mg/mL)黄芩苷的供试品溶液各3份,分别加入处方比例量的辅料,进液相测定。结果显示,高、中、低质量浓度回收率均在95%~105%,平均回收率为100.03%,RSD为0.25%。
2.2 黄芩苷脂质体(baicalin liposomes,Bai-Lip)的制备工艺优化
2.2.1 Bai-Lip的制备 在前期脂质体制备方法筛选的基础上,采用薄膜分散法[12]制备Bai-Lip。称取处方量的大豆卵磷脂、胆固醇、维生素E和聚山梨酯80在氯仿和甲醇混合液中溶解混合均匀,置于旋转蒸发器上,在28 ℃、55 r/min转速下制得类脂薄膜,加入由磷酸盐缓冲液(PBS)溶解的处方量黄芩苷,在45 ℃、低压、旋蒸震荡制得Bai-Lip,将制得的Bai-Lip放置常温后冰箱冷藏一定时间,随即将冷藏后的样品通过探针式超声,滤膜滤过,整粒得到Bai-Lip。
2.2.2 Bai-Lip包封率测定 取Bai-Lip 1 mL于4 ℃条件下高速冷冻离心15 min(14 000 r/min),精密吸取上清液适量,定容到1 mL,在上述“2.1”项HPLC条件测定其中黄芩苷的含量作为游。另取1 mL脂质体,以10倍量的甲醇进行破乳,测定其中黄芩苷的含量作为总,计算包封率。
包封率=(总-游)/总
2.2.3 处方工艺的单因素考察 制备Bai-Lip,固定处方中其他比例不变(基于平衡溶解度实验确定黄芩苷用量15 mg、水化转速55 r/min),分别对有机溶剂(氯仿、甲醇及氯仿-甲醇2∶1、1∶1、1∶2)、类脂比(胆固醇-磷脂4∶9、3∶10、2∶11、1∶12)、水化温度(30、35、40、45 ℃)、探超振幅(20、40、60、80、100 W)、水化体积(1、2、3、4、5 mL)、水化时间(25、35、45、55、65 min)进行单因素考察,结果见表1~6。采用NanoZS90激光粒度仪和HPLC法测定Bai-Lip的粒径及包封率,以考察各因素对脂质体纳米粒的粒径及包封率的影响。

表1 溶剂种类对Bai-Lip的粒径及包封率的影响(, n = 3)

表2 类脂比对Bai-Lip的粒径及包封率的影响(, n = 3)

表3 水化温度对Bai-Lip的粒径及包封率的影响(, n = 3)

表4 探超振幅对Bai-Lip的粒径及包封率的影响(, n = 3)

表5 水化体积对Bai-Lip的粒径及包封率的影响(, n = 3)
2.2.4 各因素与包封率的相关性分析 对各因素与包封率之间进行相关性分析,结果见表7。类脂比和水化体积与包封率之间的相关性显著(<0.01),其他因素对Bai-Lip包封率影响不明显,其影响依次为类脂比>水化体积>水化时间>水化温度>溶剂比例>探超功率。后续的处方工艺的优化将从类脂比、水化体积等因素入手。

表6 水化时间对Bai-Lip的粒径及包封率的影响(, n = 3)
2.2.5 响应面法优化处方 根据各因素与包封率之间进行相关性分析,选取影响较大的因素水化体积(1)、类脂比(2)、水化时间(3),进行工艺优化,采用3因素3水平进行实验设计,Box-behnken试验设计及结果见表8,共进行17次实验。采用Design-Expert 12软件进行处理。并对得到的结果进行相应的验证和对比,以此来判断制备工艺的优势和可靠性。
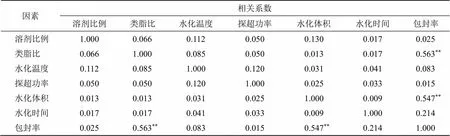
表7 各因素与包封率的相关性分析结果
**相关系数在0.01水平上显著(双侧)
**the correlation coefficient is significant at the 0.01 level (two-sided)

表8 Bai-Lip处方工艺Box-behnken试验设计及结果
模型拟合及方差分析以包封率()为响应值,应用Design Expert 12软件分别对1(类脂比)、2(水化体积)、3(水化时间)进行多元线性回归和二项式拟合,得到回归方程=64.90+1.911+1.912+2.533-1.1312-0.2013-0.1523-7.5112-6.6122-5.0932,2=0. 984 4。
由表9可知,表明实验模型有很高的显著性 (值=48.99,<0.000 1),该方程与实际情况拟合较好。失拟项值=1.38,=0.369 1,说明失拟项不显著,未知因素对试验结果干扰小。3种因素都有比较明显的影响(<0.01),影响Bai-Lip制 备的显著性排列顺序为水化时间>水化体积=类脂比。模型的相关系数2=0.984 4,因此,可以用此模型方程对制备的脂质体的实验结果进行合理分析。
采用响应面对其优化和预测,应用Design- Expert 12软件,基于二项式拟合模型,固定3个变量中的1个变量,绘制另外2个变量对包封率影响的三维响应面,结果见图2。

表9 Bai-Lip包封率回归模型方差分析

图2 各因素相互关系及包封率的三维响应面和等高线图
经软件分析筛选,得到Bai-Lip的最优制备工艺参数为水化时间47 min,类脂比3∶10,水化体积3 mL,预测包封率分别为65.7%。
2.3 脂质体的形态粒径及包封率
2.3.1 形态观察 取适量脂质体,移取PBS液进行10倍体积稀释。稀释后再移取20 μL溶液,置于铜网上吸收后,加1%磷钨酸适量染色1 min,自然风干后,TEM下观察其形状并进行拍照,结果见图3。可见脂质体呈规则球形,结构完整,分散均匀。
2.3.2 平均粒径及Zeta电位 取适量Bai-Lip,用PBS缓冲液10倍体积稀释,采用马尔文激光粒度仪对脂质体的粒径分布及Zeta电位进行测定。其平均粒径为(212.300±0.424)nm,分布均匀,多分散指数(polymer dispersity index,PDI)为0.217±0.012,Zeta电位为(−32.4±0.9)mV。

图3 Bai-Lip的外观及TEM图
2.3.3 验证试验 通过相应的优选处方进行溶液的配制,选择3批样品,并将包封率作为一个验证标准。结果见表10。其中优选配方的平均包封率为63.9%,与预测包封率(65.7%)较为接近。进一步表明处方的可行性。

表10 脂质体制剂处方验证试验结果
2.4 Bai-Lip-Gels的制备
脂质体为液体剂型,在皮肤上的保留时间较短,为了使药物长时间与皮肤接触,需采用凝胶基质对其进行赋形。称取卡波姆974P 0.5 g置于烧杯中并加入15.0 g纯化水使其在搅拌器中先低转速再高转速搅拌溶胀,待溶胀充分,形成透明、细腻、无颗粒感的凝胶后加入适量的5% NaOH溶液调节pH值,使pH值在6.5~7.5,即得空白凝胶基质。
取新制备的脂质体溶液、黄芩苷混悬液各30 mL加入至空白凝胶中抽真空缓慢搅拌形成Bai-Lip-Gels和黄芩苷混悬凝胶,形成的凝胶中黄芩苷的含药量为3 mg/g。
2.4.1 黏度测试 采用DV3T旋转粘度计[13],计算2~5 min的单点平均值即为Bai-Lip-Gels的黏度。由表11可知,黏度计在25 ℃、转速20 r/min条件下测得3批的黏度差异不大,扭矩在40%~60%,测得的黏度值可信,黏度在33~35 Pa∙s,表明制备的凝胶具有良好的重现性。
2.4.2 流变学表征 流变学作为常见研究黏弹性流体力学性质的重要试验[14],是作为表征流变性质的特征量[15]。本实验运用流变学方法,通过测量凝胶的流变参数,考察该凝胶在不同剪切应力或者剪切应变条件下测试黏度扫描、屈服应力扫描以及振幅扫描,评价所形成凝胶的力学性能,为Bai-Lip-Gels体外评价及全面质量控制提供参考和借鉴。

表11 Bai-Lip-Gels黏度测试
安东帕流变仪程序中选择测量的项目模板,仪器预热30 min后,先将Bai-Lip-Gels置于下板中央,再用平面刮刀将多余的样品刮掉,待准备就绪后,运行仪器。
黏度曲线确定凝胶的流变类型以及样品的触变回复能力。程序参数为剪切速率0.01~100 s−1/100~0.01 s−1对数变化;取样时间:20~1 s/1~20 s,对数变化,41个取样点;温度设定为25 ℃。Bai-Lip- Gels黏度曲线见图4。由图4可知,随着剪切速率的增大,Bai-Lip-Gels的黏度逐渐变稀,表明该凝胶属于剪切变稀流体,即假塑性流体。
针对非牛顿流体,在施加的剪应力较小时流体只发生变形,不产生流动[16],当剪切应力增大到某一定值时该凝胶才开始流动,此时的剪切应力达到最大值也称为该凝胶的屈服应力。程序参数:剪切速率恒定值0.2 s−1,测试点取点时间1 s,数据点60个点,结果见图5。
振幅扫描对凝胶施加剪切应力或者剪切应变在一定范围内时,凝胶的结构产生弹性形变,并且产生的形变能够回复,结构没有被破坏,此时相应的应力或应变为凝胶的线性黏弹区。当施加的应力或应变产生的形变不能回复时,此区域为凝胶的非线性黏弹区。通过对Bai-Lip-Gels进行振幅扫描来确定样品的线性粘弹区,在此区域样品为凝胶状态,当储能模量(′)与损耗模量(′′)相等时,此时为样品的流动点,见图6。程序参数:剪切应变0.02%~100%,角频率5 rad/s,取点时间30~1 s/1~30 s,共41个取样点,温度25 ℃。

图4 黏度扫描测试

图5 屈服应力测试
制备3批Bai-Lip-Gels,进行流变学测试:黏度曲线扫描、屈服应力扫描以及振幅扫描测试,得到该凝胶的相关流变学特性,结果见表12。由表12可知,黏度曲线扫描可知,剪切速率为0.1、1、10 s−1时,3批样品对应的黏度变化范围不大。振幅扫描可知,当储能模量′大于400 Pa时,样品处于线性黏弹区,此时样品呈凝胶状态。由屈服应力扫描结果可知,剪切应力在70~90 Pa为该凝胶的屈服应力值,3批脂质体的流变数据较为稳定,无明显差异,表明该凝胶剂的流变性质稳定。
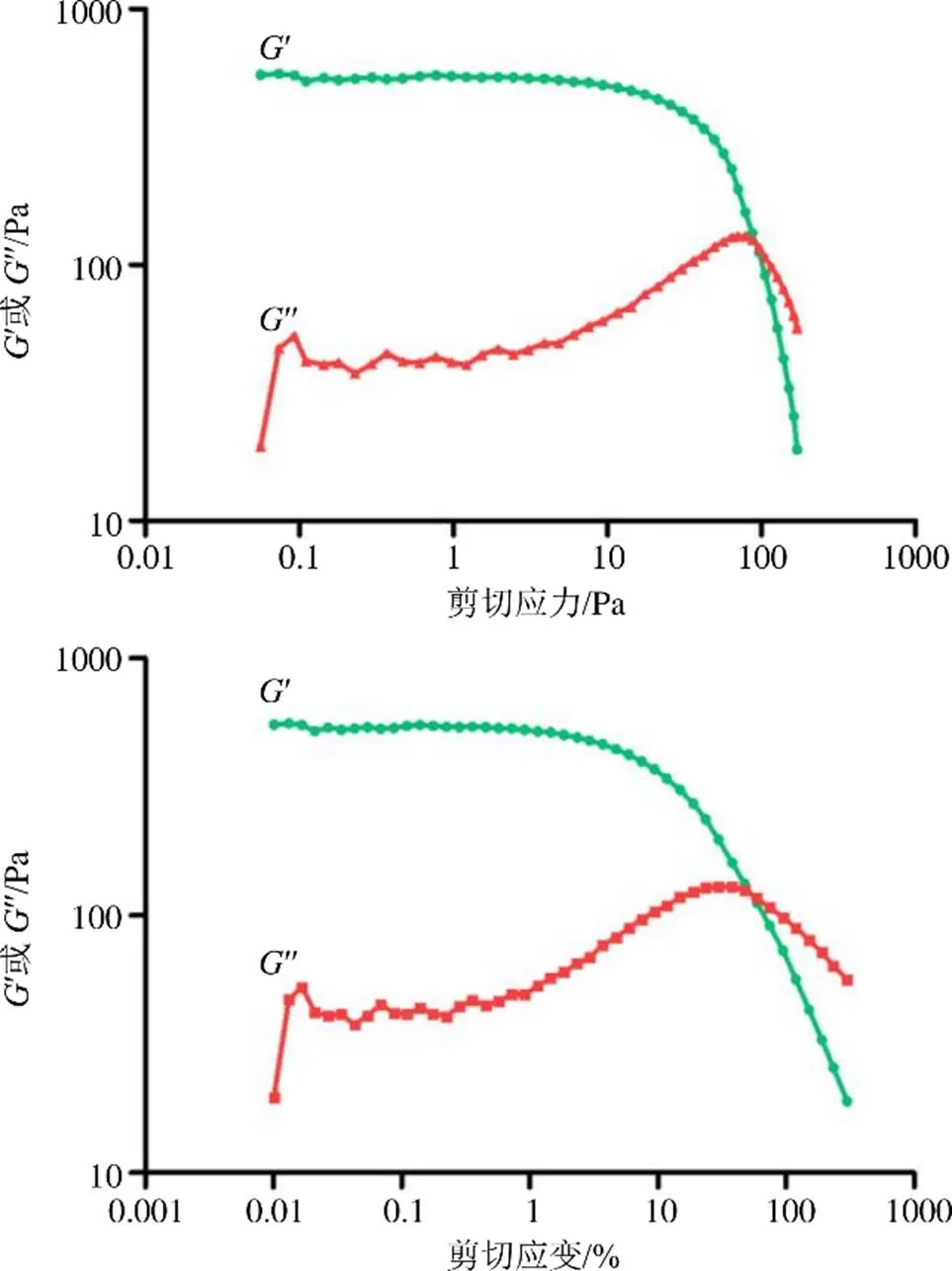
图6 振幅扫描测试

表12 Bai-Lip-Gels流变学测试
-剪切速率-剪切应力rel-触变面积
-share rate-shear stressrel-thixotropic area
2.4.3 Bai-Lip-Gels的初步稳定性考察 本品进行肉眼外观的考察,为淡黄色、细腻、均匀性良好、粘度适中的半固体凝胶,见图7,取1.0 g加纯化水稀释至10 g,分散均匀后,用pH计测得其pH值为6.42±0.13。

图7 Bai-Lip-Gels外观图
取Bai-Lip-Gels 3批,分别装入西林瓶中,于4 ℃冷藏条件下放置30 d,分别在第7、14、21、30天取样[17],与第0天样品比较,Bai-Lip-Gels的外观性状、黏度及含量的变化,含量测定按“2.1”项下的HPLC方法进行检测,结果见表13。由表13可知,存放于4 ℃冷藏条件下30 d,其外观性状、黏度和含量均无明显变化,表明Bai-Lip-Gels在此条件下状态稳定。
2.4.4 透析袋释放实验 分析比较Bai-Lip-Gels与黄芩苷混悬剂凝胶体(Bai-Sus-Gels)外释放度[18]。500 mL PBS等渗缓冲液作为释放介质,温度32 ℃,搅拌速度控制在300 r/min,确保释放介质的流动性良好。在1、2、4、6、8、10、12、18、24、36 h,按时取样,每次取样3 mL,并补充3 mL等温释放介质,采用“2.1”项下的HPLC法测量黄芩苷含量。
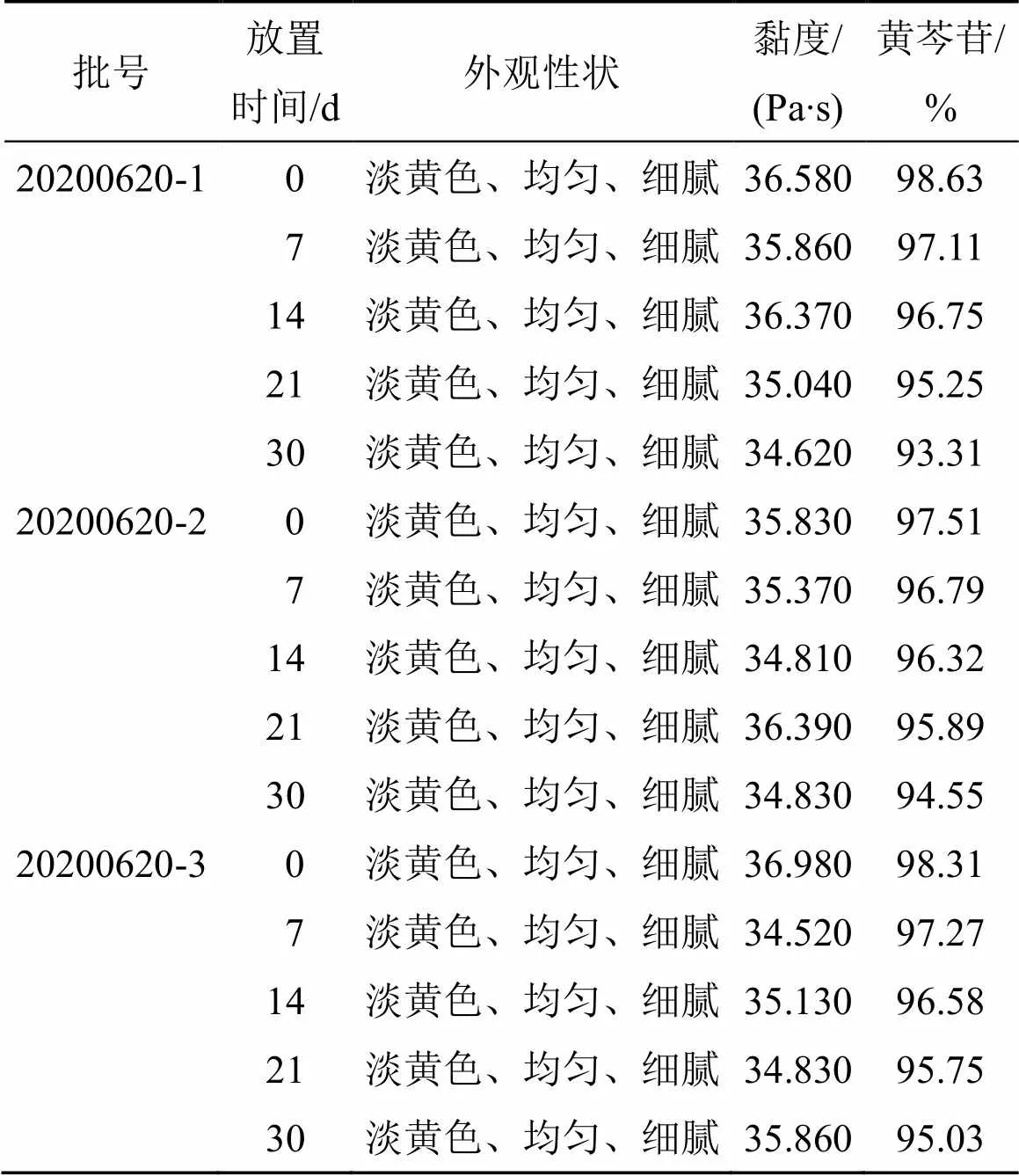
表13 Bai-Lip-Gels4 ℃冷藏试验
实验表明,Bai-Sus-Gels有着较快的释放速度,在12 h前释放较快,且在12 h时,其释放率已经超过了90%,在18 h之后,释放趋于稳定。Bai-Lip-Gels中药物释放在前2 h释放较快,由未包封的黄芩苷释放所引起,2 h后释放速率开始变缓慢,表现出缓释的效果,36 h内释放68.53%,见图8。
2.4.5 离体皮肤透皮实验 将SD大鼠采用随机数字表将其分为2组,腹部备皮,剥离腹皮,刮去角质层以及浅表层脂肪,用生理盐水洗净后剪成若干份相同大小的腹部组织,置于无菌生理盐水中,放入−20 ℃冰箱保存备用。

图8 Bai-Lip-Gels与Bai-Sus-Gels 36 h累积释放率曲线(, n = 5)
将处理好的大鼠腹皮从−20 ℃冰箱中取出,用生理盐水浸泡半小时。等渗PBS(pH 7.4)作为透皮吸收试验的接收液。皮肤角质层面向供给池,且鼠皮面积略大于扩散池表面积,置于Franz扩散池的供给池与接收池结合处,用夹子固定[19]。先用接受液平衡30 min后给药[20]。将Bai-LiP-Gels与Bai- Sus-Gels分别涂于2组大鼠腹部皮肤表面,接触面积为3.14 cm2,水浴恒温至(32.0±0.5)℃,300 r/min恒速搅拌。于1、2、4、6、8、10、12、18 h从接收池中取3 mL并补加相同量的释放介质。样品置于13 500 r/min下冷冻离心15 min后,采用“2.1”项下的HPLC法测定药物含量,计算单位面积累积渗透量(Q,图9)。

Ci表示为第i个时间点测定的药物质量浓度(mg/mL),Vi表示为第i个时间点的取样体积(mL),CnVn表示为第i-1个时间点的总药物渗透量,A则为接收池面积(cm2),本实验中,V=3 mL,A=3.14 cm2
对2种凝胶在18 h内的经皮渗透的单位面积累积渗透量(18)进行计算,结果详见表14,Bai-LiP- Gels在18 h的单位面积累积渗透量(81.38±2.81)μg/cm2远高于Bai-Sus-Gels的(43.03±2.14)μg/cm2,Bai-LiP-Gels在累积透皮率上更加优异。对Bai-Lip- Gels和Bai-Sus-Gels的单位面积累积渗透曲线进行方程拟合,结果见表15,Bai-Lip-Gels的经皮渗透符合一级方程要求,而Bai-Sus-Gels经皮渗透符合零级方程。

表14 Bai-Lip-Gels与Bai-Sus-Gels各时间点的Qn (, n = 5)
2.5 对痤疮的初步药效学评价
2.5.1 兔耳痤疮造模 选用清洁级雄性新西兰兔18只,采用Kligman法造模[21],每天用棉签将油酸外涂抹于双侧兔耳管开口2 cm×2 cm处,每日1次,连续15 d。于涂抹油酸第3天时同时涂抹.菌液,100 μL/耳,选用处于对数生长期的.菌液。
造模第1天,兔耳柔软,其上毛细血管清晰可见,未出现角化和粉刺状颗粒生成;造模第7天,毛囊口隆起,有较多黑色角栓物质生成,角化现象加重,粉刺状颗粒物增多;造模第14天,兔耳红肿明显,有隆起的丘疹和脓疱,表明痤疮造模成功。见图10。
造模结束后,分别随机选取空白兔耳朵和模型兔耳进行染色切片,染色结果见图11。其中造模兔耳染色切片,毛囊周围大量细胞浸润,真皮毛囊数量增多,周围有炎症细胞浸润,表皮层增厚,角化不全等现象,表明兔耳痤疮造模成功。

表15 Bai-Lip-Gels与Bai-Sus-Gels释放曲线方程拟合
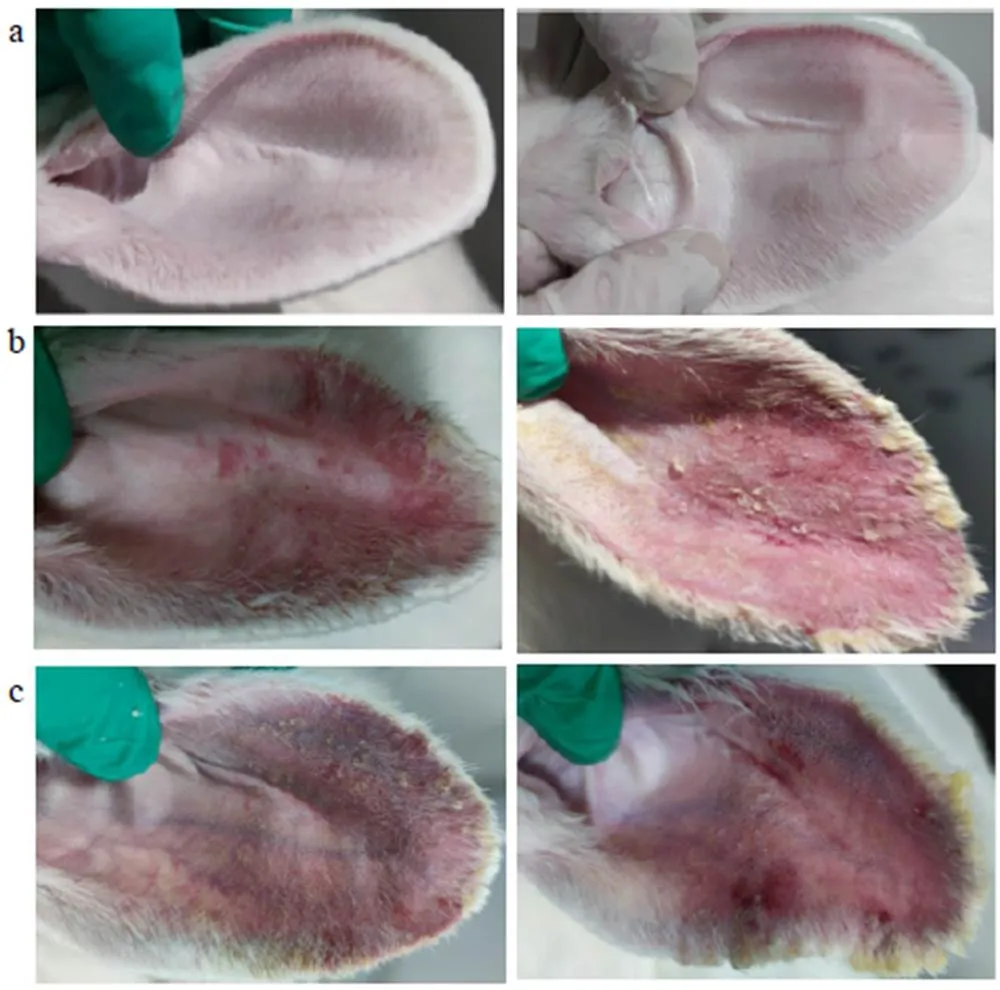
a-造模后第1天兔耳 b-造模后第7天兔耳 c-造模后第14天兔耳
2.5.2 分组及给药 查阅痤疮临床指南,选用治疗轻、中度痤疮的一线药物阿达帕林凝胶作为阳性对照;以空白脂质体凝胶作为阴性组。

A-空白组病理学观察 B-痤疮造模组病理学观察,图B中为毛囊口,为表皮层,为角质层
18只清洁级雄性新西兰兔,质量2.0~2.5 kg,适应性饲养1周后,随机分为6组,分别为正常对照组:不采用痤疮造模及用药治疗;模型实验组:造模成功后,不采用任何药物治疗;Bai-Lip-Gels组、Bai-Sus-Gels组、阳性对照组和阴性对照组分别在痤疮病损处涂抹约1 g,2次/d,治疗用药21 d。给药结束后,每组新西兰兔随机选取一只进行兔耳H&E染色切片,对其给药后的疗效进行病理组织分析[22],结果见图12。正常组兔耳皮肤结构完整,无慢性炎症改变;模型组细胞结构不完整,皮脂腺增大,角质化堵塞严重[23],呈急慢性炎症改变;阴性组存在大量单核细胞、中性粒细胞浸润,呈急慢性炎症改变;Bai-Sus-Gels组的细胞层结构紊乱,组织炎性程度较重;Bai-Lip-Gels组在组织病理形态学上与正常组较接近,角质化程度、局部组织充血、炎性程度等方面得到改善;阳性药物组毛囊角质化依然明显,在炎性细胞的聚集、角质化等方面有所改善。
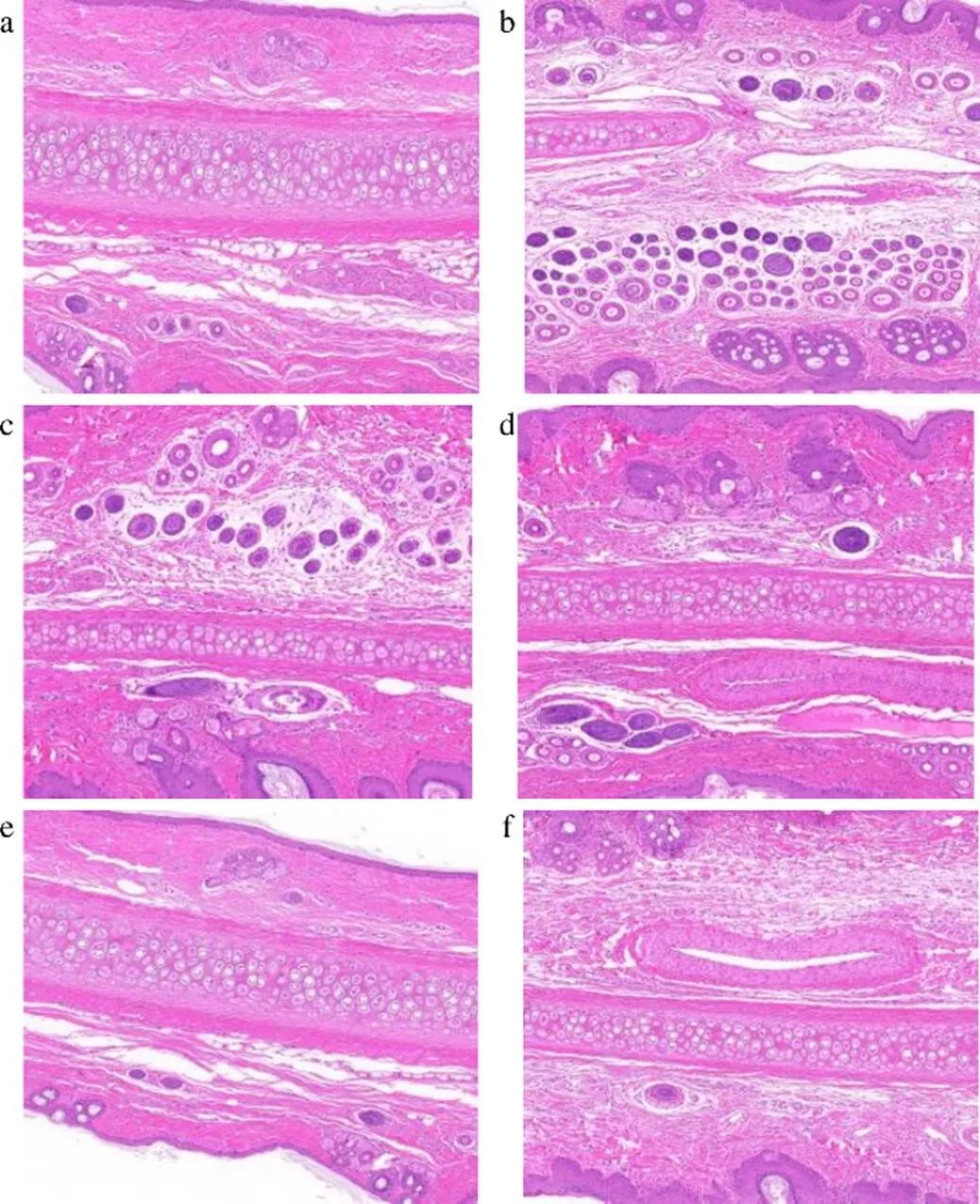
a-正常对照组 b-模型组 c-阴性对照组 d-Bai-Sus-Gels组 e-Bai-Lip-Gels组 f-阳性对照组
2.5.3 ELISA法测定兔耳痤疮模型血清中的炎症因子水平 在兔耳痤疮造模15 d时,在医用酒精消毒条件下,取造模兔耳的耳缘静脉血2 mL/只,随即用低温离心机离心5 min(4 ℃、3500 r/min),然后静置30 min取上清液分装于离心管中,保存在−80 ℃冰箱中待检测。在分组给药21 d时,分别取6组兔耳耳缘静脉血2 mL/只,同上方法操作,低温离心,取静置后上清液于离心管中,在−80 ℃冰箱中保存待检。采用酶联免疫吸附(ELISA)法检测家兔兔耳痤疮模型血清中TNF-α、IL-1β、IL-6和IL-8的含量。
(2)血清中TNF-α、IL-1β、IL-6、IL-8浓度变化:由表16可知,与模型组对比,正常组和Bai-Lip- Gels组血清中TNF-α、IL-1β、IL-6、IL-8的质量浓度水平均非常显著性的低于模型组(<0.001)。表明Bai-Lip-Gels能显著性降低兔耳痤疮的炎症因子水平,其中阳性药物组中血清中TNF-α的质量浓度水平非常显著的低于模型组(<0.001);而阳性药物组中IL-1β和IL-8的质量浓度水平极为显著低于模型组(<0.01);阳性药物组中IL-6的质量浓度水平则显著低于模型组(<0.05)。由以上统计学结果可以大致了解脂质体凝胶组与阳性药物组对兔耳痤疮的炎症因子水平均有显著性降低,但是脂质体凝胶组在降低炎症因子质量浓度的疗效更好。

表16 各组家兔血清中TNF-α、IL-1β、IL-6、IL-8水平(, n = 6)
与模型组比较:*<0.05**<0.01***<0.001;与正常对照组比较:#<0.05##<0.01###<0.001
*< 0.05**< 0.01***< 0.001model group;#< 0.05##< 0.01###< 0.001normal control group
3 讨论
中医认为,痤疮的发生发展和外受风邪、毒热互结、肝肾阴虚、冲任失调、肺经藴热、湿热蕴结、痰湿互结等有关。从中医视角来研究痤疮,形成了以“湿”“热”为辩证核心,重点从肺、肝、脾、肾来论治的思路[25]。现阶段,临床上治疗重度痤疮以口服抗生素为主,包括异维A酸软胶囊、多西环素片、红霉素片等,这些药物普遍存在着疗效周期长、容易产生耐药性、副作用多等问题。轻、中度痤疮以局部外用药物为主,包括阿达帕林凝胶、红霉素软膏等,但受阻于角质层的屏障功能,此类药物不能持续有效透过皮肤,难以达到让人满意的疗效。在中医古籍中记载痤疮治疗的外用方或是内服方[26],黄芩高频率的作为君药使用。与痤疮以“湿”“热”为辩证核心的论治思路相统一的是,中药黄芩具有清热燥湿、泻火解毒的功效[27],其提取物黄芩苷是其所有提取物中最具抗炎活性的物质[2],相关研究表明[3],在同样浓度下,黄芩苷对于痤疮丙酸杆菌的抑制作用是甲硝唑的2倍左右,而与同浓度的红霉素相比,药效也在1.5倍以上。因此,将中药单体黄芩苷制备成外用制剂具有较大的潜力。
通过单因素试验考察了6个因素对Bai-Lip粒径和包封率的影响,研究发现粒径可以通过适宜的探超功率来控制粒径大小,而包封率需要通过多个因素来综合评价。在形成Bai-Lip的前提下,水化温度越高越不利于后续的稳定性储存,随着储存时间的延长,容易导致脂质体破相,药物泄露出来。前期的预实验以及单因素考察结果表明,40 ℃左右作为水化温度制备样品,在脂质体后期的稳定性试验考察中发现是最为稳定的。
单因素考察筛选出对Bai-Lip的包封率影响较大的3个因素,可以减少Box-Behnken设计-响应面试验的因素,减少试验次数,得到较优的处方工艺参数。根据最优工艺参数制备的脂质体包封率较大,且实测值与预测值偏差较小,表明Box-Behnken设计-响应面具有较好的预测性,可用于Bai-Lip的处方和制备工艺的优化设计。
根据透析袋释药结果,选取0~18 h做离体皮肤透皮试验,Bai-Lip-Gels在18 h内的单位面积累积渗透量能达到(81.38±2.81)μg/cm2,是Bai-Sus- Gels累积渗透量的1.88倍,并对Bai-Lip-Gels和Bai-Sus-Gels的释放曲线进行了方程拟合,Bai-Lip凝胶体外经皮渗透规律符合一级方程,且方程拟合系数大于0.99,Bai-Sus-Gels经皮渗透规律更符合零级方程,方程拟合系数大于0.98,提示了2种制剂的释放机制不同。
油酸堵塞兔耳毛囊,涂抹痤疮丙酸杆菌15 d后,痤疮模型造模成功。给药21 d后,从组织病理染色结果来观察脂质体凝胶组的疗效比较显著,主要体现在减轻角质化程度、局部组织充血、炎性程度等方面。通过给药治疗后,兔耳痤疮模型血清中TNF-α、IL-1β、IL-6、IL-8分泌的影响发现,Bai-Lip- Gels能显著降低兔耳痤疮的炎症因子水平。说明Bai-Lip-Gels在短期治疗轻、中度痤疮具有良好的疗效。
综上所述,本实验成功制备的Bai-Lip-Gels为治疗因痤疮丙酸杆菌引发炎症引起的痤疮提供了制剂的依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Ma A T, Zhong X H, Liu Z M,. Protective effects of baicalin against bromocriptine induced abortion in mice [J]., 2009, 37(1): 85-95.
[2] 苏青, 吴婷婷, 黄雅兰, 等. 黄芩提取物制备过程中化学成分及药效的变化规律分析 [J]. 中国实验方剂学杂志, 2018, 24(14): 1-6.
[3] Hamza M, Tohid H, Maibach H. Shaving effects on percutaneous penetration: Clinical implications [J]., 2015, 34(4): 335-343.
[4] Xing J, Chen X, Zhong D. Absorption and enterohepatic circulation of baicalin in rats [J]., 2005, 78(2): 140-146.
[5] 张建春, 张华, 施瑛, 等. 黄芩苷的研究近况 [J]. 时珍国医国药, 2005, 16(3): 247-249.
[6] 陈遥. 黄芩苷外用制剂透皮吸收及初步药效学研究 [D]. 广州: 广东药学院, 2015.
[7] 熊欣, 刘淑芝, 顼佳音, 等. 黄芩苷脂质载体凝胶的制备及其体外透皮性能评析 [J]. 中国实验方剂学杂志, 2012, 18(12): 28-30.
[8] 储晓琴, 王琦, 刘玉娟, 等. 黄芩苷脂质体凝胶体外释药与稳定性研究 [J]. 安徽中医学院学报, 2013, 32(4): 80-83.
[9] 周婷, 黎春燕, 李运, 等. 正交设计法优化羟基喜树碱脂质体处方工艺 [J]. 中药材, 2019, 42(9): 2128-2132.
[10] 赖滢滢, 周若鹏, 张英丰, 等. 蛇床子素脂质体凝胶剂的制备及其体外透皮试验的初步研究 [J]. 广东药学院学报, 2016, 32(1): 5-8.
[11] 史亚军, 张小飞, 果秋婷. Box-Behnken效应面法优化紫杉醇长循环脂质体处方及制备工艺 [J]. 中药材, 2015, 38(12): 2606-2610.
[12] Hou L F, Gu K R, Wu Y H. Research on preparation methods of different preparation liposome [J]., 2016, 37(5): 118-124.
[13] 陈林. 布地奈德直肠原位温敏凝胶的制备及评价 [D].成都: 成都医学院, 2020.
[14] Azeem M, Mu T H, Zhang M. Effects of hydrocolloids and proteins on dough rheology andstarch digestibility of sweet potato-wheat bread [J]., 2021, 142.https://doi.org/10.1016/j.lwt.2021.110970.
[15] 魏刚. 体温敏感眼用凝胶的研究 [D]. 沈阳: 沈阳药科大学, 2002.
[16] 邱爽, 宋铮, 张璟琳, 等. 细菌素bifidocin A对凝固型发酵乳品质及贮藏性能的影响 [J]. 中国食品学报, 2020, 20(9): 156-165.
[17] 李传灵. 叶黄素脂质体眼用温敏型原位凝胶的研究 [D]. 南昌: 江西中医药大学, 2019.
[18] 郑杭生, 黄绳武, 徐莲英. 全缘千里光碱脂质体及其凝胶剂的体外释药比较研究 [J].中成药, 2013, 39(9): 2027-2030.
[19] 肖卫红, 徐宏峰, 张耕, 等. 高乌甲素脂质体凝胶制备工艺及体外释药性能研究 [J]. 中国医院药学杂志, 2019, 39(5): 466-470.
[20] 仵文英, 李莎, 徐晓娜, 等. 苦参碱脂质体的稳定性及体外释放度研究 [J]. 中国药房, 2013, 24(37): 3542-3544.
[21] 谢碧. 丹连消痤散外用对兔耳痤疮模型TNF-α、TNFR1、ERK含量影响的实验研究 [D]. 哈尔滨: 黑龙江省中医药科学院, 2019.
[22] Han R, Blencke H M, Cheng H,. The antimicrobial effect of CEN1HC-Br againstand its therapeutic and anti-inflammatory effects on acne vulgaris [J]., 2018, 99: 36-43.
[23] 胡彬. 不同浓度的石榴皮多酚软膏对兔耳粉刺模型组织病理形态学的影响 [D]. 长沙: 湖南中医药大学, 2017.
[24] 马英, 项蕾红. 痤疮发病机制及治疗目标的新认识 [J]. 临床皮肤科杂志, 2015, 44(1): 66-69.
[25] 周晓梅. 寻常痤疮的外治综述 [J]. 名医, 2020(13): 52-53.
[26] 杨星哲. 黄芩苷治疗痤疮丙酸杆菌引起痤疮的分子机制研究 [D]. 北京: 北京中医药大学, 2019.
[27] 高光武, 李玲. 黄芩提取物的抗炎作用及其作用机制研究 [J]. 中国临床药理学杂志, 2014, 30(6): 550-552.
Preparation, quality evaluation of baicalin liposomes gels and its pharmacodynamic evaluation for acne
WANG Jia-hui, CHEN Lin, SUN Ping, CHEN Zi-hao, LI Hai-yan, SU Qing
College of Pharmacy,Chengdu Medical College, Chengdu 610500, China
To prepare baicalin liposomes gels (Bai-Lip-Gels), evaluate its quality, and investigate its efficacy in treating mild and moderate acne.Firstly, a single factor test was used to investigate the influence of the formulation process on the preparation of liposomes with the encapsulation efficiency and particle size as evaluation indicators. Secondly, the correlation between each factor and the encapsulation efficiency was used to select the significant factors affecting the preparation of liposomes, and then, the Box-Behnken effect surface method was used to further optimize the prescription process. Moreover, Bai-Lip-Gels was prepared, and characterized by rheology, and its stability was preliminarily investigated, and the drug release of Bai-Lip-Gels was investigated through the dialysis bag release test and theskin transdermal test performance. Finally, the pharmacodynamics of Bai-Lip-Gels was evaluated for rabbit ear acne.The baicalin liposomes (Bai-Lip) were successfully prepared, with an encapsulation efficiency of 63.9%; Under the transmission electron microscope, the liposomes were in a regular spherical shape, with complete structure and uniform dispersion. The particle size was (212.300 ± 0.424) nm, polydispersity index (PDI) was 0.217 ± 0.012, Zeta potential was (−32.4 ± 0.9) mV, and the prepared Bai-Lip was stable. The prepared Bai-Lip-gels had stable rheological properties and good storage stability at 4 ℃. The results ofskin permeation test showed that the cumulative permeation per unit area in 18 h (18) of Bai-Lip-Gels was (81.38 ± 2.81) μg/cm2, which was higher than18of baicalin suspension gels (Bai-Sus-Gels) which was (43.03 ± 2.14) μg/cm2, and the release curve of Bai-Lip-Gels and Bai-Sus-Gels was fitted with equations. The permeation of Bai-Lip-Gelsconformed to the first-order equation, and the transdermal permeation of Bai-Sus-Gels penetration conformed to the zero-order equation. Preliminary pharmacodynamic tests showed that the therapeutic effect of the Bai-Lip-Gels group was significant after administration treatment by histopathological staining, which was mainly reflected in the reduction of keratinization, local tissue congestion, and inflammation. From the effects of TNF-α, IL-1β, IL-6, and IL-8 secretion in the serum of rabbit ear acne model, it is found that Bai-Lip-Gels significantly reduced the level of inflammatory factors in rabbit ear acne, and the curative effect was better than Adapalene gel group.The preparation of Bai-Lip-Gels for the treatment of rabbit ear acne can effectively reduce the degree of keratinization, relieve local tissue congestion, and reduce the level of inflammatory factors, which provides a basis for the development of preparation for the treatment of mild and moderate inflammatory acne.
baicalin; liposomes gels; Box-Behnken design-response surface methodology; percutaneous permeation; acne; inflammation; pharmacodynamics
R283.6
A
0253 - 2670(2021)16 - 4860 - 13
10.7501/j.issn.0253-2670.2021.16.011
2021-04-30
2020年四川省科技创新苗子工程培育及小发明小创造项目;2020年江安县级科技计划项目
王佳辉(1995—),硕士研究生,从事中药提取物及新制剂研究。Tel: 15756327309 E-mail: 1647906146@qq.com
苏 青,博士,副教授,研究生导师,从事中药提取物及新制剂研究。Tel: (028)62739516 E-mail: 74359178@qq.com
[责任编辑 郑礼胜]
