植物生长调节剂对萱草不定芽诱导增殖的影响
2021-08-23李黎曲彦婷韩辉唐焕伟陈菲熊燕
李黎 曲彦婷 韩辉 唐焕伟 陈菲 熊燕

摘 要:为解决金娃娃萱草(Hemerocallis fulva)不定芽诱导过程中诱导率和增殖率较低的问题,采用植物组织培养技术,通过不定芽诱导及继代增殖培养方法,利用显著性分析,筛选出适宜的植物生长调节剂的种类及质量浓度,确定金娃娃萱草的最佳培养方案。结果表明:最佳不定芽诱导培养基为:MS+6-BA1.0 mg/L+NAA0.3 mg/L,诱导率最高可达98.7%,最佳不定芽增殖培养基为:MS+6-BA2.0 mg/L+NAA0.5 mg/L,增殖系数最高可达9.0。由此可知,适宜的植物生长调节剂的种类及浓度可以显著提高萱草不定芽的诱导率和增殖系数。
关键词:金娃娃萱草;不定芽;组织培养;继代增殖;植物生长调节剂
中图分类号:S682.1 文献标识码:A 文章编号:1006-8023(2021)04-0022-05
Effects of Plant Growth Regulators on Adventitious Bud Induction and
Proliferation of Hemerocallis fulva
LI Li1, QU Yanting1*, HAN Hui1, TANG Huanwei2, CHEN Fei1, XIONG Yan1
(1. Institute of Natural Resources and Ecology. HAS, National and Local Joint Laboratory of Wetland and Ecological
Conservation, Harbin 150040, China; 2. Heilongjiang Academy of Sciences, Harbin 150040, China)
Abstract:In order to solve the problem of low induction rate and proliferation rate during adventitious bud induction of Hemerocallis fulva, species and concentrations of plant growth regulators and the best culture scheme were determined by using plant tissue culture technology, adventitious bud induction, multiplication of subculture, and significance analysis. The results showed that the best adventitious bud induction medium was MS+6-BA1.0 mg/L+NAA0.3 mg/L, and the highest induction rate was 98.7%. The best adventitious bud proliferation medium was MS+6-BA2.0 mg/L+NAA0.5 mg/L, the highest proliferation coefficient was 9.0. In conclusion, the type and concentration of appropriate plant growth regulators can significantly increase the adventitious bud induction rate and proliferation coefficient of Hemerocallis.
Keywords:Hemerocallis fulva; adventitious bud; tissue culture; subculture multiplication; plant growth regulator
收稿日期:2021-02-02
基金項目:黑龙江省科学院科研基金项目(KY2020ZR05)
第一作者简介:李黎,硕士,高级工程师。研究方向为园林植物育种。E-mail: LiLi-16688@126.com
*通信作者:曲彦婷,博士,研究员。研究方向为园林植物育种。E-mail: 290971992@qq.com
引文格式:李黎,曲彦婷,韩辉,等.植物生长调节剂对萱草不定芽诱导增殖的影响[J].森林工程,2021,37(4):22-26.
LI L, QU Y T, HAN H, et al. Effects of pant growth regulators on adventitious bud induction and proliferation of Hemerocallis fulva[J]. Forest engineering,2021,37(4):22-26.
0 引言
金娃娃萱草(Hemerocallis fulva)为百合科萱草属多年生宿根草本植物,株高30 cm左右,是多倍体杂种中选育出的矮型优良品种,是大花萱草中唯一一个多季开花品种[1-2]。金娃娃萱草花朵大、花色艳丽、花期长、观赏性强、适应性强、耐寒和耐旱,适宜在公园和广场等绿地丛植,也可用做园林造景材料在庭院、道路和花海中建植,是城市绿化、美化中极具推广应用潜力的宿根花卉品种[3-6]。
萱草属植物的繁殖方式有分株繁殖、茎芽扦插繁殖和种子繁殖等,但整体繁殖系数小,繁殖速度较慢,经过多代繁殖还会造成品种退化,影响观赏效果,其中最常用的分株繁殖易对母株造成损伤,产生病菌感染[7-8]。组织培养可以缩短育种时间,提高繁殖系数,保持种苗的优良性状,有利于种苗的规模化生产[9-11]。早在20世纪70年代国外最早进行了萱草属植物的组织培养研究,国内对萱草属植物组织培养的研究起步稍晚。国内相关专家[12-15]以萱草不同部位作为外植体进行组织培养,得出不同外植体培养效果各有差异。也有专家[16-17]分别以短缩茎、分蘖茎段作为外植体可以直接诱导出不定芽。对萱草属植物的组织培养研究,主要集中在对外植体类型的选择上,并且一般都是通过愈伤组织途径,随着继代次数的增加,染色体会出现变异,影响无性系后代的性状和分生能力,而利用外植体直接诱导不定芽可以建立稳定的组织培养体系,而目前关于金娃娃萱草直接诱导不定芽的报道极少,且分化率和增殖率都比较低。植物生长调节剂是除基本培养基外另一种影响增殖过程的重要因素,通过施用不同的植物生长调节剂或单纯改变生长调节剂的质量浓度就可以使组培快繁过程的分化率和增殖系数大大增加[18-25]。本研究采用外植体直接诱导不定芽,对消毒方法、植物生长调节剂的种类、质量浓度等开展研究,确定金娃娃萱草的最佳组织培养方案,为金娃娃萱草的工厂化生产提供理论依据。
1 材料与方法
1.1 材料
本试验材料采自黑龙江省科学院自然与生态研究所试验地,引自辽宁省鞍山市台安县。试验地位于哈尔滨市,属中纬度温带大陆性季风气候,年平均气温3~4 ℃,7月气温较高,平均为23 ℃,1月气温较低,最低达-45.4 ℃,年平均降水量为625 mm。选择生长健壮无病虫害,株高在30 cm左右的植株作为母株,每个处理选取90份材料用于初代接种,外植体取材时期为4月中下旬,此时期外植体的污染率最低,成活率高,最佳取材部位为幼芽。
1.2 试验方法
1.2.1 无菌材料的获得
以金娃娃萱草的幼芽作为外植体,将采集的外植体放入清水中浸泡,加入少量洗衣粉搅拌2~3 min,然后放入流水下冲洗4~6 h,于超净工作台上用75%酒精表面消毒30 s,用无菌水冲洗3~4次,浸泡于灭菌剂中消毒,用无菌水冲洗6~7次,接种于培养基上,采用2因素正交试验设计,每个处理接种30瓶,每瓶接种1个外植体,重复3次,30 d后对外植体的污染率、死亡率进行统计,筛选灭菌剂的种类和消毒时间。
1.2.2 不定芽的诱导
将外植体接种在分别添加了不同質量浓度植物生长调节剂6-苄基氨基腺嘌呤(6-BA) 1.0、2.0、3.0 mg/L和萘乙酸(NAA) 0.1、0.2、0.3 mg/L的培养基中,采用2因素3水平正交设计,每一处理3次重复,每次接种30瓶,30 d后统计各处理的芽诱导率。
诱导率=诱导出的不定芽数/(接种外植体数-污染外植体数)×100% 。
1.2.3 不定芽继代增殖培养
在初代培养基础上继续筛选植物生长调节剂6-BA和NAA的质量浓度,采用2因素3水平正交设计,每一处理3次重复,每次接种30瓶,观测芽生长情况及产生丛生芽数,筛选出植物生长调节剂的最佳质量浓度,计算增殖系数。
增殖系数=增殖苗数/接种苗数。
1.2.4 培养条件
培养室内白天温度为(23±2) ℃,夜间不低于18 ℃,光照时间为12~14 h/d,光照强度为2 000 lx。
1.2.5 继代培养周期
设置不同继代培养周期,分别为15、20、25、30 d,接种到增殖培养基上进行培养,每个处理接种10瓶,每瓶接种3个芽,重复3次,30 d 后观察并统计增殖系数及生长状况,比较不同继代周期对金娃娃萱草增殖效果的影响。
1.2.6 数据统计分析
数据采用SPSS 19.0软件进行显著性分析。
2 结果与分析
2.1 消毒方法的选择
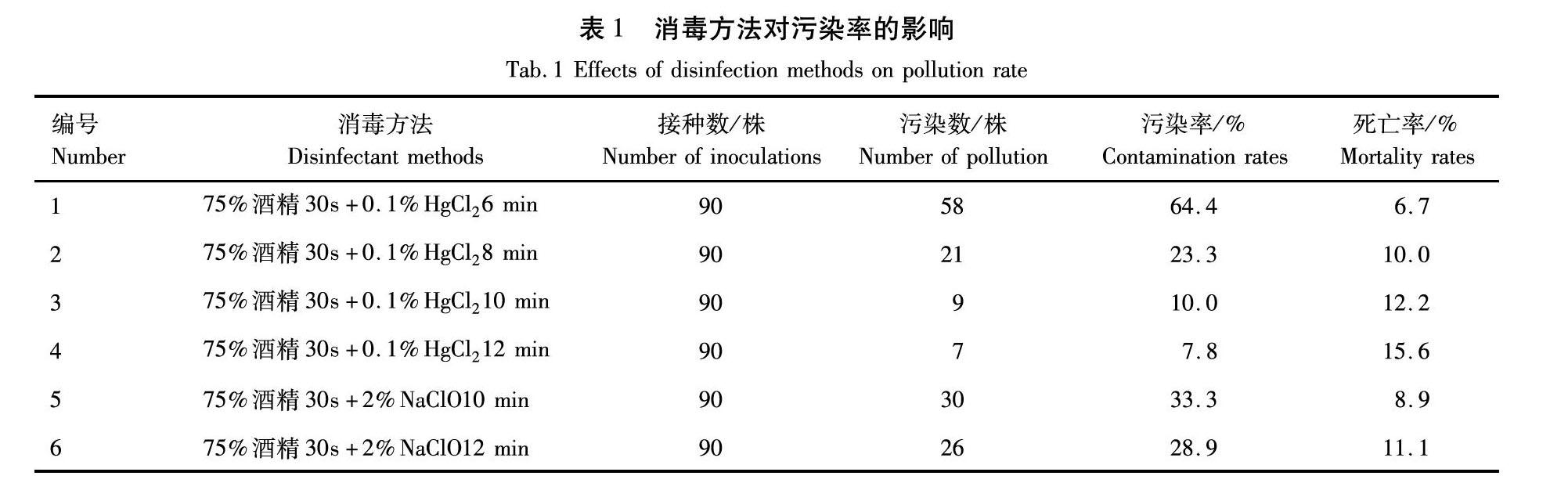
植物材料的表面灭菌剂有很多种,经常使用的有氯化汞、次氯酸钠等,现在多采用2种或2种以上的组合灭菌剂来处理外植体,在使用灭菌剂消毒之前,用75%酒精做短暂灭菌,一般为10~30 s,再用灭菌剂做进一步处理。从表1可以看出,在相同的消毒时间下,氯化汞处理要比次氯酸钠处理的污染率低,说明氯化汞的消毒效果好。虽然采用消毒方法4获得的污染率最低,但是随着消毒时间的增加死亡率会随着上升,因此根据污染率和死亡率2个因素考虑,金娃娃萱草外植体采用组合灭菌剂(75%酒精30 s+0.1% HgCl2 10 min)灭菌效果最佳,污染率为10%。
2.2 植物生长调节剂对不定芽诱导的影响
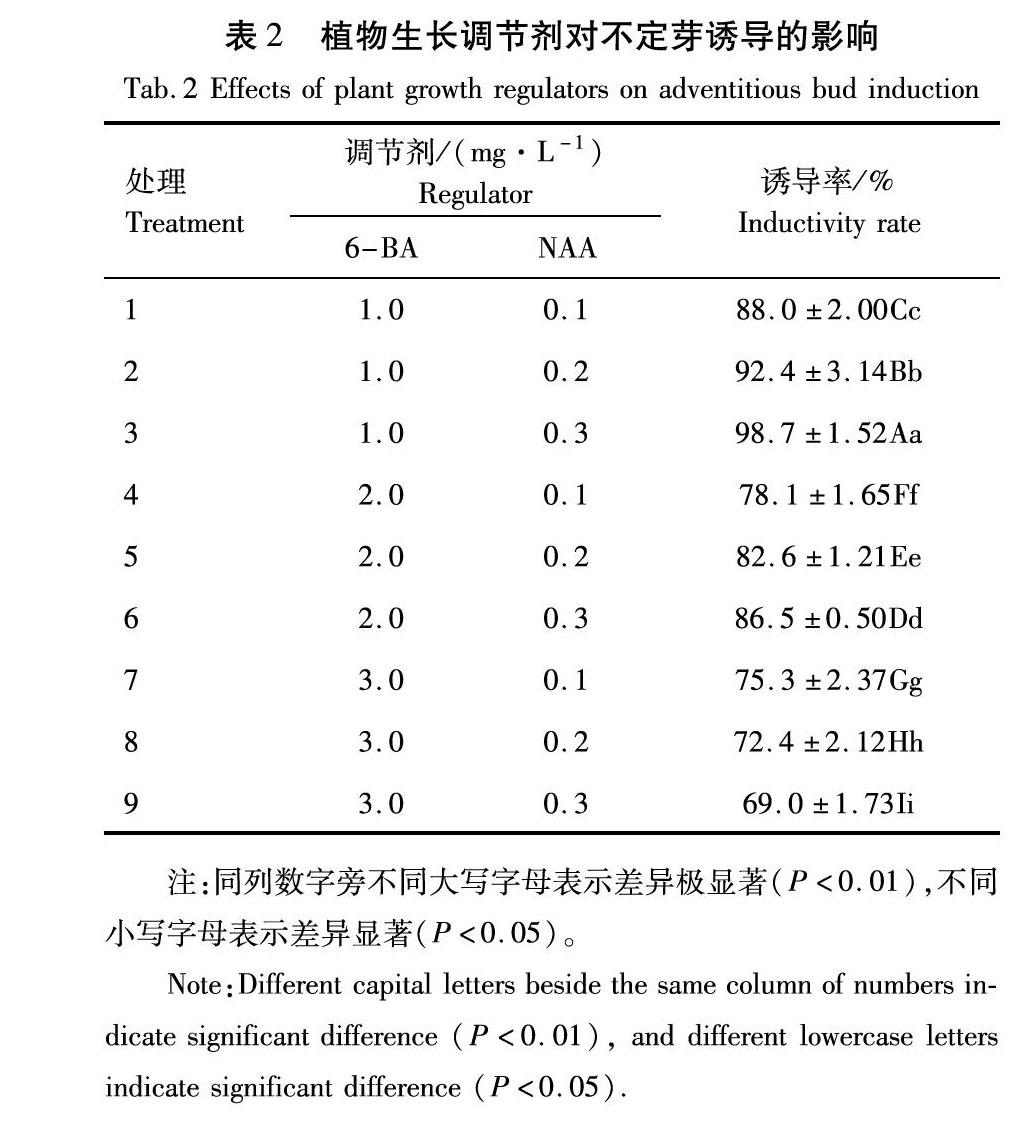
金娃娃萱草外植体接种于不定芽诱导培养基上,不定芽5~7 d后开始萌发,出现绿色的突起并逐渐伸长长高(图1)。植物生长调节剂不同组合对诱导分化的影响不同,诱导率的差异显著。从表2可以看出,金娃娃萱草在处理3上,即:MS+6-BA1.0 mg/L+ NAA0.3 mg/L(MS为基本培养基),其诱导率可达到98.7%,与其他处理间差异极显著(P<0.01)。因此MS附加植物生长调节剂质量浓度为1.0 mg/L的6-BA和质量浓度为0.3 mg/L的NAA组合是外植体直接分化为不定芽的最佳植物生长调节剂组合。
2.3 植物生长调节剂对不定芽增殖培养的影响
将诱导出来的不定芽转入不定芽增殖培养基进行增殖培养,10 d左右产生新的腋芽,增殖系数可达1.8~9.0。从表3可以看出,植物生长调节剂不同组合对不定芽增殖系数的影响有较大差异,2种植物生长调节剂的交互作用对金娃娃萱草继代增殖培养的影响达到了极显著水平(P<0.01),
3个6-BA水平间差异极显著(P<0.01),3个NAA水平间差异极显著(P<0.01)。因此得出继代增殖的最佳培养基为:MS+6-BA2.0 mg/L+NAA0.5 mg/L,即试验的L6处理,不定芽增殖系数最大,增殖系数可达到9.0。
2.4 继代培养周期对继代增殖的影响
随着继代培养天数的增加,增殖系数也随之增长,继代周期为20、25 d时,组培苗生长健壮,长势最好,增殖系数分别为7.8和9.0(图2),25 d时为最大增殖系数,苗高达到最高值(表4),培养周期到30 d时,由于培养基中的养分消耗殆尽,植株生长缓慢,基本停止生长,叶片逐渐变黄,继代后增殖能力降低。因此,金娃娃萱草组培苗继代25 d是最佳的生长、增殖时期,苗高平均可达5 cm,增殖系数达到最大,因此25 d继代一次较为适宜。
3 讨论与结论
在植物组织培养中,为了有效地促进不定芽的诱导和增殖,采用植物生长调节剂的种类和质量浓度往往不同,常以生长素和细胞分裂素按照一定比例混合使用。诱导率和增殖率的差异,关键在于植物生长调节剂种类和质量浓度的筛选。在本研究中,选用了6-BA和NAA 2种植物生长调节剂,在初代培养阶段,低质量浓度的生长素和细胞分裂素组合更有利于不定芽的诱导、形成,在继代培养阶段,高浓度的生长素和细胞分裂素组合更有利于不定芽的增殖。
本研究以金娃娃萱草幼芽作为外植体,研究外植体直接诱导不定芽的植物生长调节剂种类和质量浓度组合。通过试验发现,最佳不定芽诱导培养基为:MS+6-BA1.0 mg/L+NAA0.3 mg/L,诱导率最高可达98.7%,最佳不定芽增殖培养基为:MS+6-BA2.0 mg/L+NAA0.5 mg/L,增殖系数最高可达9.0,25 d继代一次较为适宜。在植物组织培养中根据培养物以及培养要求的不同,适时、适量使用适宜的植物生长调节剂可以有效地促进组培苗的生长、发育,有利于形成优质的组培苗,提高组培苗的诱导率和分化率。
【参 考 文 献】
[1]孙波,黄毅恒.金娃娃萱草的繁殖栽培及园林应用[J].现代农业科技,2016,50(16):161.
SUN B, HUANG Y H. Propagation, cultivation and landscape application of Hemerocallis fulva[J]. Modern Agricultural Science and Technology, 2016, 50(16):161.
[2]胡金萍,赵震虎,金鹏.大花萱草-金娃娃在黑龙江省的栽培及繁育技术的研究[J].黑龙江科技信息,2011,25(15):204.
HU J P, ZHAO Z H, JIN P. Study on cultivation and breeding techniques of Hemerocallis fulva and Golden Doll in Heilongjiang province[J]. Heilongjiang Science and Technology Information, 2011, 25(15):204.
[3]李靜,陈丰鸽,杨国阁.“金娃娃”萱草的应用及栽培技术[J].河南农业,2008,32(19):14.
LI J, CHEN F G, YANG G G. Application and cultivation techniques of Hemerocallis fulva[J]. Agriculture of Henan, 2008, 32(19):14.
[4]孙徐骉,武荣花.萱草属植物研究进展[J].河南农业科学,2016,45(4),45:7-11.
SUN X B, WU R H. Recent advances in Hemerocallis[J]. Journal of Henan Agricultural Sciences, 2016, 45(4): 7-11.
[5]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1979.
Editorial Board of Flora of China, Chinese Academy of Sciences. Flora of China[M]. Beijing: Science Press, 1979.
[6]张世杰,张志国.萱草属植物的起源、分布、分类及应用[J].园林,2018,38(5):5-9.
ZHANG S J, ZHANG Z G. Origin, distribution, classification and application of Hemerocallis[J]. Landscape Architecture, 2018, 38(5): 5-9.
[7]褚焕宁.萱草属植物快繁体系构建及杂种胚拯救研究[D].太谷:山西农业大学,2017.
CHU H N. Construction of rapid propagation system and rescue of hybrid embryo on Hemerocallis spp.[D]. Taigu: Shanxi Agricultural University, 2017.
[8]王荣梅.萱草属植物组培快繁体系优化及单倍体培养研究[D].太谷:山西农业大学,2019.
WANG R M. Optimization of tissue culture and rapid propagation system of Hemerocallis spp. and haploid culture study[D]. Taigu: Shanxi Agricultural University, 2019.
[9]宋雪莲.5个新品种多倍体萱草离体快繁技术的研究[D].长春:吉林农业大学,2011.
SONG X L. Research on rapid propagation technique of Hemerocallis hybrida polyploid of 5 new species[D]. Changchun: Jilin Agricultural University, 2011.
[10]李雯,王秀华.几种榆属植物组织培养研究进展[J].森林工程,2013,29(2),29:41-43.
LI W, WANG X H. The research progress of tissue culture of some genus Ulmus species[J]. Forest Engineering, 2013, 29(2): 41-43.
[11]张琳, 程亚男, 张欣, 等. 两种植物生长调节剂对木槿插穗生根的影响[J]. 南京林业大学学报(自然科学版), 2021, 45(3): 123-129.
ZHANG L, CHENG Y N, ZHANG X, et al. Effects of two plant growth regulators on rooting of Hibiscus syriacus cuttings[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2021, 45(3): 123-129.
[12]杨丽莉,王德平,张晓,等.以子房为外植体的‘金娃娃萱草组织培养技术的研究[J].中国农学通报,2012,28(25):184-190.
YANG L L, WANG D P, ZHANG X, et al. Study on tissue culture technique in Hemerocallis hybridus Stella Doro Using ovary as explants[J]. Chinese Agricultural Science Bulletin, 2012, 28(25): 184-190.
[13]姜凤英,栾绍武,吴志刚,等.多倍体萱草“金娃娃”的离体培養研究[J].辽宁农业科学,2007,62(1):51-52.
JIANG F Y, LUAN S W, WU Z G, et al. In vitro culture of polyploid Hemerocallis fulva[J]. Liaoning Agricultural Sciences, 2007, 62(1): 51-52.
[14]解有利,陈兰芬,石进朝.大花萱草组织培养研究[J].北京农业职业学院学报,2007,21(5):25-27.
XIE Y L, CHEN L F, SHI J C. Study on tissue culture of Hemerocallis fulva[J]. Journal of Beijing Agricultural Vocation College, 2007, 21(5): 25-27.
[15]李秀华,杜贞,武银玉,等.大花萱草组培快繁体系的研究[J].植物研究,2009,29(6):757-762.
LI X H, DU Z, WU Y Y, et al. Research on tissue culture regeneration of Hemerocallis middendorfii[J]. Bulletin of Botanical Research, 2009, 29(6): 757-762.
[16]王荣梅,褚焕宁,王金耀,等.萱草属植物短缩茎组织培养及植株再生[J].山西农业大学学报(自然科学版),2019,39(3):23-28.
WANG R M, CHU H N, WANG J Y, et al. Tissue culture and plant regeneration with dwarf stem of Hemerocallis plants[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2019, 39(3): 23-28.
[17]陈曦,刘志洋.6种多倍体大花萱草组织培养研究[J].安徽农业科学,2020,48(1):106-110.
CHEN X, LIU Z Y. Study on tissue cultivation in six polyploid Hemerocallis hybrida[J]. Journal of Anhui Agricultural Sciences, 2020, 48(1): 106-110.
[18]罗倩,董运常,严过房,等.植物生长调节剂在园林植物生产及抗逆性上的应用研究[J].安徽农学通报,2017,23(16):122-124.
LUO Q, DONG Y C, YAN G F, et al. Research and application of plant growth regulators on the production techniques and resistance of garden plants[J]. Anhui Agricultural Science Bulletin, 2017, 23(16):122-124.
[19]周宜君,周生闯,刘玉,等.植物生长调节剂对植物愈伤组织的诱导与分化的影响[J].中央民族大学学报(自然科学版),2007,30(1):23-28.
ZHOU Y J, ZHOU S C, LIU Y, et al. Influences of plant growth regulations on induction and differentiation of plant callus[J]. Journal of the Central University for Nationalities (Natural Sciences Edition), 2007, 30(1):23-28.
[20]马秋月, 李倩中, 李淑顺, 等. 元宝枫组织培养及快速繁殖技术研究[J]. 南京林业大学学报(自然科学版), 2021, 45(2): 220-224.
MA Q Y, LI Q Z, LI S S,et al. Study on tissue culture and rapid propagation of Acer truncatum Bunge[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2021, 45(2): 220-224.
[21]李艳霞,刘忠玲,刘建明,等.树莓品种“波拉纳”组培繁殖体系建立[J].森林工程,2018,34(2):26-29.
LI Y X, LIU Z L, LIU J M, et al. Establishment of tissue culture and propagation system for Raspberry (Rubusdaeus) Cultivar ‘Polana[J]. Forest Engineering, 2018, 34(2):26-29.
[22]任雪羽,王晓红,肖芬,等.木槿种子的多倍体诱导及鉴定研究[J].西部林业科学,2019,48(4):119-125.
REN X Y, WANG X H, XIAO F, et al. Polyploidy Induction and Identification of Hibiscus syriacus[J]. Journal of West China Forestry Science, 2019, 48(4):119-125.
[23]蒋华.巴西人参组培快繁体系的建立[J].西部林业科学,2021,50(1):138-144.
JIANG H. Rapid propagation system of Pfaffia paniculate tissue culture[J]. Journal of West China Forestry Science, 2021, 50(1):138-144.
[24]肖杰,薛欢,苑景淇,等.3个紫薇品种实生苗和扦插苗光合特性比较及光合效率评价[J].西部林业科学,2020,49(6):85-93.
XIAO J, XUE H, YUAN J Q, et al. Comparison of photosynthetic characteristics and evaluation of photosynthetic efficiency of seedlings and cuttings of three Lagerstroemia indica cultivars[J]. Journal of West China Forestry Science, 2020, 49(6):85-93.
[25]姚穎,刘忠玲,吕跃东.植物生长调节剂和扦插基质对紫椴嫩枝扦插生根的影响[J].森林工程,2017,33(1):12-15.
YAO Y, LIU Z L, LV Y D. Effect of plant growth regulators and cutting medium on rooting of the Tilia Amurensis by softwood cutting[J]. Forest Engineering, 2017, 33(1):12-15.
