山新杨PdPapGH12基因克隆及其响应胁迫的组织表达
2021-08-23李素陈芳殷缘田广宇陈晓璇王天真范诺ABDULWAHIDBALOCH张荣沭
李素 陈芳 殷缘 田广宇 陈晓璇 王天真 范诺 ABDUL WAHID BALOCH 张荣沭
摘 要:為筛选林木抗性基因,培育高抗转基因林木,以山新杨(Populus davidiana × P. alba var.pyramidlis)为试材,采用RT-PCR技术克隆获得1 560 bp的PdPapGH12(Potri.004G109200.1)基因cDNA,生物信息学分析表明该基因编码519个氨基酸,该蛋白属于亲水性酸性蛋白。依据亚细胞定位预测结果推测其在胞内发挥水解的作用。蛋白结构分析发现PdPapGH12与4个杨树品种的9条GHs序列具有高度一致性。qRT-PCR分析显示,PdPapGH12在茎基、老叶和根中表达量更高。并发现200 mmol/L NaCl、pH为10的Na2CO3溶液和聚乙二醇6000(PEG 6000;质量分数30%)胁迫48 h其在茎尖、叶和根中均上调表达;5种植物致病病原真菌胁迫48 h均使其在茎尖的表达下调。只有核盘菌使其在叶中表达显著上调;尖孢镰刀菌、链格孢菌和立枯丝核菌使其在根内表达显著上调。受激素诱导48 h,ABA(100 μmol/L)仅使其在根部表达上调;SA(100 μmol/L)仅使其在叶中表达上调,而JA(100 μmol/L)使其在叶和根中的表达均上调。结果表明PdPapGH12参与植物抵抗逆境胁迫和激素诱导的信号途径。
关键词:糖苷水解酶;非生物胁迫;生物胁迫;激素诱导;qRT-PCR
中图分类号:Q786 文献标识码:A 文章编号:1006-8023(2021)04-0011-11
Cloning of PdPapGH12 Gene of Shanxin Poplar
(Populus davidiana × P. alba var. pyramidlis) and Its Tissue
Expression in Response to Stress
LI Su1, CHEN Fang1, YIN Yuan1, TIAN Guangyu1, CHEN Xiaoxuan1, WANG Tianzhen1,
FAN Nuo1, ABDUL WAHID BALOCH2, ZHANG Rongshu1*
(1.College of Landscape Architecture, Northeast Forestry University, Harbin 150040, China;
2.Department of Plant Breeding and Genetics, Sindh Agriculture University, Tandojam 70060, Pakistan)
Abstract:In order to screen for the resistance genes of trees and cultivate transgenic trees with high resistance, Shanxin Poplar (Populus davidiana × P. alba var. pyramidlis) was used as the test material, and the 1 560 bp cDNA of the PdPapGH12 (Potri.004G109200.1) gene was cloned by RT-PCR. Bioinformatics analysis showed that PdPapGH12 encoded a protein of 519 amino acids, and the PdPapGH12 protein was a hydrophilic acidic protein. According to the prediction results of the subcellular localization of PdPapGH12, it might play a role in the hydrolysis reactions in the cytoplast. Protein structure analysis showed that PdPapGH12 shared high similarity with nine other GHs of four poplar varieties. RT-qPCR analysis showed that PdPapGH12 was relatively highly expressed in the stem base, old leaves and roots. Salt (NaCl, 200 mmol/L), alkali (Na2CO3 solution, pH=10) and PEG 6000 (Polyethylene glycol 6000; 30%) treatments for 48 hours could induce the up-regulation of PdPapGH12 in the apex, mature leaf and root. PdPapGH12 expression in the apex was down-regulated by the inducing of five plant pathogenic fungi for 48 hours. Only Sclerotinia sclerotiorum induction significantly upregulated the expression of PdPapGH12 in mature leaves. Fusarium oxysporum, Alternaria alternate and Rhizoctonia solani induction significantly increased PdPapGH12 expression in the roots. After 48 hours of phytohormone induction, ABA (100 μmol/L) only upregulated PdPapGH12 expression in the roots. SA (100 μmol/L) only upregulated PdPapGH12 expression in mature leaves, while JA (100 μmol/L) upregulated PdPapGH12 expression in both the mature leaves and roots. This study demonstrated that PdPapGH12 had a role in poplar's resistance against environmental stresses and responses to phytohormone induction.
Keywords:Glycoside hydrolase; abiotic stress; biotic stress; hormone induce; RT-qPCR
收稿日期:2021-03-13
基金项目:2019年国家级本科生创新训练项目(201910225087);国家自然科学基金资助项目(31370642)
*通信作者:张荣沭,博士,副教授。研究方向为园林植物种质资源及植物病害生物防治。E-mail: zrs6504@sina.com
引文格式:李素, 陈芳, 殷缘, 等. 山新杨PdPapGH12基因克隆及其响应胁迫的组织表达[J]. 森林工程,2021,37(4):11-21.
LI S, CHEN F, YIN Y, et al. Cloning of PdPapGH12 Gene of Shanxin Poplar (Populus davidiana × P. alba var. pyramidlis) and its tissue expression in response to stress[J]. Forest Engineering,2021,37(4):11-21.
0 引言
我国实施退耕还林政策以来,植树造林工程、天然林保护工程等相关事项愈发受到行业重视[1]。杨树因其物种资源丰富,分布广泛,具有生长迅速、繁殖率高、树干笔直和枝繁叶茂遮阴效果好等特点,作为绿化树种能起到水土保持、防风固沙和改善环境的作用;又因其生长期短、出材率高还可作为经济树种起到促进地方经济发展的作用[2-4]。因此,开展提高杨树抗逆性的相关研究,一方面有利于推进生态环保事业发展,另一方面对促进经济产值的提高有重要的意义。
β-葡萄糖苷酶(又称为β-D-葡萄糖苷葡萄糖水解酶,β-D-glueosidase, E.C.3.2.1.21),是纤维素酶的一个重要组成部分,能水解结合于末端、非还原性的β-D-糖苷键,同时释放β-D-葡萄糖及相应的配基[5-6]。根据氨基酸序列,β-葡萄糖苷酶目前可被划分为糖苷水解家族GH1、GH3、GH5、GH9和GH30[7-10]。GH1、GH5和GH30均属于GH-A(clan GH-A),结构特点是拥有(β/α)8桶状结构,其β折叠结构中C端的第4位和第7位的Glu残基是它的活性位点[11-12],一个作为质子供体,一个作为亲核集团参与催化反应,分别催化酸碱和亲核试剂[13,15]。糖苷水解酶家族1(GH1)β-葡萄糖苷酶由大量基因编码,参与植物的许多发育过程和胁迫反应,不仅参与防御病原体及其他食草动物的侵害[15],响应渗透胁迫[5,16] ,被生物或非生物胁迫所诱导[16-17];还能参与植物激素的激活[18]、细胞壁的木质化[19]和植物的次级代谢[20]等多种途径。由于GH1β-葡萄糖苷酶在植物生长和发育中的重要性,已经在多种植物中被克隆和分析。
山新杨是以山杨(P. davidiana)为母本、新疆杨(P. alba var. pyramidalis)为父本杂交得到的优良树种,生长速度较快,适应性强,抗逆性好,果序自然脱落不飞絮,具有较高的经济价值和观赏价值。迄今为止,有关山新杨(GH1)β-葡萄糖苷酶的生物信息学分析、组织表达模式和生物胁迫应答的相关研究未见报道。本研究团队已具备山新杨良好的遗传转化体系[21-22]。基于构建的山新杨与植物益生菌棘抱木霉和致病菌链格孢菌互作的转录组数据库,获得一条特异表达基因Potri.004G109200.1 v3.1的cDNA全长序列,该基因具有完整的Glycosyl hydrolase family 1(PF00232)功能域,在Genbank数据库进行BLASTx比对,与已命名的杨树GH12一致性最高,将其命名为PdPapGH12。在此基础上拟对该基因进行生物信息学分析。利用RT-qPCR(Real-time Quantitative polymerase chain reaction)技术揭示PdPapGH12在茎尖、叶、茎和根中的表达模式,以此为基础进一步研究山新杨根部进行盐、碱和高渗透压胁迫,接种5种植物土传病害病原菌或植物激素诱导48 h后,PdPapGH12的组织表达变化,为进一步揭示此基因的调控功能和进行山新杨基因工程改良育种获得高抗山新杨新品种提供依据。
1 材料与方法
1.1 材料
供试植物:山新杨组培苗由本实验室保存。继代培养培养基为WPM(Woody Plant Medium)+NAA 0.1 mg/L+6-BA 0.5 mg/L;生根培养为WPM+IBA 0.4 mg/L。 在人工气候箱中培养和完成各种处理。
供试微生物:核盘菌NECC20005(Sclerotinia sclerotiorum NECC20005)、立枯丝核菌NECC20006(Rhizoctonia solani NECC20006)、尖孢镰刀菌NECC20007(Fusarium oxysporum NECC20007),由沈阳农业大学刘志华教授赠予;金黄壳囊孢菌C29(Cytospora chrysosperma C29)由东北林业大学宋瑞清教授赠予;链格孢菌NECCFP002(Alternaria alternate NECCFP002)由本实验室分离保藏。
1.2 方法
1.2.1 PdPapGH12基因的PCR扩增及测序
基于本实验室构建的山新杨与棘抱木霉菌和链格孢菌互作的转录组数据库(北京,百迈客公司),采用Gang等[23]的方法进行有参转录组差异基因表达分析。经筛选获得特异表达基因Potri.004G109200.1的cDNA全长序列。依据此序列信息,利用Primer Premier 6.0 軟件设计克隆该基因的全长引物(表1),采用CTAB裂解法提取山新杨叶片总RNA。并用反转录试剂盒(PrimeScript RT reagent Kit with gDNA Eraser, TaKaRa)合成cDNA。以cDNA为模板,TaKaRa Primer STAR Max DNA Polymerase为反应试剂,使用表1中PdPapGH12的“PdPapGH12-F”和“PdPapGH12-R”引物进行RT-PCR扩增,条件为:98 ℃预变性3 min;98 ℃变性10 s,60 ℃退火8 s,72 ℃延伸5 s,共35个循环;72 ℃再延伸2 min。将扩增片段进行纯化,并按照说明书将其连接到pMD18-T载体上,送交哈尔滨市擎科嘉美生物科技有限公司进行测序。
1.2.2 PdPapGH12基因的生物信息学分析
利用NCBI数据库的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析PdPapGH12的开放读框长度;利用ExPASy网站中ProtParam(http://web.expasy.org/protparam/)分析PdPapGH12的氨基酸组分及理化性质。利用NCBI的BLASTx程序(https://blast.ncbi.nlm.nih.gov/)比对获得PdPapGH12同源蛋白序列;利用NCBI的Conserve Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白保守区;运用PsortⅡ prediction(http://psort.hgc.jp/form2.html)进行亚细胞定位预测;利用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测PdPapGH12蛋白跨膜结构域;利用Prot Scale(http://web.expasy.org/protscale/)进行PdPapGH12蛋白疏水性分析。利用MEME软件(https://meme-suite.org/meme/)对PdPapGH12同源序列进行结构域预测,应用SWISS-MODEL(https://swissmodel.expasy.org/)在线预测PdPapGH12蛋白的三级结构,并用Mega6.0软件采用邻接法(Neighbor-Joining,NJ)构建进化树(Bootstrap=1000)。
1.2.3 PdPapGH12基因在组织中的差异表达量分析
无菌条件下,生长在固体WPM培养基上的山新杨4周龄组培苗转接到含有12 mL液体WPM培养基的试管中进行生根培养2周。培养条件为:温度23 ℃,湿度40%,16 h/8 h(光/暗)。分别收集组培生根苗顶芽(芽、未展开叶及茎为ST)、幼茎(带有第1和第2完全展开叶片的 2个节间为S1),S1上的2片嫩叶为L1;茎最下边2个节间为S3,S3上的2片叶为L3;茎中部的2个节间为 S2,S2上的2片叶为L2;还有根(R)等。将样品包好后迅速置于液氮中,然后置于-80 ℃冰箱中,用于提取总RNA及分析PdPapGH12基因在不同组织中的表达量。
1.2.4 PdPapGH12基因在非生物、生物胁迫及激素诱导下组织表达量分析
无菌条件下将6周龄山新杨组培苗(不定根长度为10~20 cm)分别置于含有NaCl(200 mmol/L)、Na2CO3溶液(pH为10)和含有聚乙二醇6000(Polyethylene glycol,PEG6000)30%(质量分数)的液体WPM培养基中,进行盐、碱和高渗透压3种非生物胁迫实验。处理48 h后,分别收集S(茎)、L2(成熟叶)和R(根)部位样品。
无菌条件下将活化后的5种植物土传致病真菌接种到PDA培养基中,在26 ℃条件下培养10 d获得大量分生孢子或菌丝体。细致刮取立枯丝核菌PDA培养基(1 cm×4 cm×3块)上的菌丝溶于WPM液体培养基中制备菌丝体悬浮液。其他4种真菌用血球计数器计数,计算分生孢子悬浮液浓度,备用。再将6周龄组培苗的根部分别接种尖孢镰刀菌、核盘菌、金黄壳囊孢菌和链格孢菌分生孢子,使其终浓度为1×105 cfu/mL。或接种已配制的立枯丝核菌的菌丝体。接种48 h后,分别收集S、L2和R部位样品。
无菌条件下将6周龄山新杨组培苗分别置于含有100 μmol/L ABA(abscisic acid)、JA(jasmonic acid)或 SA(salicylic acid)的液体WPM培养基中,处理48 h后,分别收集S、L2和R部位样品。
上述样品以同龄非处理山新杨组培苗为对照,分别分析PdPapGH12基因在3种非生物胁迫、5种生物胁迫和3种激素诱导下的组织差异表达量。每实验组设3株苗,每处理3次重复。
1.2.5 RT-qPCR 分析
收集的山新杨各个样品采用CTAB法提取总 RNA,使用反转录试剂盒(PrimeScript RT reagent Kit with gDNA Eraser,TaKaRa)參照说明书合成cDNA。以cDNA为模板,利用北京全式金生物公司(TransGen Biotech)的TransStart Top Green qPCR SuperMix 酶和罗氏公司的荧光定量 RT-qPCR 仪器(LightCycler 96;Roche)进行荧光定量 RT-qPCR 反应。3个内参基因及其 GenBank 登录号分别为:PdPapACT2(MN196665)、PdPapEF1-α(MN196666)和 PdPapTub(MN196667)。基因的引物序列见表 1。实时定量 qPCR 的反应体系为:20 μL(2×Taq Master Mix 10 μL;10 μmol/L双向引物各0.8 μL;模板2 μL;DEPC处理水6.4 μL)。为了确保实验结果的重现性,对3个生物学重复的样品进行了 3个技术重复。反应程序:为95 ℃预变性10 min;94 ℃变性5 s,59 ℃退火15 s, 45个循环;72 ℃延伸10 s。熔解曲线按照95℃ 10 s,65℃ 60 s,97℃ 1 s进行。
1.3 数据分析
采用2-ΔCt方法[24]对无诱导条件下山新杨PdPapGH12基因在不同组织部位的组成型表达和不同诱导条件下不同组织部位的表达进行计算,Ct代表每个反应管内的荧光信号达到设定域值时所经历的循环数,该方法计算所得的结果为PdPapGH12基因相对于3个内参基因的平均表达水平的相对表达量。使用Microsoft Office Excel 2007软件包和SPSS 19统计软件包对测量数据进行统计、作图和分析。对同一时间点的实验组之间的差异显著性进行ANOVA分析,在P<0.05下比较差异性。
2 结果与分析
2.1 PdPapGH12基因序列分析
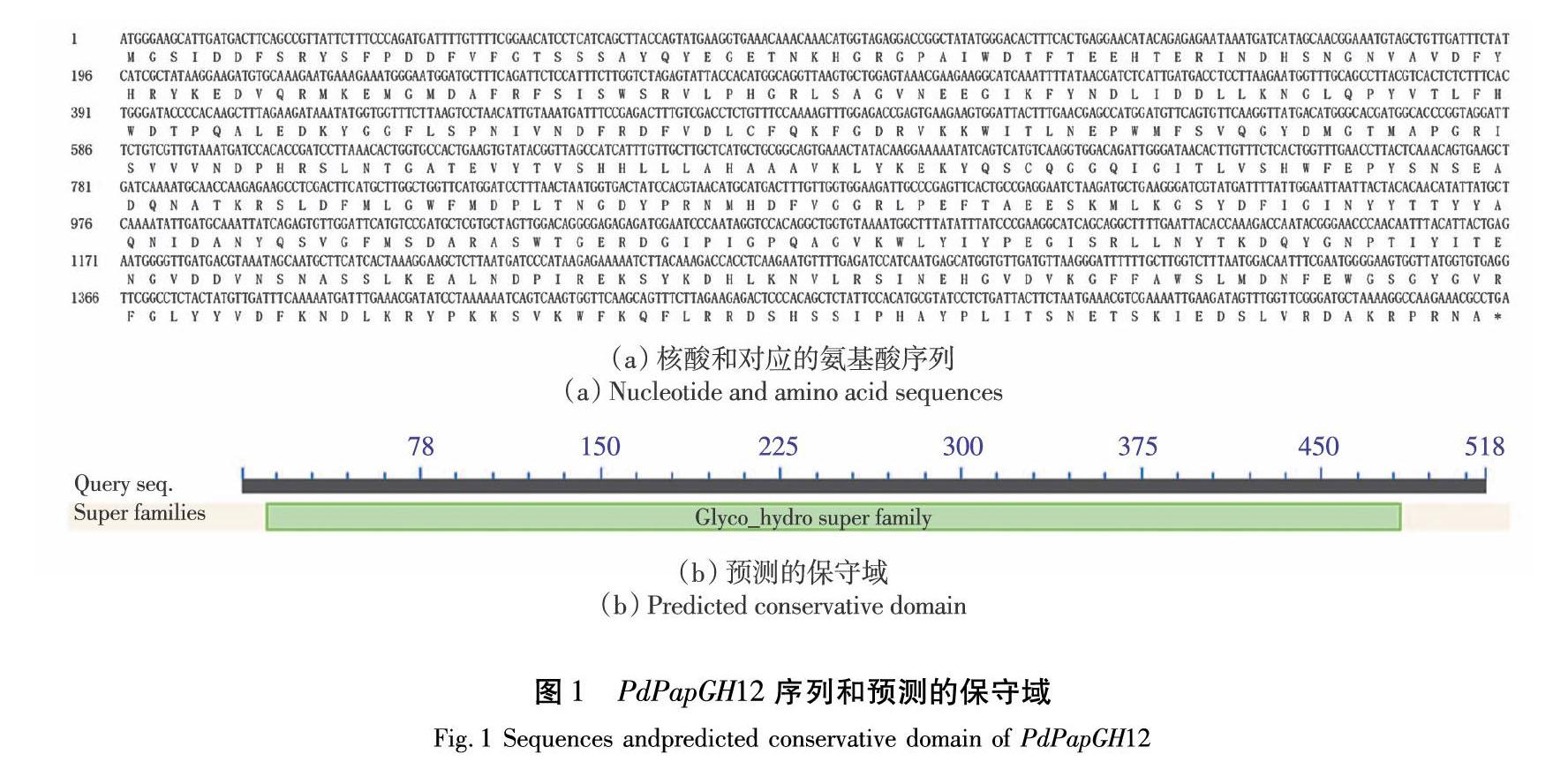
测序结果获得的PdPapGH12基因序列长度为1 560 bp。该基因编码蛋白的起始密码子在第1个氨基酸处,终止密码子在第519个氨基酸处,编码519个氨基酸,如图1(a)所示。具有完整的Glyco_hydro(pfam00232, Glycosyl hydrolase superfamily member)保守域,位于PdPapGH12的第11至483氨基酸之间(E= 1.48×10-176),如图1 (b)所示。PdPapGH12编码蛋白分子式为C2687H4004N720O798S15,相对分子质量为59 643,理论等电点为5.83,属于酸性、亲水性稳定蛋白。无跨膜结构,亚细胞定位预测分析表明其在细胞核、细胞质中的分布情况分别占17.4%、69.6%。由此可以初步推测PdPapGH12在胞内发挥水解的作用。
2.2 PdPapGH12蛋白的结构特性分析
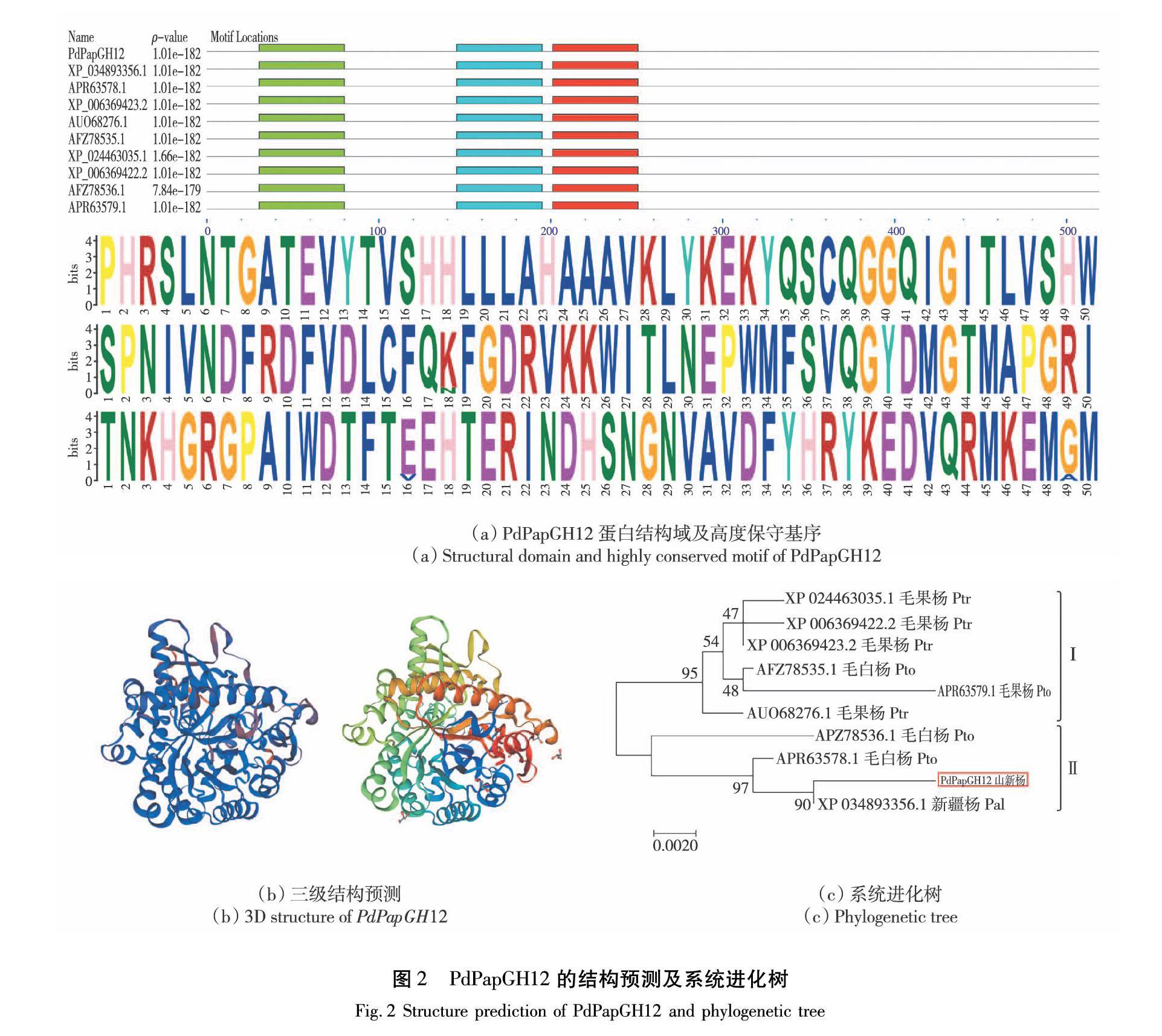
对山新杨PdPapGH12蛋白进行二级结构预测的结果表明,该蛋白主要由无规则卷曲与 α-螺旋构成,其中无规则卷曲占 41.81%、α螺旋占 34.87%、β-转角占 7.32%、延伸链占 15.99%。
对PdPapGH12蛋白的三级结构预测结果可见,共比对上50个模板,在GMQE值最大为0.82的条件下,该蛋白与模型3gno.1.A的Identity较高,为53.04%;coverage为0.92,范围在6~484氨基酸处。此模型为水稻β-葡萄糖苷酶(Beta-glucosidase,Os03g0212800)蛋白的晶体结构,如图2(a)所示。
在Genbank数据库中利用BLASTx进行序列搜索,获得9条(来源于4个杨树品种)与PdPapGH12一致性最高的GHs序列(Total Score >1 030; Query Cover >99%; E =0.0; Ident >97%),将PdPapGH12与此9条GHs蛋白序列进行对比分析,结果显示:这10条蛋白序列均具有位置靠近N端高度保守的3个基序,如图2(b)所示。第1个基序位于31—80处,第2个(位于146—195)与第3个(位于202—251)基序相隔很近,靠近N端的2个保守基序一个是催化结构域,功能是催化酸碱和亲核试剂;一个是结合结构域,功能是将酶分子连到纤维素上[5]。采用MEGA软件NJ法构建PdPapGH12和与9条同源基因遗传进化树,如图2(c)所示,将进化树分为2组。第I组只包括毛果杨(P. trichocarpa)中的4个和毛白杨(P. tomentosa)中的2个β-葡萄糖苷酶,第Ⅱ组含有新疆杨(P. alba)中1个、山新杨中1个和毛白杨中的2个β-葡萄糖苷酶。在NCBI数据库中通过BLASTx比对得到的9条与PdPapGH12相似GH蛋白中,新疆杨的GH与PdPapGH12亲缘关系最近。
2.3 PdPapGH12在茎尖、茎、叶和根组织中的表达分析
采用qRT-PCR技术进行基因表达量分析发现,山新杨PdPapGH12在茎尖、茎、叶和根中均有表达,如图3所示。其在R中的表达量最高,S1中的表达量最低,R中的表达量是S1的332.86倍(P<0.05)。茎尖部位ST的表达量是S1的3.6倍,叶组织L1、L2和L3的表达量分别是S1的6.4、6.7和9.3倍。在茎S2和S3中的表达量分别是S1的1.8和28.6倍。
2.4 胁迫处理对PdPapGH12的组织表达变化分析
2.4.1非生物胁迫下PdPapGH12在茎尖、叶和根中的表达变化
采用NaCl、Na2CO3和PEG溶液模拟山新杨在盐、碱或干旱(高渗透压)等非生物胁迫条件下PdPapGH12的组织差异表达变化。由图4可见:在茎尖、成熟叶和根组织中,盐胁迫组、碱胁迫组、高渗透压胁迫下PdPapGH12表达量均为上调,在茎尖部位中分别为对照的8.66、2.46、2.68倍;在成熟叶中,分别为对照的4.83、2.08、1.95倍;而在根中分别为对照的19.15、62.48、6.11倍。
2.4.2 生物胁迫下PdPapGH12在莖尖、叶和根中的表达变化
山新杨组培苗根部接种5种植物土传致病真菌48 h后,在茎尖部位,由于根部接种Fo、Cc、Ss、Aa和Rs等真菌致病菌,PdPapGH12表达量均为下降,分别为对照的0.20、0.16、0.44、0.31、0.06倍;其中Rs菌对PdPapGH12表达量的影响最大,如图5所示。
在成熟叶中,只有根部接种Ss菌使PdPapGH12表达量上调,为对照的37.37倍,而其余真菌均使得PdPapGH12表达量下降,其中接种Fo菌使PdPapGH12表达量最低,为对照组的0.03倍,如图5所示。
在根组织中,接种Cc菌和Ss菌使PdPapGH12表达量均为下降,分别为对照的0.41、0.13倍,而接种Fo菌、Aa菌和Rs菌均使得PdPapGH12表达量上调,其中接种Fo菌使其上调量最大,为对照的577.47倍。
2.4.3 激素 SA、JA 和 ABA 诱导下PdPapGH12在茎尖、叶和根中的表达变化
在3种植物激素诱导48 h后,山新杨PdPapGH12基因的组织表达量发生不同的变化,如图6所示。在茎尖部位,受根部JA、SA和ABA诱导,PdPapGH12表达量均为下降,分别为对照的0.14、0.33、0.19倍;在成熟叶中,根部ABA诱导使PdPapGH12表达量下降,为对照的0.37倍,受根部JA和SA诱导PdPapGH12表达量均为上调,分别为对照的1.18和20.26倍。在根组织中,JA和ABA诱导使PdPapGH12表达量均为上调,分别为对照的18.55和8.79倍,SA诱导使其表达量下降,为对照的0.47倍。
3 讨论与结论
β-葡萄糖苷酶在植物中广泛存在,并且发挥出多种功能,对生物体的生理代谢有重要作用。不仅参与防御病原体及其他食草动物的侵害,还能响应渗透胁迫、被生物或非生物胁迫诱导,参与植物激素的激活、细胞壁的木质化和植物的次级代谢等多种途径[17-18,20,25-26]。在拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)和毛果楊中已分别发现48、40和46个GH1β-葡萄糖苷酶基因,对拟南芥和水稻中β-葡萄糖苷酶在多种胁迫条件下的表达谱已见报道[5],然而,有关GH1β-葡萄糖苷酶基因在木本植物中的表达模式研究相对很少,对山新杨PdPapGH基因在胁迫条件下的表达模式未见报道。因此,在山新杨中克隆GH1新基因并研究其组织表达特异性和在多种逆境胁迫下的调控规律具有创新性。
基于本团队获得的特异表达基因Potri.004G109200.1 v3.1在毛果杨基因组数据库中被注释为(1 of 46)3.2.1.21-Beta-glucosidase/Gentobiase。采用PCR技术克隆到山新杨PdPapGH12基因序列,此序列含有1 560个核酸。编码519个氨基酸,蛋白序列具有完整的Glyco_hydro保守域(图1),属于非跨膜亲水性酸性蛋白。预测其主要在细胞质中分布,故推测PdPapGH12在胞内发挥水解的作用。序列比对结果显示PdPapGH12与4个杨树品种的9条GHs基因具有高度一致性,且均具有3个高度保守靠近N端的motif(图2(a)和(b)),这与苏振峰[5]的分析结果水稻β-葡萄糖苷酶的3个保守基序靠近N端的结果一致。构建系统进化树显示PdPapGH12与新疆杨的XP_034893356.1(beta-glucosidase 12-like)亲缘关系最近。对PdPapGH12蛋白进行三级结构预测,结果发现该蛋白与模型3gno.1.A的Identity 较高,此模型为水稻Beta-glucosidase Os4BGlu12的晶体结构(图2(c)),研究认为水稻Os4BGlu12蛋白可能在植物的防御过程中发挥功能,其分子功能可能是降解细胞壁受病原菌侵染时被分解而产生的寡聚糖[27]。故推测山新杨PdPapGH12可能与水稻Os4BGlu12蛋白的功能有相似之处。
本研究以山新杨6周龄组培苗为材料,采用qRT-PCR技术分析PdPapGH12的组织表达特性,发现其在茎尖、叶、茎和根中均有表达,并且PdPapGH12的表达模式从幼嫩到老化的组织表达量逐渐升高,在根中的表达量最高,为幼嫩茎的332.86倍(P<0.01)。说明PdPapGH12随杨树发育梯度而表达提升,其生物功能可能仅在成熟组织中特异性发挥。植物在生长发育过程中会遇到干旱、高盐碱和极端温度等各种非生物胁迫。此时,植物常常通过调节自身基因的表达来响应非生物逆境的胁迫[5,16,28-29]。本研究发现山新杨PdPapGH12受到盐、碱和高渗透压胁迫,在茎尖、成熟叶和根等组织中的转录水平均受诱导而上调,说明PdPapGH12可能是杨树响应和抵御胁迫过程中一个重要的蛋白,并且具有正向调控抗盐、碱和高渗透压胁迫的能力。
尖孢镰刀菌、核盘菌、立枯丝核菌、链格孢菌和金黄壳囊孢菌为常见的5种土传植物病害致病菌,在一定环境条件下可引起植物不同程度发生根腐、茎腐、茎基腐、花腐病,及菌核病、褐斑病、叶枯病等多种病害症状,并且寄主较广。本研究发现,山新杨根际接种不同致病真菌后,不同组织部位中PdPapGH12的响应不同。在茎尖部位,PdPapGH12表达量均为下降,受影响程度由大到小分别为:Rs>Cc >Fo >Aa>Ss(图5)。在成熟叶中,只有根部接种Ss菌使PdPapGH12表达量上调,而其余4种真菌均使PdPapGH12表达量下降,其中接种Fo菌使PdPapGH12表达量最低(图5)。说明植物根系侵染病原菌48 h,茎尖和成熟叶中细胞壁的降解相对较少。可能根部感染的Ss菌对杨树苗的叶片会产生影响,PdPapGH12表达量上调可能与降解叶中细胞壁被分解而产生的寡聚糖相关[26]。在根组织中,接种Cc菌和Ss菌使PdPapGH12表达量均为下降,而接种Fo菌、Aa菌和Rs菌均使得PdPapGH12表达量上调,其中接种Fo菌使其上调量最大,为对照的577.47倍(图5)。由于Fo是营半活体病原,其他致病菌是完全营腐生病原,而PdPapGH12被具有营活体营养的病原直接接触诱导表达提升最剧烈,故推测PdPapGH12可能是直接响应这类病原的一个重要基因。研究发现, 拟南芥AtBGLU26在抵御真菌侵害方面起着决定性的作用,AtBGLU23在和内寄生真菌建立共生关系方面起着决定性作用,通过阻止真菌的过度生长进而引发防御反应[17, 30-33]。内生真菌是营活体营养菌,Fo是半活体,说明PdPapGH12可能在对内生真菌的识别和响应中也扮演重要角色,具体的作用机制有待于今后深入研究。
自然界中的植物总是受到各种病原物(如细菌、真菌和病毒等)的侵袭。植物在与病原物相互作用的过程中体内会发生一系列的信号传递,激发植物的防御体系来产生抗病性反应[33]。SA和JA在调控抗病和防卫信号传导网络中扮演了重要的角色[34]。在进化过程中植物同样进化出一系列响应非生物胁迫(包括干旱胁迫、高盐胁迫和冷胁迫)的信号通路,ABA是调控植物对非生物胁迫响应的首要激素,本研究发现盐、碱和PEG均诱导PdPapGH12在根部的转录水平提高,与ABA对根部诱导结果一致,进一步说明PdPapGH12可能是杨树响应盐、碱和干旱胁迫并做出抵御胁迫生理响应的重要响应蛋白。本研究发现受根部JA、SA和ABA诱导,PdPapGH12在茎尖部位的表达量均下调;受根部JA和SA诱导PdPapGH12在成熟叶中表达量均为上调;在根组织中,JA和ABA诱导使PdPapGH12表达量均为上调。说明PdPapGH12可能参与SA、JA和ABA的信号途径。Fo、Aa和Rs对根部PdPapGH12转录水平的直接诱导结果和JA一致,说明三者侵染可能诱导杨树根部JA升高,推测PdPapGH12转录水平可能受JA诱导。因此,未来有必要对PdPapGH12应答SA和JA介导的植物抗病相关途径的调控机制和植物响应非生物胁迫的ABA依赖性信号途径进行深入研究。
综上,本研究说明了山新杨PdPapGH12基因组织表达模式为随杨树发育梯度而表达提升,其生物功能可能仅在成熟组织中特异性发挥。PdPapGH12是特异性地响应盐、碱和高渗透压胁迫的重要蛋白。PdPapGH12能对根部多种致病真菌侵染产生不同程度的应答,尤其是对Fo侵染表达高度上调,说明PdPapGH12可能是直接响应具有营活体营养的病原的一个重要基因,并且可能在对内生真菌的識别和响应中也扮演重要角色。此外,PdPapGH12参与了植物激素SA、JA和ABA诱导的信号途径。本研究结果将为进一步揭示PdPapGH12基因的功能和通过分子植物育种构建高抗速生杨树品种提供依据。
【参 考 文 献】
[1] 朱颖, 高路, 倪红伟. 黑龙江省国有重点林区森林资源动态变化及原因分析[J]. 森林工程, 2018, 34(3): 32-38.
ZHU Y, GAO L, NI H W. Analysis on dynamic change and the reason of forest resources in the state-owned forest area of Heilongjiang Province[J]. Forest Engineering, 2018, 34(3): 32-38.
[2]张金鹏, 郦芝汀, 吴海楠, 等. 几种杨树全基因组复制事件与进化分析[J]. 分子植物育种, 2020. https://kns.cnki.net/kcms/detail/46.1068.S.20201216.1635.010.html.
ZHANG J P, LI Z T, WU H N, et al. Whole genome duplication events and evolutionary analyses of several populus species[J]. Molecular Plant Breeding, 2020, https://kns.cnki.net/kcms/detail/46.1068.S.20201216.1635.010.html.
[3]贾庆彬, 王晓伟, 邹建军, 等. 大青杨无性系材性分析与优良无性系选择[J]. 森林工程, 2020, 36(2): 12-19.
JIA Q B, WANG X W, ZOU J J, et al. Analysis of variance in wood properties of Populus ussuriensis clones and superior clones selection[J]. Forest Engineering, 2020, 36(2): 12-19.
[4]洪雪, 杨清福, 张光华, 等. “三北”平原林业生态工程建设中存在的问题及对策分析[J]. 森林工程, 2006, 22(4): 4-6.
HONG X, YANG Q F, ZHANG G H, et al. The existing problems of forestry ecological engineering construction in the three north plain and countermeasure analysis[J]. Forest Engineering, 2006, 22(4): 4-6.
[5]苏振峰. GH1 β-葡萄糖苷酶在拟南芥和水稻中的生物信息学及表达模式分析[D]. 泰安: 山东农业大学, 2014.
SU Z F. Bioinformation and expression patterns analysis of GH1β-glucosidases in Arabidopsis and rice[D]. Taian: Shandong Agricultural University, 2014.
[6]CULLEN V, SARDI S P, NG J, et al. Acid β-glucosidase mutants linked to gaucher disease, parkinson disease, and lewy body dementia alter α-synuclein processing[J]. Annals of Neurology, 2011, 69(6): 940-953.
[7]SINGH R P, RAJARAMMOHAN S, THAKUR R, et al. Linear and branched beta-Glucans degrading enzymes from versatile Bacteroides uniformis JCM 13288T and their roles in cooperation with gut bacteria[J]. Gut Microbes, 2020, 12(1): 11-18.
[8]施赛玲. 解纤维芽孢杆菌来源的适冷木聚糖酶和β-葡萄糖苷酶的异源表达及酶学性质研究[D]. 镇江: 江苏大学. 2017.
SHI S L. Heterologous expression and characterization of cold-adaptedxylanase and β-glucosidase from Bacillus cellulosilyticus[D]. Zhenjiang: Jiangsu University, 2017.
[9]GUDMUNDSSON M, HANSSON H, KARKEHABADI S, et al. Structural and functional studies of the glycoside hydrolase family 3 β-glucosidase Cel3A from the moderately thermophilic fungus Rasamsonia emersonii[J]. Acta Crystallographica Section D, 2016, 72(7): 860-870.
[10]劉玉姣. 嗜热革节孢第一家族和第六家族糖苷水解酶的分子改造[D]. 泰安: 山东农业大学, 2017.
LIU Y J. Molecule evolution of glycoside hydrolase family 1 and family 6 from Scytalidium thermophilium[D]. Taian: Shandong Agricultural University, 2017.
[11]郑芳芳. Streptomyces sp.GXT6中β-葡萄糖苷酶的酶学性质研究[D]. 南宁: 广西大学, 2018.
ZHENG F F. Characterization of β-glucosidases from streptomyces sp.GXT6[D]. Nanning: Guangxi University, 2018.
[12]HENRISSAT B, CALLEBAUT I, FABREGA S, et al. Conserved catalytic machinery and the prediction of a common fold for several families ofglycosyl hydrolases[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(15): 7090-7094.
[13]JENKINS J, LO LEGGIO L, HARRIS G, et al. Β-Glucosidase,β-galactosidase, family A cellulases, family F xylanases and two barley glycanases form a superfamily of enzymes wit 8-fold β/α architecture and with two conserved glutamates near the carboxy-terminal ends of β-strands four and seven[J]. FEBS Letters, 1995, 362(3): 281-285.
[14]刘宇. 橡胶籽中β-葡萄糖苷酶分离鉴定、变性特点及结构性质的研究[D]. 海口: 海南大学, 2015.
LIU Y. Study on the isolation and identification, degeneration characteristics and structure properties for β-glucosidase from Hevea brasiliensis seed[D]. Haikou: Hainan University, 2015.
[15]ZAGROBELNY M, BAK S, MOLLER B L.Cyanogenesis in plants and arthropods[J]. Phytochemistry, 2008, 69(7): 1457-1468.
[16]XU Z Y, LEE K H, DONG T, et al. A vacuolar β-glucosidase homolog that possesses glucose-conjugated abscisic acid hydrolyzing activity plays an important role in osmotic stress responses in Arabidopsis[J]. The Plant Cell, 2012, 24(5): 2184-2199.
[17]SHERAMETI I, VENUS Y, DRZEWIECKI C, et al. PYK10, a β-glucosidase located in the endoplasmatic reticulum, is crucial for the beneficial interaction between Arabidopsis thaliana and the endophytic fungus Piriformospora indica[J]. The Plant Journal, 2008, 54(3): 428-439.
[18]CHO E J, NGUYEN Q A, LEE Y G, et al. Enhanced biomass yield of and Saccharification in Transgenic tobacco over-expressing β-glucosidase[J]. Biomolecules, 2020, 10(5): 806-822.
[19]李蕊伽. 芦荟叶皮β-葡萄糖苷酶的分离纯化及酶学性质和功能基团研究[D]. 重庆: 西南大学, 2017.
LI R J. Isolation, purification and properties, modification of group of β-glucosidase from leaf skin of Aloe Vera[D]. Chongqing: Southwest University, 2017.
[20]BABA S A, VISHWAKARMA R A, ASHRAF N. Functional characterization of CsBGlu12, a β-glucosidase from Crocus sativus provides insights into its role in abiotic stress through accumulation of antioxidant flavonols[J]. Journal of Biological Chemistry, 2017, 292(11): 4700-4713.
[21]南希偉, 杨洪军, 李晓波, 等. 山新杨应用前景的探讨[J]. 防护林科技, 2006(5): 74.
NAN X W, YANG H J, LI X B, et al. Discussion on the application prospect of Populus spp.[J]. Protection Forest Science and Technology, 2006(5): 74.
[22]WANG Y F, HOU X Y, DENG J J, et al. AUXIN RESPONSE FACTOR 1 Acts as a positive regulator in the response of poplar to Trichoderma asperellum inoculation in overexpressing plants[J]. Plants (Basel), 2020, 9(2): 272.
[23]GANG H X, LI R H, ZHAO Y M, et al. Loss of GLK1 transcription factor function reveals new insights in chlorophyll biosynthesis and chloroplast development[J]. Journal of Experimental Botany, 2019, 70(12): 3125-3138.
[24]RIEDEL G, RUDRICH U, FEKETE-DRIMUSZ N, et al. An extended ΔCT-method facilitatingnormalisation with multiple reference genes suited for quantitative RT-PCR analyses of human hepatocyte-like cells[J]. PLoS One, 2014, 9(3): e93031.
[25]张腾倩, 张伟溪, 丁昌俊, 等. 欧美杨PdMODD基因克隆与表达特性分析[J]. 南京林业大学学报(自然科学版), 2021, 45(2): 43-50.
ZHANG T Q, ZHANG W X, DING C J,et al. Cloning and expression characteristics of PdMODD genes in Populus × euramericana[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2021, 45(2): 43-50.
[26]XU J Q, LIU S S, LIU G, et al. β-glucosidase from Hevea brasiliensis seeds: Purification, homology modeling, and insights into the substrate-binding model[J]. Journal of Food Biochemistry, 2020, 44(6): e13206.
[27]RODJANA O, JANJIRA M, TAKASHI A, et al. Rice Os4BGlu12 is a wound-induced β-glucosidase that hydrolyzes cell wall-β-glucan-derived oligosaccharides and glycosides[J]. Plant Science, 2010, 179(3): 273-280.
[28]SHINOZAKI K, YAMAGUCHI-SHINOZAKI K, SEKI M. Regulatory network of gene expression in the drought and cold stress responses[J]. Current Opinion in Plant Biology, 2003, 6(5): 410-417.
[29]BARTELS D, SUNKAR R. Drought and salt tolerance in plant[J]. Critical Reviews in Plant Sciences, 2007, 24(1):23-58.
[30]PARWEE D, SULTAN E, DALEI K, et al. Arabidopsis nonhost resistance gene PENETRATION 2 is involved in disruption of cushion formation by Rhizoctonia solani during early infection process[J]. Australasian Plant Pathology, 2021, https://schlr.cnki.net/en/Detail/index/SSJDLAST/SSJDA90A8551B64556C
3B4994D77FDEC6AE1.
[31]BEDNAREK P, PISLEWSKA-BEDNAREK M, SVATOS A, et al. Aglucosinolate metabolism pathway in living plant cells mediates broad-spectrum antifungal defense[J]. Science, 2009, 323(5910): 101-106.
[32]NAGANO A J, MATSUSHIMA R, HARA-NISHIMURA I. Activation of an ER-body-localized β-glucosidase via a cytosolic binding partner in damaged tissues of Arabidopsis thaliana[J]. Plant and Cell Physiology, 2005, 46(7): 1140-1148.
[33]TURNER J G. Stress responses: JAZ players deliver fusion and rhythm[J]. Current Biology, 2007, 17(19): R847-R849.
[34]ZHANG Y F, LI D Y, ZHANG H J, et al. Tomato histone H2Bmonoubiquitination enzymes SlHUB1 and SlHUB2 contribute to disease resistance against Botrytis cinerea through modulating the balance between SA-and JA/ET-mediated signaling pathways[J]. BMC Plant Biology, 2015, 15: 252.
