体外培育牛黄治疗缺血性中风中脏腑的临床观察
2021-08-23汪慧陈延李平黄敏郭珍立
汪慧 陈延 李平 黄敏 郭珍立
〔摘要〕 目的 观察体外培育牛黄治疗缺血性中风中脏腑(痰热内闭证)患者的临床疗效。方法 选取湖北省中西医结合医院2017年2月至2020年2月新发缺血性中风中脏腑(痰热内闭证)患者108例,分为治疗组和对照组,每组54例。所有患者均给予西医常规治疗,治疗组患者另外加服体外培育牛黄0.3 g/d,温水化开后鼻饲,疗程为1周。观察治疗前及治疗后1周、4周及3个月两组患者格拉斯哥昏迷指数(GCS)、美国国立卫生研究院卒中量表(NIHSS)、改良Rankin量表(mRS)评分的变化情况;检测治疗前及治后1周超敏C反应蛋白(Hs-CRP)、神经元特异性烯醇化酶(NSE)、S-100β蛋白水平的变化情况。结果 治疗后1周,治疗组和对照组GCS评分、NIHSS評分、mRS评分比较差异无统计学意义(P>0.05),治疗后4周及3个月,治疗组GCS评分高于对照组,NIHSS评分、mRS评分低于对照组,差异均有统计学意义(P<0.05)。治疗后1周,两组患者血清Hs-CRP、NSE、S-100β蛋白水平均较治疗前下降,且治疗组低于对照组,差异有统计学意义(P<0.05)。结论 体外培育牛黄治疗缺血性中风中脏腑(痰热内闭证)可有效降低患者的炎性反应、减轻神经损伤、改善中远期预后,有一定的临床应用价值。
〔关键词〕 中风;中脏腑;痰热内闭证;体外培育牛黄;格拉斯哥昏迷指数;美国国立卫生研究院卒中量表;改良Rankin量表
〔中图分类号〕R255.2 〔文献标志码〕B 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.07.022
〔Abstract〕 Objective To observate the clinical effect of in-vitro-cultured calculus bovis on ischemic apoplexy involving Zang and Fu-viscera (syndrome of phlegm heat blocking internally). Methods Patients with first-ever ischemic apoplexy involving Zang and Fu-viscera (syndrome of phlegm heat blocking internally) who hospitalized in Hubei Provincial Hospital of Integrated Chinese and Western Medicine from February 2017 to February 2020 were selected. The patients were separated into treatment group and control group randomly, 54 patients in each group. All the patients were given the routine treatment of western medicine. The treatment group were treated with in-vitro-cultured calculus bovis 0.3 g everyday extraly, nasal feeded after warm hydration. The course of treatment was one week. The Glasgow coma scale (GCS), National Institutes of Health stroke scale (NIHSS) and improved Rankin scale (mRS) were calculated before treatment and after 1 week, 4 weeks, 3 months of treatment; the levels of hypersensitive C-reactive protein (Hs-CRP), neuron-specific enolase (NSE) and S-100β protein were calculated before treatment and after 1 week of treatment. Results After 1 week of treatment, the scores of GCS, NIHSS and mRS were compared between the two groups, there was no significant difference between the treatment group and the control group (P<0.05). After 4 weeks and 3 months of treatment, the scores of GCS of the treatment group was higher than the control group, the scores of NIHSS and mRS were lower than the control group, and there was a significant difference between the two groups (P<0.05). After 1 week of treatment, the levels of Hs-CRP, NSE and S-100β protein were lower than before treatment, and treatment group was lower than the control group, there was a significant difference between the two groups (P<0.05). Conclusion The application of in-vitro-cultured calculus bovis on the patients of ischemic apoplexy involving Zang and Fu-viscera (syndrome of phlegm heat blocking internally) could reduce the inflammatory response and neurologic impairment, improve the medium term and forward prognosis, it has a certain value of clinical applications.
〔Keywords〕 apoplexy; apoplexy involving Zang and Fu-viscera; syndrome of phlegm heat blocking internally; in-vitro-cultured calculus bovis; Glasgow coma scale; National Institutes of Health stroke scale; improved Rankin scale
脑梗死属中医学“中风”范畴,有高发病率、高致残率、高病死率、高复发率、高经济负担等特点[1]。中风中脏腑者病情尤为严重,多伴随神昏、高热、惊厥,且西医疗效欠佳。中风中脏腑(痰热内闭证)的患者痰热内结、痰壅神窍、心神失主,乃至昏迷,其治疗重在清热化痰、醒脑开窍[2]。牛黄是牛胆结石,有清心、豁痰、开窍、凉肝、息风、解毒的功能,用于治疗高热神昏、中风惊厥等疾病[3],但药源匮乏、价格昂贵。体外培育牛黄的性状、成分、含量及药效与天然牛黄相似度极高,可替代天然牛黄[4]。超敏C反应蛋白(highsensitivity C-reactive protein, Hs-CRP)、S-100β蛋白水平可反映中枢神经系统炎症反应的严重程度,两者的血清水平与脑梗死病情的严重及预后相关[5-7]。神经元特异性烯醇化酶(neuron-specificenolase, NSE)可作为中枢神经系统损伤的定量指标[8-10]。本研究通过临床评分及检测Hs-CRP、S-100β蛋白、NSE 3种血清学指标,旨在观察体外培育牛黄对缺血性中风中脏腑痰热内闭证的治疗效果。
1 资料与方法
1.1 病例资料
选取湖北省中西医结合医院2017年2月至2020年2月新发缺血性中风中脏腑(痰热内闭证)的患者108例,随机分为治疗组和对照组,每组54例。所有患者入院后均采集性别、年龄、既往史(高血压病、糖尿病、冠心病、高脂血症)、体质量指数(body mass index, BMI)等资料。两组在性别、年龄、BMI、高血压、糖尿病、冠心病患病率方面差异均无统计学意义(P>0.05),可认为两组基线水平基本一致。
1.2 诊断标准
(1)中医中风病诊断标准参照《中风病诊断与疗效评定标准》[11];(2)西医脑梗死诊断标准参照中华医学会神经病学分会制定的诊断标准[12],并经颅脑CT或MRI确诊为脑梗死;(3)中医证候辨证诊断参照《中风病中医诊断、疗效评定标准》[13],痰热内闭证诊断标准:神识昏蒙,鼻鼾痰鸣,半身不遂,或肢体强痉拘急,面赤身热,气粗口臭,躁扰不宁,大小便闭,甚则抽搐、呕血。舌质红绛、舌苔黄腻或褐黄干腻,脉弦滑。
1.3 纳排标准
1.3.1 纳入标准 (1)年龄30~80岁;(2)符合西医脑梗死及中医中风的诊断标准;(3)发病48 h内入院;(4)有意识障碍,符合中医中脏腑痰热内闭辨证。
1.3.2 排除标准 (1)短暂性脑缺血发作;(2)出血性脑梗死或蛛网膜下腔出血;(3)脑疝形成或格拉斯哥昏迷指数(Glasgow coma scale, GCS)评分≤4分;(4)既往有肢体伤残、脑梗死、脑外伤、颅脑手术、癫痫病史;(5)合并其他系统严重疾病、精神疾病者。
1.4 治疗方法
两组患者均给予抗血小板聚集、抗动脉粥样硬化、营养神经和改善脑循环、控制血糖、血压治疗,对于合并感染的患者,给予抗感染及对症支持治疗。治疗组在此基础上给予体外培育牛黄0.3 g/d(武汉健民大鹏药业有限公司,批号:20170112,规格:0.3 g/瓶),温水化开后鼻饲,连服1周。
1.5 观察指标
1.5.1 GCS、NIHSS、mRS量表评分 分别于治疗前(入院24 h内)、治疗后1周、4周及3个月分别评定GCS评分、美国国立卫生研究院卒中量表(National Institutes of Health stroke scale, NIHSS)评分、改良Rankin量表(improved rankin scale, mRS)评分[14]。
(1)GCS是国际上最常用的昏迷评估量表,分别从睁眼、语言、运动3方面逐一评分,三者的积分即表示意识障碍程度,13~15分为轻度,9~12分为中度,3~8分为重度。
(2)NIHSS評分是用来评判脑梗死患者的神经缺损程度。量表包含对意识、语言、运动、感觉、共济运动、眼球运动、视野等方面的评判,评分为0~42分,分数越高,提示神经缺损程度越严重。
(3)mRS评分是常用的评估脑梗死预后的指标,分值越高提示预后越差。mRS为0~2分者提示预后较好,mRS为3~6分者为预后差[15],其中5分为生活依赖、6分为死亡。
1.5.2 速率散射比浊法检测Hs-CRP水平 采集2 mL静脉血液置于BD真空采血管中,于2 ℃冰箱中以2 000 r/min离心15 min(离心半径12 cm),分离出血浆。使用美国贝克曼LX20型全自动微量蛋白分析仪采用速率散射比浊法检测Hs-CRP。
1.5.3 电化学发光免疫分析法检测NSE、S-100β蛋白水平 按照方法“1.5.2”分离出血浆后,使用德国罗氏全自动电化学发光酶免疫分析仪检测血清NSE、S-100β蛋白水平。所有操作严格按照试剂盒说明书进行。
1.6 统计学分析
统计数据采用SPSS 19.0统计软件进行处理。计量资料用“x±s”表示,先检验方差齐性,符合正态分布的两组间比较用t检验,3组及3组以上的比较用方差分析,不符合正态分布的计量资料(mRS评分)采用“M(P25,P75)”进行统计描述,采用秩和检验。P<0.05表示差异有统计学意义。
2 结果
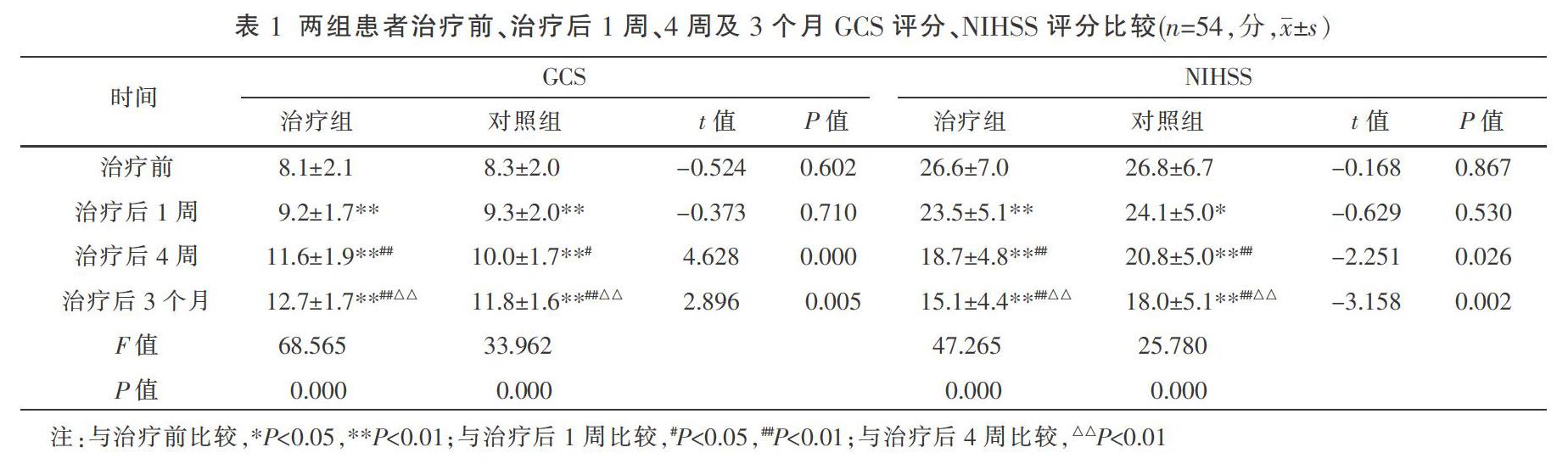
2.1 两组患者治疗前、治疗后1周、4周及3个月GCS评分、NIHSS评分比较
治疗前、治疗后1周两组患者GCS评分、NIHSS评分比较,差异无统计学意义(P>0.05);治疗后4周及3个月,治疗组GCS评分高于对照组,治疗组NIHSS评分低于对照组,差异均有统计学意义(P<0.05或P<0.01);治疗后1周、4周及3个月,两组患者GCS评分逐渐升高,NIHSS评分逐渐下降,差异均有统计学意义(P<0.05或P<0.01)。见表1。
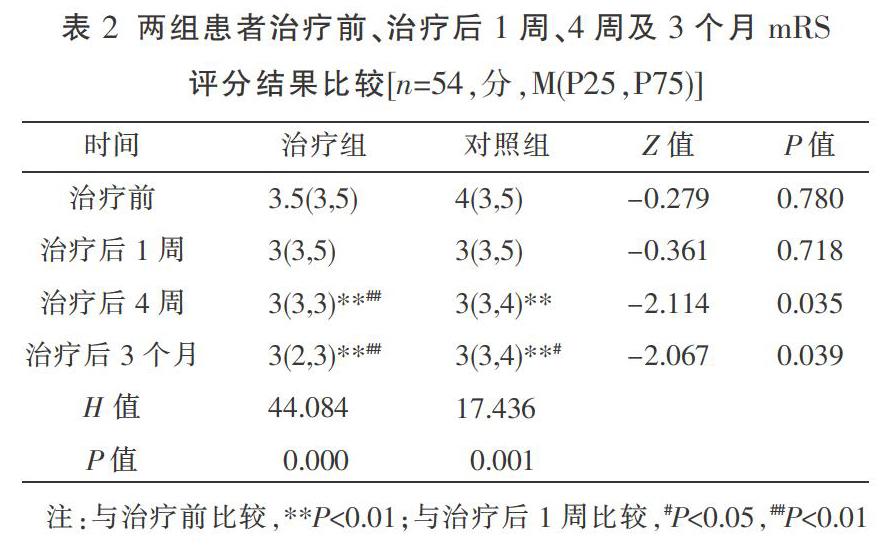
2.2 两组患者治疗前、治疗后1周、4周及3个月mRS评分比较
治疗前和治疗后1周,两组患者mRS评分比较,差异无统计学意义(P>0.05);治疗后4周及3个月,治疗组mRS评分低于对照组,差异有统计学意义(P<0.05);与治疗前及治疗后1周比较,治疗后4周及3个月mRS评分降低,差异有统计学意义(P<0.05或P<0.01);治疗后4周及3个月mRS评分比较,差异无统计学意义(P>0.05)。见表2。
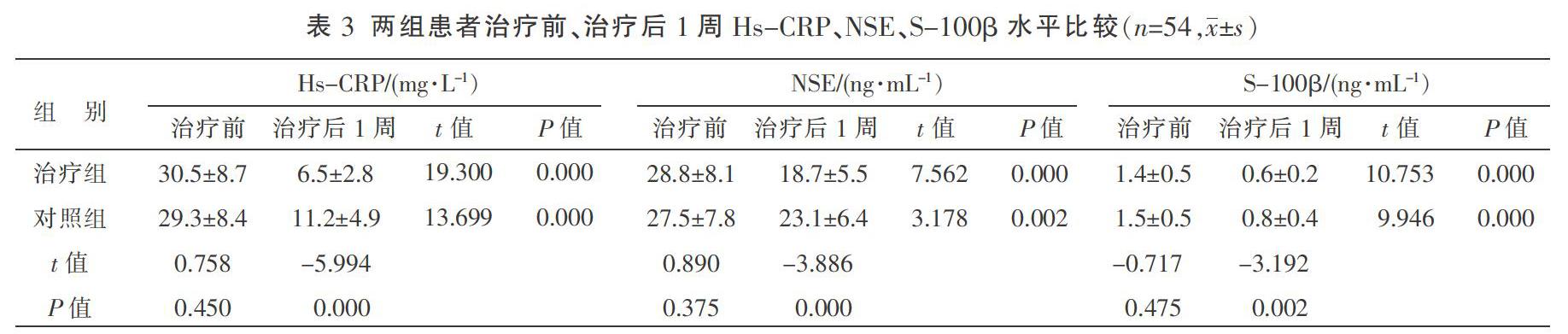
2.3 两组患者治疗前、治疗后1周的Hs-CRP、NSE、S-100β水平比较
治疗前,两组血清Hs-CRP、NSE、S-100β蛋白水平比较,差异无统计学意义(P>0.05)。治疗后1周,两组患者血清Hs-CRP、NSE、S-100β蛋白水平均较治疗前下降,且治疗组低于对照组,差异均有统计学意义(P<0.05)。见表3。
2.4 不良反应
治疗组2例出现腹泻,对照组1例出现头痛,对症处理后耐受良好,无肝肾功能损害及凝血功能异常,无其他不良反应发生。
3 讨论
脑梗死患者缺血-再灌注损伤可引起大量的炎性因子释放,炎性反应可推动脑梗死的进展。Hs-CRP是临床最常用的炎性反应指标之一,其血清水平与脑梗死病情的严重及预后明确相关[5]。NSE是机体神经元的标志酶,也是神经内分泌细胞糖酵解途径所需的特异酶,大量存在于神经元的胞体和突触内。脑损伤后,大量的NSE被释放进入血液,破坏神经元细胞膜的完整性[16]。在阿尔茨海默病、癫痫、多发性硬化、颅脑外伤及中风的患者中,脑脊液中NSE水平明显增加,且与脑损伤的严重程度相关[17]。S-100β蛋白是一类钙结合蛋白,可促进神经元及神经胶质细胞的生长及修复[18]。脑梗死时,神经元及神经胶质细胞损伤的同时血脑屏障破坏,胞体中的S-100β蛋白进入脑脊液及血液循环中,外周血S-100β蛋白水平升高[19]。LARIBI等[20]指出,患者神经元及胶质细胞损伤越严重,其外周血中的S-100β蛋白水平越高。
对于脑梗死重症患者,西医治疗可有效减轻脑水肿、改善脑侧支循环,但是目前脑保护治疗方面临床试验结果不一致,尚无定论[21-22]。因此,积极寻找具有脑保护作用的中药治疗显得尤为重要。中医学认为,中风病的起因是积损正衰、饮食不节、劳逸失度、情志不畅或外邪侵袭,其病因主要为风、火、痰、瘀、虚,其病机为阴阳失调、气血逆乱。唐晓军等[23]认为中风中脏腑者痰热相互影响,阳热亢盛,炼液成痰,痰湿盛者,中焦运化受阻,脾胃运化失常,上不能升清气,下不能降浊气,糟粕内停,加之气机运行受阻,郁而化火,更助痰盛。热盛伤津,大肠燥粪内结、腑气壅滞不通,气机升降失调,气血逆乱,上冲于脑,内闭清窍,神机失用而致神昏。中脏腑痰热内闭证治疗主要是清热化痰、醒脑开窍。
本研究中,治疗后1周、4周及3个月,两组GCS评分较治疗前升高,NIHSS评分、mRS评分均较治疗前下降(P<0.05)。在治疗后4周及3个月,治疗组GCS评分高于对照组,NIHSS评分、mRS评分低于对照组(P<0.05)。上述结果提示在西药治疗的基础上,加用体外培育牛黄治疗后,可有效改善中风中脏腑患者的中远期预后。治疗后1周,治疗组和对照组GCS、NIHSS、mRS评分比较差异无统计学意义,提示体外培育牛黄对中脏腑痰热内闭证患者近期预后无明显改善。这可能与患者病情过重,脑水肿期过长有关。本研究中,治疗后1周,治疗组和对照组患者血清Hs-CRP、NSE、S-100β蛋白水平均较治疗前下降,且治疗组低于对照组(P<0.05),提示在西药治疗的基础上,加用体外培育牛黄治疗,可有效降低炎性反应、减轻神经损伤。
安宫牛黄丸是经典的醒脑开窍药物,但方剂中的朱砂和雄黄为有毒重金属中药,有一定的肝肾毒性,另外,牛黄、水牛角、黄连、栀子均为寒凉药物,合用加重药效,易损脾胃,因此,限制了某些高龄患者或有基础肝肾疾病或脾胃虚弱患者的临床应用。牛黄是安宫牛黄丸的君药,但产量低且价格昂贵。其替代品体外培育牛黄量多价廉,且避免了天然牛黄带菌的不足。现代医学研究[23]发现,中风患者的胃肠蠕动减慢,尤其是中脏腑患者长时间卧床,肠内容物稽留,同时经过脱水、降颅压等治疗后,肠液分泌减少,以致大便秘结,毒素蓄积,病情加重。蔡红娇等[24]通过小鼠实验研究发现,体外培育牛黄具有耐缺氧作用,此作用与其提高SOD活性和降低MDA含量、提高机体清除自由基的能力、减轻脂质过氧化作用对脑、心、组织的损害有关。最新研究[25]提示牛黄对脑细胞及血管的保护作用可能与调控凋亡蛋白Bax和Bcl-2表达有关。体外培育牛黄息风止痉、豁痰开窍、清熱解毒,打破痰热交互的病机,改善新陈代谢,增加胃肠道蠕动,排除体内毒素[4],清除自由基,减轻过氧化,从而达到保护脑组织的作用。
综上,对于中风中脏腑痰热内闭证患者,在西医常规治疗基础上,合用体外培育牛黄可有效降低炎性反应、减轻神经损伤、改善中远期预后,有一定的临床应用价值。本文病例数较少,同时有关体外培育牛黄的最佳治疗剂量以及疗程、停药指征等问题,目前尚不明确,尚需要大规模的临床研究来进一步探究。
參考文献
[1] WANG W Z, JIANG B, SUN H X, et al. Prevalence, incidence, and mortality of stroke in China: Results from a nationwide population-based survey of 480 687 adults[J]. Circulation, 2017, 135(8): 759-771.
[2] 王永炎.中医内科学[M].上海:上海科学技术出版社,1997:129.
[3] 中华人民共和国卫生部药典委员会.中华人民共和国药典,2020年版一[M].人民卫生出版社,2020.
[4] 吴 涛,张程亮,蔡红娇,等.牛黄及体外培育牛黄的药理作用研究进展[J].中国药师,2014,17(8):1396-1399.
[5] PANDEY A, SHRIVASTAVA A K, SAXENA K. Neuron specific enolase and c-reactive protein levels in stroke and its subtypes: Correlation with degree of disability[J]. Neurochemical Research, 2014, 39(8): 1426-1432.
[6] SEL U K, YAYLA V, ABALAR M, et al. The relationship of serum S100B levels with infarction size and clinical outcome in acute ischemic stroke patients[J]. Noro Psikiyatri Arsivi, 2014, 51(4): 395-400.
[7] 王子溪,钱 凯,王 勋,等.S100β蛋白与脑梗死研究进展[J].医学综述,2019,25(23):4626-4630.
[8] 林绍鹏,殷建瑞.血清神经元烯醇化酶水平对急性脑梗死患者转归的预测价值[J].山东医药,2014,54(4):7-9.
[9] CHENG F, YUAN Q, YANG J, et al. The prognostic value of serum neuron-specific enolase in traumatic brain injury: Systematic review and meta-analysis[J]. PLoS One, 2014, 9(9): e106680.
[10] MERCIER E, TARDIF P A, CAMERON P A, et al. Prognostic value of neuron-specific enolase (NSE) for prediction of post-concussion symptoms following a mild traumatic brain injury: A systematic review[J]. Brain Injury, 2018, 32(1): 29-40.
[11] 中风病诊断与疗效评定标准(试行)[J].北京中医药大学学报,1996,19(1):55-56.
[12] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2018[J].中华神经科杂志,2018,51(9):666-682.
[13] 中华全国中医学会内科学会.中风病中医诊断、疗效评定标准[J].中国医药学报,1986,1(2):56-57.
[14] 郭玉璞.神经病学[M].北京:人民卫生出版社,2006:965.
[15] QUN S, TANG Y, SUN J, et al. Neutrophil-to-lymphocyte ratio predicts 3-month outcome of acute ischemic stroke[J]. Neurotoxicity Research, 2017, 31(3): 444-452.
[16] ANDERSON B J, REILLY J P, SHASHATY M G S, et al. Admission plasma levels of the neuronal injury marker neuron-specific enolase are associated with mortality and delirium in Sepsis[J]. Journal of Critical Care, 2016, 36: 18-23.
[17] ATL G, AN K A, ACAR S, et al. Brain injury markers: S100 calcium-binding protein B, neuron-specific enolase and glial fibrillary acidic protein in children with diabetic ketoacidosis[J]. Pediatric Diabetes, 2018, 19(5): 1000-1006.
[18] ROHLWINK U K, MAUFF K, WILKINSON K A, et al. Biomarkers of cerebral injury and inflammation in pediatric tuberculous meningitis[J]. Clinical Infectious Diseases, 2017, 65(8): 1298-1307.
[19] ISGRò M A, BOTTONI P, SCATENA R. Neuron-specific enolase as a biomarker: Biochemical and clinical aspects[J]. Advances in Experimental Medicine and Biology, 2015, 867: 125-143.
[20] LARIBI S, KANSAO J, BORDERIE D, et al. S100B blood level measurement to exclude cerebral lesions after minor head injury: The multicenter STIC-S100 French study[J]. Clinical Chemistry and Laboratory Medicine, 2014, 52(4): 527-536.
[21] PATEL R A G, MCMULLEN P W. Neuroprotection in the treatment of acute ischemic stroke[J]. Progress in Cardiovascular Diseases, 2017, 59(6): 542-548.
[22] SECADES J J, ALVAREZ-SABíN J, CASTILLO J, et al. Citicoline for acute ischemic stroke: A systematic review and formal meta-analysis of randomized, double-blind, and placebo-controlled trials[J]. Journal of Stroke and Cerebrovascular Diseases, 2016, 25(8): 1984-1996.
[23] 唐曉军,刘 波,曲秀绢.通腑化痰法治疗中风中脏腑闭症的临床观察[J].光明中医,2007,22(7):56-57.
[24] 蔡红娇,汪世元,刘烈刚,等.体外培育牛黄耐缺氧和清除自由基作用的研究[J].中药药理与临床,2003,19(6):20-22.
[25] ZHONG X M, REN X C, LOU Y L, et al. Effects of in-vitro cultured Calculus bovis on learning and memory impairments of hyperlipemia vascular dementia rats[J]. Journal of Ethnopharmacology, 2016, 192: 390-397.
