高压均质鸡蛋卵黄对猪冷冻精子凋亡的影响
2021-08-23汪俊跃戴建军张树山孙玲伟吴彩凤张德福
汪俊跃,戴建军,张树山,孙玲伟,吴彩凤,张德福*
(1.上海市农业科学院畜牧兽医研究所,上海农业遗传育种重点实验室,动物遗传工程研究室,上海 201106;2.上海海洋大学,水产科学国家级试验教学示范中心,上海 201306)
猪精液冷冻技术的发展给养猪业提供了商业价值和运输保障。冷冻精液能克服时空限制,最大限度的提高养殖场精液利用率[1]。但猪精子富含多不饱和脂肪酸,在冷冻过程中易发生冷冻损伤,从而导致冻后质量下降,这也是限制猪精液冷冻技术发展的主要因素之一[2],因此,如何降低猪精子在冷冻中的损伤已成为目前研究的主要方向。卵黄作为一种常用的冷冻保护剂,已证实在动物精液冷冻过程中,卵黄能附着在精子膜上增强精子抗冷休克能力,从而提高精子冻后质量[3]。但卵黄中蛋白质成分较为复杂,其所含的大量脂质导致稀释液粘度增加,未经处理的卵黄中含有大颗粒物质,可抑制精子呼吸并降低精子运动能力[4]。此外,卵黄作为动物源成分,存在一定的生物安全性风险[5],在卵黄保存精液过程中能对精子造成不可逆的损伤,因此,卵黄处理方式也在不断更新。
高压均质技术是指在高强度的压力和空气剪切力作用下,使稀释液在很短时间内高速旋转通过小孔,极大程度的降低稀释液中大颗粒粒径,并破坏溶液中微生物细胞基本结构和功能,使其失去或钝化生物活性,以减少冷冻过程中对物质的物理损伤[6-7]。利用高压均质处理的鸡蛋卵黄溶液与普通鸡蛋卵黄溶液不同,高压均质后鸡蛋卵黄溶液粒径减小,溶液稳定性提高。作为一种动态高压的非热加工技术,高压均质能短时间产生高压并不改变溶液本身性质[8-9]。有研究发现,经高压均质处理后能提高鸡蛋卵黄溶液的溶解性和稳定性,减少其中的微生物含量[10-11]。但目前为止,仍缺乏高压均质处理后的鸡蛋卵黄对猪冷冻精子凋亡水平影响的研究。
本试验通过高压均质鸡蛋卵黄对猪精液冷冻保存效果的研究,比较冷冻后精子质量、DNA完整性、线粒体膜电位变化(△Ψm)、细胞凋亡率水平、多种Caspase活性以及凋亡功能基因的表达水平,为进一步提高猪精液冷冻效果提供参考。
1 材料与方法
1.1 试剂与样品
1.1.1 试验试剂 高压均质处理的卵黄加工于苏州纳米生物园;注射用青霉素钠和硫酸链霉素购于河北石家庄远征药业有限公司;一步法TUNEL细胞凋亡检测试剂盒(绿色荧光)和JC-1线粒体膜电位检测试剂盒购于上海碧云天生物技术有限公司;吖啶橙(AO)购于美国Sigma公司;Caspase-3、Caspase-8和Caspase-9原位荧光染色试剂购于Bio Vision公司;RNA prep Pure Micro Kit和Fast Quant RT Kit 试剂盒购于中国Tiangen公司。
1.1.2 精液采集 精液采自上海祥欣种公猪站,2岁杜洛克种公猪(n=5),利用手握法收集中段浓缩部分的精液,15 min内带回实验室。选择色泽正常、活力大于0.8的精液用于冷冻保存。试验前经过多次预试验,利用5头杜洛克公猪的混精,以排除个体差异。
1.2 试验设计
基础稀释液(TCG)[12]的配制:称取柠檬酸1.48 g、葡萄糖1.1 g和 TRIS 2.42 g,溶解后加入200 IU·mL-1双抗、6 mL甘油,调节溶液pH为7.1,定容至100 mL。
试验组为基础稀释液中添加20%经高压均质处理的鸡蛋卵黄,以普通鸡蛋卵黄为对照组,分别配制成冷冻Ⅰ液和冷冻Ⅱ液。冷冻-解冻后检测猪精子各项指标。
1.3 精液的冷冻解冻
1.3.1 预处理 采用两步稀释法。将采集的合格精液用等温等量的预稀释液进行稀释,经1 h室温平衡后17 ℃离心(800 g,10 min),弃上清液;将配制好的冷冻Ⅰ液预冷后缓慢加入到离心后的沉积中,轻轻吹打摇匀后纱布包裹放入4 ℃冰箱平衡1.5~2 h。再等体积缓慢加入同步预冷过的Ⅱ液。选择精子活率高于0.75,密度大于1.0×109个·mL-1的精液进行冷冻。
1.3.2 精液冷冻 将灌装封口的0.5 mL细管放入程序冷冻仪(Planer公司,型号:Kryo 560-16)中并设置冷冻程序进行冷冻,待冷冻结束后迅速投入到液氮中保存。冷冻程序为:调整恒温箱温度为6 ℃,以保证冷冻程序进行的更快捷;设定从6 ℃降到4 ℃,以1 ℃/2 min进行降温;设定从4 ℃降到1 ℃, 以1.5 ℃/2 min进行降温;设定从1 ℃降到-140 ℃, 以30 ℃/4.8 min进行降温;设定-140 ℃保持1 0 min。
1.3.3 精液解冻 将冷冻保存的精液细管从液氮中迅速取出,放入60 ℃水浴锅中解冻12 s,用稀释液1∶10稀释,37 ℃孵育10 min后进行指标检测。
1.4 精子质量检测
1.4.1 精子活力 取10 μL解冻后精液滴在预热的精子计数板中,置于37 ℃恒温载物台上,使用精液自动分析仪在光学显微镜下随机选取5个视野,记录精子活力和活率。
1.4.2 DNA完整性 利用吖啶橙染色法检测精子DNA完整性[13]。取解冻后0.1 mL样品,加入0.9 mL PBS清洗3次后再用0.9 mL PBS重悬,取30 μL涂片并干燥,经甲醛固定10 min后,均匀滴上30 μL AO染液,黑暗条件下37 ℃孵育30 min后在荧光显微镜下观察,计数头部发荧光精子百分率,每次计数精子不少于200个。
1.4.3 线粒体膜电位检测 利用JC-1线粒体膜电位试剂盒对解冻后精子进行线粒体膜电位检测。37%条件下孵育20 min后利用荧光显微镜进行观察,计算红色(RITC)和绿色(FITC)精子比值(△Ψm)。每次计数精子不少于200个。
1.4.4 精子凋亡检测 利用一步法TUNEL凋亡检测试剂盒对精子进行凋亡检测。样品经多聚甲醛(4%)固定30 min后,利用PBS清洗3次,并加入含有Triton X-100(0.1%)的PBS重悬。室温孵育5 min后,用PBS清洗2次。加入50 μL TUNEL检测液并37 ℃避光孵育60 min。然后利用PBS洗涤2次 并用250 μL PBS重悬。利用荧光显微镜观察,计算绿色荧光精子数,每次计数精子不少于200个。
1.4.5 精子Caspase原位荧光染色 取解冻后精子样品分别进行Caspase-3、Caspase-8和Caspase-9原位荧光染色。37 ℃孵育20 min,利用PBS清洗3次并在荧光显微镜下观察。每次计数精子不少于200个。
1.4.6 精子总RNA提取 取解冻后精子样品,加等量Trizol裂解,利用RNA prep Pure Micro Kit试剂盒进行总RNA提取,检测OD值(OD260 nm/OD280 nm)为1.8~2.0之间,样品存放于-80 ℃低温柜。所有操作均需在低温柜或冰上进行。
1.4.7 逆转录和qRT-PCR 精子总RNA样品经Fast Quant RT Kit试剂盒逆转录得到cDNA。以GAPDH为内参基因,从NCBI获取猪精子有关基因的cDNA序列(Bcl-2-F、Bax、TNF-α、Caspase-8、Caspase-9、P53)并设计引物。利用所获得的猪相关基因的cDNA序列设计引物,构建20 μL 反应体系。反应条件:95 ℃预变性 30 s;95 ℃ 变性5 s,退火34 s, 72 ℃延伸 30 s,40个循环,完成反应。相对基因表达量利用2-△△CT算法(△△CT=[(CT目的基因-CT内参基因)处理组-(CT目的基因-CT内参基因)对照组]),每个试验重复3次。cDNA序列引物见表1。所有操作均需在低温柜或冰上进行。

表1 qRT-PCR所需引物信息
1.5 统计分析
每组试验至少重复3次,每次每组至少解冻2支 细管。本试验用SPSS 22.0软件进行数据分析,结果表示为“平均值±标准误(Mean±SEM)”,P<0.05表示差异显著。
2 结 果
2.1 高压均质鸡蛋卵黄对猪精子冻后质量的影响
如图1和表2所示,经高压均质处理后,猪精子冻后活力、活率和顶体完整率显著高于对照组(P<0.05),为87.64%、87.14%和66.61%,较对照组分别提高了12.58%、5.82%和12.48%。
2.2 高压均质鸡蛋卵黄对猪精子冻后凋亡水平的影响
由表3和图2、图3可见,经高压均质鸡蛋卵黄处理后线粒体膜电位和DNA完整率显著高于对照组(P<0.05),分别为0.74和61.76%。冷冻后精子经JC-1染色后均呈红绿色荧光,图2中经高压均质鸡蛋卵黄处理后精子绿色荧光(高亮部分)较对照组减少。经高压均质鸡蛋卵黄处理后精子凋亡水平显著降低(P<0.05),为37.74%,较对照组下降4.33%。

表2 冻后猪精子质量
2.3 高压均质鸡蛋卵黄对猪精子冻后Caspase水平的影响
由表4和图4可知,对照组荧光强度均高于试验组,解冻后猪精子Caspase水平对照组明显高于试验组(P<0.05)。试验组的Caspase-3、Caspase-8和Caspase-9活性为17.15、11.19和15.18,较对照组分别减少6.17、2.18和3.51(P<0.05)。
2.4 高压均质鸡蛋卵黄对猪精子冻后凋亡功能基因表达的影响
通过qRT-PCR得到相关基因mRNA表达水平如图5。以GAPDH为内参基因,不同基因表达量不同,对照组的Bax、TNF-α、Caspase-8、Caspase-9和P53基因表达量均高于试验组,其中Bax、TNF-α和Caspase-9基因表达均显著高于试验组(P<0.05);Caspase-8、P53基因表达水平较高于试验组(P>0.05)。相较于对照组,试验组的Bcl-2基因表达量升高(P>0.05)。

图1 冷冻后猪精子顶体完整性(400×)Fig.1 The sperm acrosome integrity after cryopreservation(400×)

表3 冻后猪精子凋亡水平

A.对照组JC-1染色;B.高压均质组的JC-1染色A. The JC-1 staining of frozen sperms in control group; B. The JC-1 staining of frozen sperms in the high pressure homogeneous group图2 冷冻后猪精子的JC-1染色(400×)Fig.2 The JC-1 staining of frozen porcine sperms(400×)
3 讨 论
本研究从冷冻后精子活力、DNA完整性、线粒体膜电位和凋亡情况着手,同时检测Caspase活性和相关基因mRNA表达水平,表明高压均质鸡蛋卵黄能降低猪精子冷冻细胞凋亡水平。
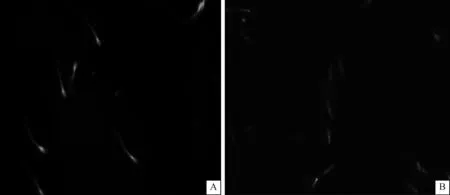
A.对照组TUNEL染色;B.高压均质组的TUNEL染色A. The TUNEL staining of frozen sperms in control group; B. The TUNEL staining of frozen sperms in the high pressure homogeneous group图3 冷冻后猪精子TUNEL染色(400×)Fig.3 The TUNEL staining of frozen porcine sperms(400×)

表4 冻后猪精子Caspase水平
本试验中,高压均质处理鸡蛋卵黄能有效提高猪精子冻后的活力和DNA完整性(P<0.05)。猪精子冻后活力是精子质量最直观的表现,DNA完整性是精卵是否能正常结合的保证。精子保存时间长短和冷冻过程中是否遭受物理损伤都会造成精子DNA完整性被破坏,导致精子质量下降[14-15]。这与本试验相似,未经处理的鸡蛋卵黄会残存不溶性大颗粒,精子在冷冻过程中对物理冲击、冷冲击和渗透应力等几个因素造成的损伤没有过强的抵抗力,而经过高压均质处理的鸡蛋卵黄溶液粒径减小且精子质量提高,推测可更好地促进卵黄中蛋白质和脂质的融合,降低卵黄自身存在的微生物对精液冷冻后影响,从而有效提高猪冻精质量。
精子获能是指精子经过一系列生理活动最终达到具有受精能力的状态,线粒体是维持精子生命活动的直接能量来源[16-19]。线粒体膜电位下降是精子细胞状态改变的主要标志之一。吕松洁等[20]发现,经冷冻后山羊精子内线粒体膜电位降低会导致精子解冻后活力下降。本研究发现,经高压均质后鸡蛋卵黄能更好保护猪精子,降低冻后线粒体膜电位的改变程度,保护线粒体功能完整性。
对很多哺乳动物精子冷冻研究发现,凋亡精子的比例升高会导致精子受精能力的降低。凋亡现象主要表现为精子运动能力丧失、线粒体膜电位降低、Caspase活化水平提高和DNA氧化损伤等[21-24]。本试验对猪精子冷冻后进行TUNEL检测,发现高压均质处理的鸡蛋卵黄试验组猪精液荧光比例显著低于对照组,表明精子凋亡率下降,DNA完整率增高。虽然冷冻后精子凋亡的具体机制还尚无定论,但有试验表明,线粒体功能受损是精子细胞产生凋亡的重要因素之一[25-27],线粒体功能受损导致无法有效清除精子细胞内多余的自由基;同时线粒体膜电位下降,Caspase级联反应展开,从而致使精子凋亡。
精子细胞发生凋亡时,会将原本无活性的Caspase被激活。Caspase原位荧光染色被用来检测细胞凋亡情况。Brugnon等[28]认为,凋亡精子内Caspase-3、Caspase-8和Caspase-9活性显著升高,与本研究结果类似。本试验中,高压均质的鸡蛋卵黄试验组冷冻后精子内Caspase-3、Caspase-8和Caspase-9活性明显降低,抑制了精子凋亡的发生。

荧光表示具有Caspase活性,活性高的荧光强The fluorescence indicates Caspase activity, high activity show strong fluorescence图4 冷冻后猪精子Caspase 活性(400×)Fig.4 Caspase activity of frozen porcine sperms(400×)
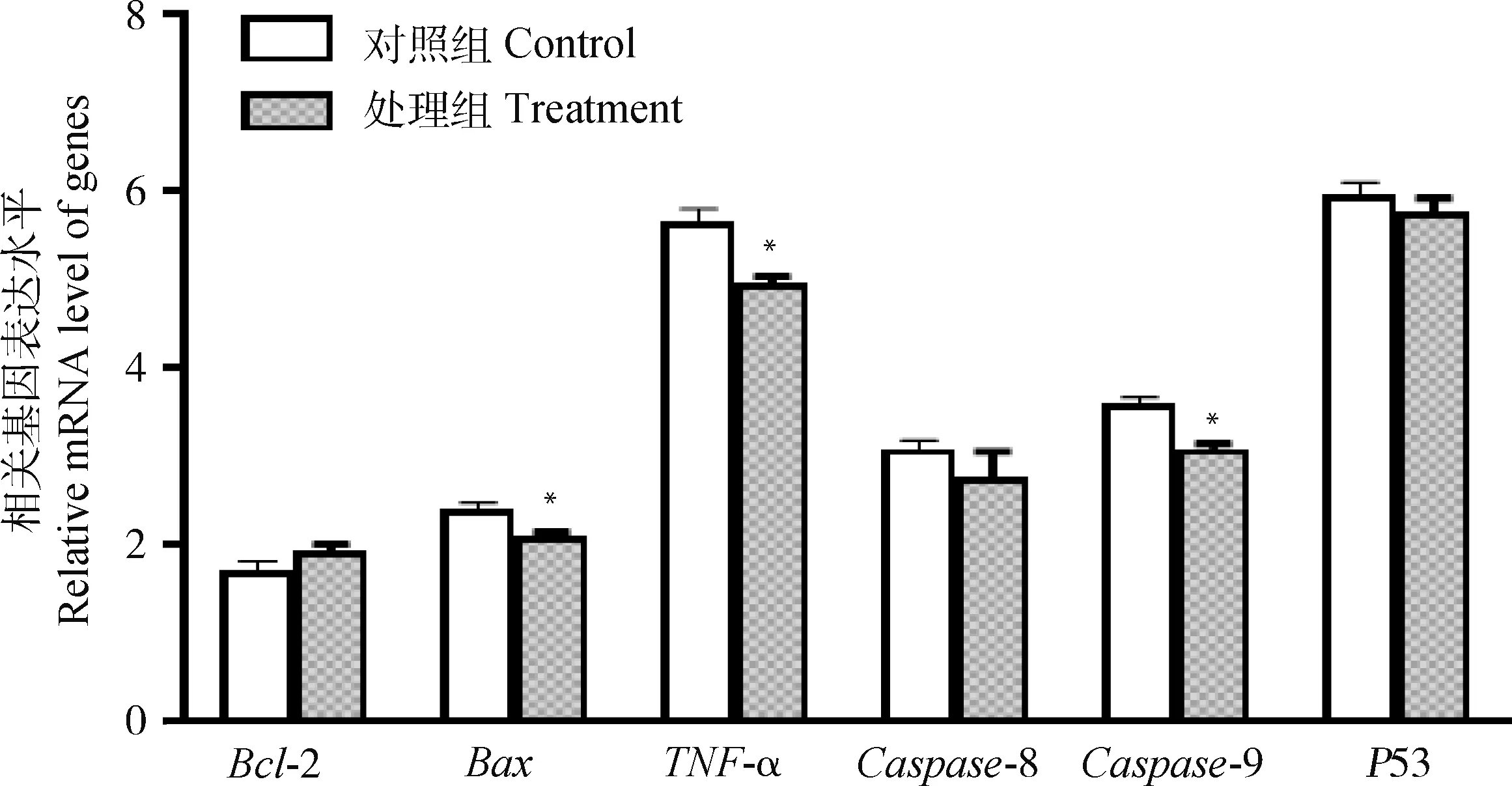
*. P<0.05图5 凋亡相关基因表达结果Fig.5 Apoptosis related gene expression results
本试验中,高压均质的鸡蛋卵黄组相较于对照组,Bax、P53、TNF-α、Caspase-8和Caspase-9水平降低,Bcl-2水平升高。试验结果与Jeremy等[29]的研究结果相似,说明凋亡细胞中凋亡促进基因的增多和凋亡抑制基因的减少,最终会导致细胞发生凋亡。细胞凋亡是细胞自身维持稳定性,由基因控制的细胞主动性死亡的过程[30],Bax、P53、TNF-α、Caspase-8和Caspase-9等为细胞凋亡促进基因,Bcl-2为细胞凋亡抑制基因。都在细胞凋亡过程中发挥重要作用[31-33]。P53作为细胞中重要调控因子,具有控制细胞生长、凋亡和DNA修复的作用[34]。TNF-α能促进坏死细胞发生凋亡,是死亡受体重要因子[35]。Bax能拮抗Bcl-2的细胞凋亡抑制作用,寡聚体的Bax还能刺激细胞色素C释放和Caspase蛋白酶家族的级联激活,最终导致细胞凋亡[36-37]。Caspase级联激活作为细胞凋亡的中心环节,上游Caspase-9经细胞色素C激活并放大下游Caspase-3和Caspase-8表达导致细胞凋亡的发生[33, 38-39]。本研究中,试验组线粒体膜电位降低,且细胞Caspase水平下降,细胞凋亡水平较对照组有所降低,预示了精子线粒体凋亡的发生同时也促进了精子细胞的凋亡过程。本试验中,试验组精子细胞内Bax、P53、TNF-α、Caspase-8和Caspase-9基因表达量明显降低,Bcl-2基因表达量上升,这可能是精子细胞发生凋亡时,多种凋亡途径均参与介导,多条通路联合扩大了精子细胞凋亡信号的传递。证明经高压均质后鸡蛋卵黄能有效保护精子细胞,减少冷冻后精子细胞发生凋亡的机率,提高冻后精子质量。至于能否通过添加凋亡通路抑制剂来减少冻后精子发生凋亡的水平仍有待进一步研究。
4 结 论
综上所述,经高压均质后的鸡蛋卵黄能提高冷冻后精子活力、DNA完整性;降低线粒体膜电位和凋亡水平,同时降低精子细胞内Caspase活性和促凋亡相关基因mRNA表达水平。
