GRAP2在肺腺癌中的表达及其临床意义
2021-08-23郑州大学第一附属医院生物细胞治疗中心郑州450052
屈 姣 张 毅 (郑州大学第一附属医院生物细胞治疗中心,郑州450052)
肺癌是全球发病率及死亡率最高的肿瘤之一[1-2]。因缺乏有效诊断标志物,肺癌早期诊断率低,发现时多数已处于晚期,导致其治疗效果差,预后不良,死亡率较高[3]。根据组织学特点可将肺癌分为非小细胞肺癌和小细胞肺癌,85%约为非小细胞肺癌,其中肺腺癌(lung adenocarcinoma,LUAD)是非小细胞肺癌的主要组织学类型[4]。由于多数肺癌发现时即晚期,急需从蛋白、分子等水平深入探究肺癌的发生、发展机制,为肺癌患者的早期诊断及预后评估寻找高敏感指标,进一步为肺癌防治提供新策略。
目前非小细胞肺癌的治疗方式主要包括手术、放疗、化疗、靶向治疗等,但5 年生存率较低。近年肿瘤免疫治疗已广泛应用于肿瘤治疗领域,但如何寻找更加精准有效的生物标志物筛选肿瘤免疫治疗的获益人群是急需突破的瓶颈[5-7]。
GRAP2(Gads/Mona/GrpL/Grf40)是白细胞激活信号通路上重要的一类衔接蛋白[8]。GRAP2 在T细胞中的功能备受关注,为活化衔接因子(linker for activation of T cells,LAT)和含 76 kD SH2 结构域的白细胞蛋白(SH2-domain-containing leukocyte pro‑tein of 76 kD,SLP-76)提供了物理和功能连接[9]。连接 T 细胞受体(T cell receptor,TCR)后,GRAP2 的SH2 结构域与酪氨酸磷酸化的LAT 结合,其羧基端SH3 结构域组成性结合 SLP-76。LAT、GRAP2 和SLP-76 形成异源三聚体复合物介导TCR 信号转导,从而将膜近端信号与下游信号通路耦合,对T 细胞中钙离子信号调节具有重要作用,对介导T 细胞活化起重要作用[10-11]。
TCGA 数据库已广泛应用于癌症发生发展机制探究,包括肺癌研究[12]。本研究采用TCGA 数据库分析GRAP2 基因在LUAD 中的表达及其临床意义,并采用GEO 数据库及临床组织标本验证确定GRAP2 可作为LUAD 早期诊断并预测患者预后的潜在临床指标,同时为筛选免疫治疗潜在获益人群提供新思路。
1 资料与方法
1.1 资料
1.1.1 数据资料收集 采用UCSC Xena 数据库(http:/ /xena. ucsc. edu/)下 载 TCGA 数 据 库 中LUAD 组织RNA 表达数据及其相应的患者临床信息。纳入标准为具有完整的RNA 表达数据和临床参数信息。临床信息包括生存期、年龄、性别、T 期、N 期、M 期和肿瘤分期。通过在线分析GEPIA 数据库(http:/ /gepia. cancer-pku. cn/)合并TCGA 数据集和GTEx 数据集增加正常肺组织组标本数进一步比较LUAD 组织与正常组织GRAP2 表达。GEO 数据库(https:/ /www. ncbi. nlm. nih. gov/gds/)获得LUAD 表达谱芯片(GSE75037),包括 83 个LUAD 组织和83 个癌旁正常组织。采用TIMER 数据库(https:/ /cistrome. shinyapps. io/timer/)分析GRAP2表达与免疫浸润细胞相关性,包括B 细胞、CD4+T 细胞、CD8+T 细胞、嗜中性粒细胞、巨噬细胞和树突状细胞。单样本基因集富集分析(single sample GSEA,ssGSEA)采用R 软件“GSVA”包对LUAD FP‑KM 数据进行处理,得到各样品中28 种免疫细胞类型评分。
1.1.2 临床组织标本收集 收集郑州大学第一附属医院标本库中2014 年1 月至2015 年12 月于我院手术切除的53 例LUAD 组织样本。纳入标准:①病理学确认为LUAD;②手术前未经系统放化疗治疗;③临床参数信息完整,包括:性别、年龄及分期等,并有完备的随访信息以便统计患者生存期。本研究经我院伦理委员会批准(编号:2019-KY-256),参与者知情同意。
1.1.3 主要试剂 Trizol 试剂(Invitroge 公司);反转录试剂(TaKaRa 公司);SYBR Green(Bioconnect Services公司)。
1.2 方法
1.2.1 组织RNA 提取 根据LUAD 纳入标准筛选入组标本,取我院冻存于−80℃标本库的LUAD 标本,解冻,剪成50~100 mg 组织块,置于2 ml 无酶管中,每管加入适量Trizol 试剂和无酶钢珠,研磨,高速离心,取上层匀浆置于新的离心管,加入500µl氯仿,盖紧离心管盖上下颠倒混匀10 次,充分混合乳化,冰上静置5 min,4℃、12 000 r/min 离心15 min,取上层无色透明水相转移至新的无酶离心管中,加入 500 µl 异丙醇,颠倒混匀,冰上静置 5~10 min,4℃、12 000 r/min 离心10 min,弃上清,缓慢加入预冷75%乙醇(无酶水与无水乙醇按相应比例配制),4℃、12 000 r/min 离心5 min,清洗,弃上清,将离心管倒置,控干残留乙醇,加入适量无酶水溶解RNA,采用Nanodrop仪检测RNA纯度及浓度。
1.2.2 反转录 反转录全程冰上操作。配制基因组DNA 去除反应体系:5×gDNA Eraser Buffer 2 µl,gDNA 1 µl,RNA 1 µg,无酶水补齐体系至10 µl,混匀,42℃反应2 min。配制反转录体系:PrimeScript RT Enzyme Mix 1 µl,PrimeScrip buffer(5×)4 µl,RT Prime Mix 1 µl,无酶水4 µl,共计10 µl,加至基因组DNA 去除反应后的体系,采用普通PCR 仪进行反转录:37℃15 min,85℃5 s,反应结束后得到组织标本cDNA。
1.2.3 qRT-PCR 检测 SYBR Green 10 µl,上游引物(10 µmol/L)0.8µl,下游引物(10µmol/L)0.8 µl,cDNA 2 µl,无酶水 6.4 µl。引物由生工生物工程(上海)股份有限公司合成,序列见表1。采用Agi‑lent Mx3005P 仪进行 PCR 反应,95℃ 60 s;95℃ 15 s;60℃ 15 s;72℃ 45 s,带溶解曲线,重复 39 个循环。以GAPDH为内参,2−ΔΔCt法计算目的基因mRNA 水平。
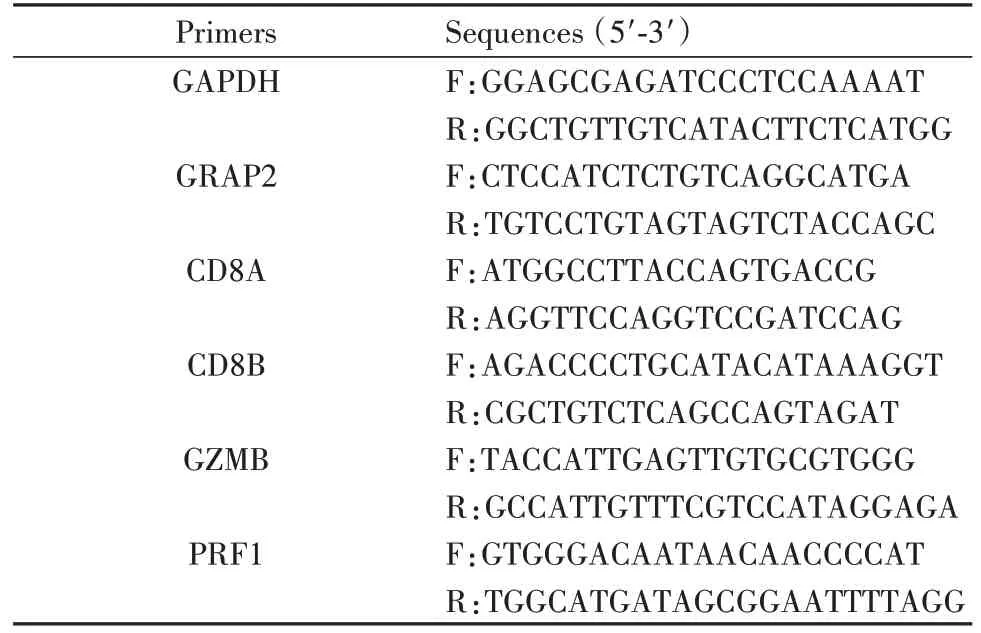
表1 qRT-PCR引物序列Tab.1 Primer sequences for qRT-PCR
1.3 统计学分析 采用IBM SPSS25.0 软件进行统计学分析,符合正态分布的计量资料以表示,均数比较分别采用独立样本t检验和配对样本t检验。MedCal 软件分析并绘制 ROC 曲线,Prism 8 软件分析并绘制 Kaplan-Meier plotter 图,log.rank 检验分析GRAP2 表达与生存期的关系。Pearson 相关分析评估基因表达相关性。采用Cox 多因素回归,以“输入”法分析GRAP2 表达及临床参数对生存期的影响。P<0.05为差异有统计学意义。
2 结果
2.1 TCGA 数据库中LUAD 组织 GRAP2 表达及生存分析 TCGA 数据库显示,LUAD 组织中GRAP2表达水平低于正常组织(图1A)。采用GEPIA 数据库整合TCGA 和GTEX 数据库增加正常组织标本数,对483例LUAD 样本及347例正常组织样本进行分析,结果显示,GRAP2 在LUAD 组织中呈低表达(图1B)。ROC 曲线结果显示,GRAP2 可作为LUAD诊断的潜在临床指标(图1C)。生存分析结果显示,GRAP2 低表达的LUAD 患者生存期较短,提示GRAP2可能是评估LUAD预后的潜在标志物(图1D)。
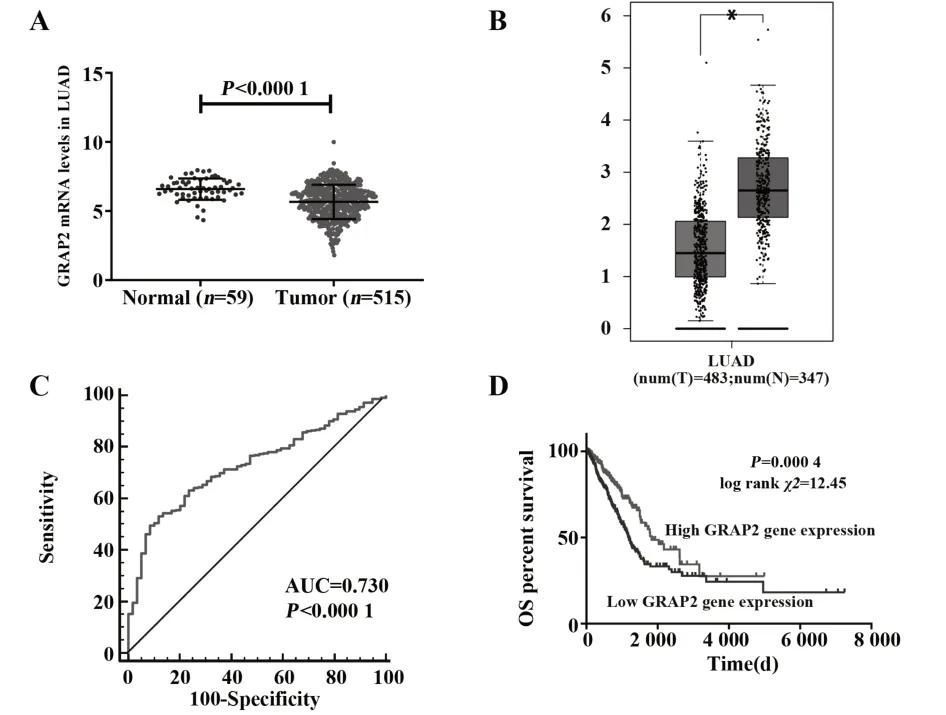
图1 LUAD组织中GRAP2表达及生存分析Fig.1 Expression of GRAP2 and survival analysis in LUAD tissues
2.2 LUAD 中GRAP2 表达与临床病理特征的关系 采用TCGA 数据库中LUAD 患者临床数据分析GRAP2与不同临床病理特征间的关系,结果如图2、表 2 显示,肿瘤浸润 T3~T4 期 GRAP2 mRNA 表达低于T1~T2 期(P=0.03),发生淋巴结转移期GRAP2mRNA表达低于无转移期(P=0.01),病理分期Ⅲ~Ⅳ期GRAP2 mRNA表达低于Ⅰ~Ⅱ期患者(P=0.000 6)。ROC曲线表明,GRAP2分别作为诊断LUAD肿瘤浸润(AUC=0.589,P=0.021 9)、淋 巴 结 转 移(AUC=0.579,P=0.004 0)和临床病理分期(AUC=0.622,P<0.000 1)具有优越性。进一步分析发现,肿瘤浸润T3~T4 期预后差于T1~T2 期(P<0.000 1),发生淋巴结转移预后差于无转移患者(P<0.000 1),病理分期Ⅲ~Ⅳ期预后差于Ⅰ~Ⅱ期患者(P<0.000 1)。多因素Cox回归分析年龄、远处转移、淋巴结转移、肿瘤大小、病理分期和GRAP2 表达水平对LUAD 预后的影响,结果显示,淋巴结转移(P<0.000 1)、GRAP2表达水平(P=0.017 0)对LUAD预后有明显影响。
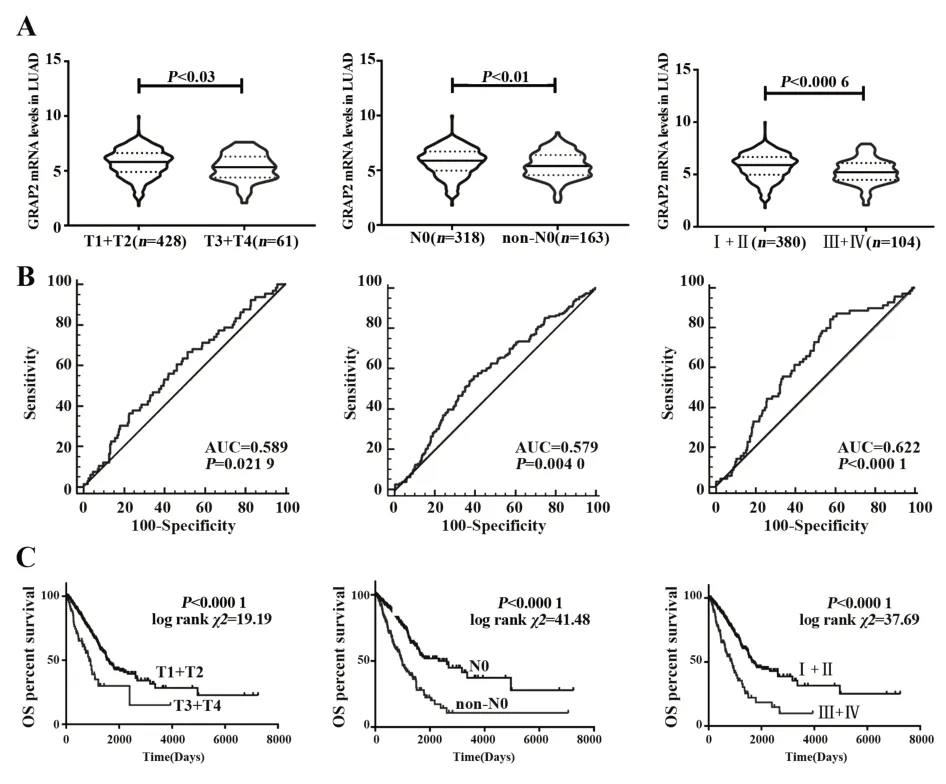
图2 GRAP2表达与LUAD患者临床病理特征的关系Fig.2 Relationship between GRAP2 expression and clini⁃copathological characteristics of patients with LUAD

表2 GRAP2 表达、各临床参数与OS的多因素Cox回归分析Tab.2 Cox regression analysis between GRAP2 expression,various clinical parameters and OS
2.3 GRAP2 与免疫细胞相关性分析 TIMER 数据库分析GRAP2基因与免疫浸润细胞的相关性,结果如图 3所示,GRAP2与 B 细胞、CD4+T 细胞、CD8+T 细胞、嗜中性粒细胞、巨噬细胞、树突状细胞和CD8+T细胞的功能性分子相关基因GZMB、PRF1 呈正相关。采用ssGSEA 处理LUAD 的FPKM 数据,如表3所示,得到各样品中28 种免疫细胞类型评分,将其与得到的免疫细胞进行相关性分析,进一步验证了GRAP2 与包括CD8+T 细胞在内的各类免疫细胞呈正相关。
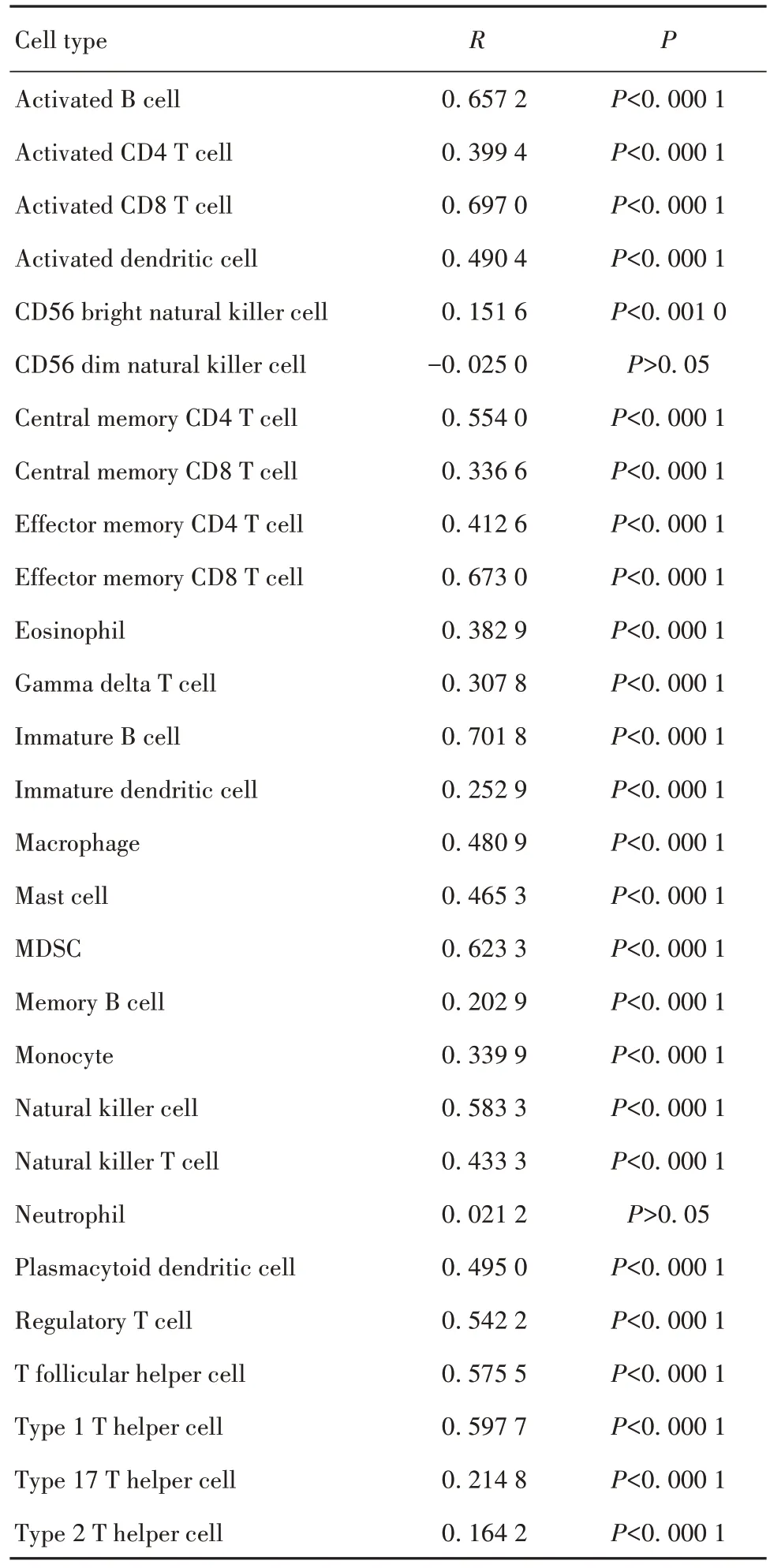
表3 GRAP2 表达与28 种免疫细胞的相关性分析(ssG⁃SEA)Tab.3 Relationship analysis between GRAP2 expression and 28 immune cells(ssGSEA)
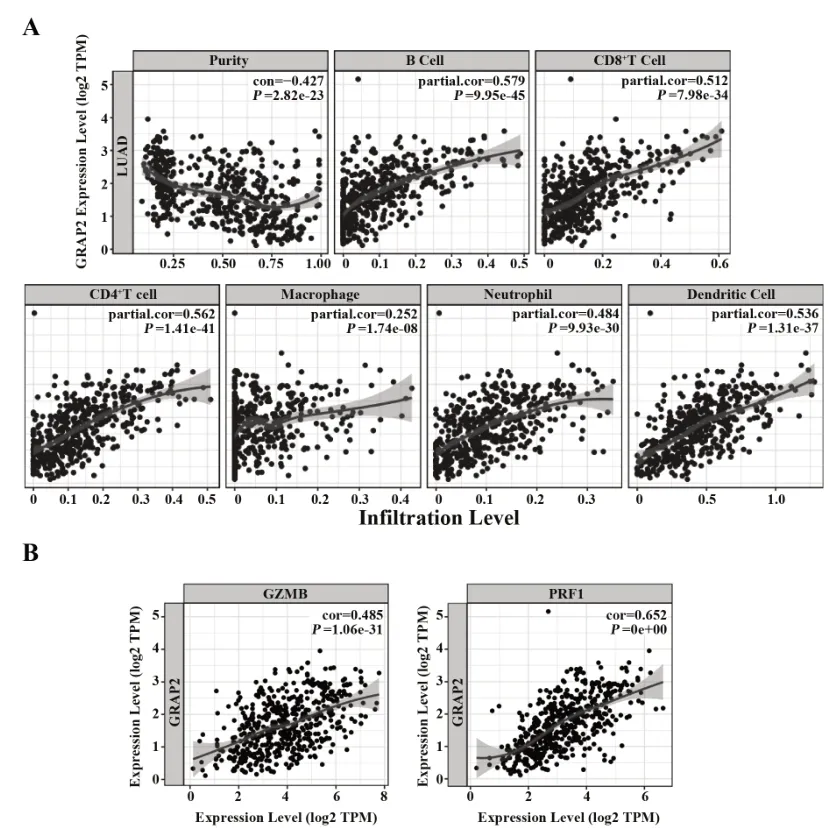
图3 TIMER 数据库分析GRAP2 与免疫细胞及CD8+T 细胞功能性分子相关性Fig.3 Relationship between GRAP2 and immune cells,functional related genes of CD8+T cells by TIMER database
2.4 GEO 数 据库 GSE75037 验 证 GRAP2 在 LUAD中呈低表达 通过GEO 数据库(https:/ /www.ncbi.nlm. nih. gov/gds/) 获 取 LUAD 表 达 谱 芯 片(GSE75037),包括 83 个 LUAD 组织和 83 个癌旁正常组织,与癌旁正常组织相比,GRAP2 在LUAD 组织呈低表达(图4)。
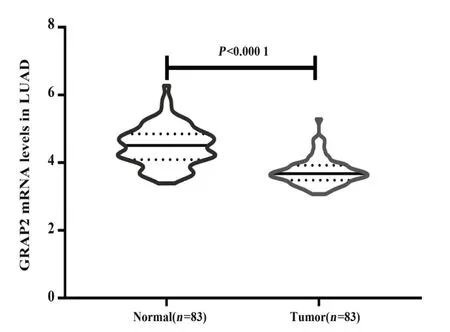
图4 GRAP2在GEO数据集GSE75037中的表达Fig.4 Expression of GRAP2 in GEO database GSE75037
2.5 GRAP2 在LUAD 临床组织标本中的表达及其与CD8+T细胞的相关性 收集我院接受手术切除治疗的53例LUAD组织样本,qRT-PCR检测GRAP2在LUAD 组织及其相应正常组织中的表达,进一步验证 LUAD 组织中 GRAP2 与 CD8+T 细胞的相关性,结果显示,与癌旁组织相比,GRAP2 在LUAD 组织中呈低表达(图5A)。LUAD 组织中GRAP2 高表达组较低表达组预后更好(图5B),且GRAP2与CD8+T细胞(图5C、D)及其功能相关分子GZMB、PFR1 呈正相关(图5E、F)。
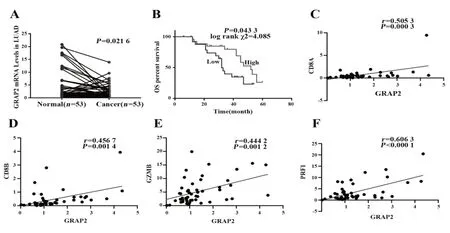
图5 临床组织标本中GRAP2 表达及其与LUAD 患者预后、CD8+T细胞的相关性Fig.5 Expression of GRAP2 and its relationship with prognosis and CD8+T cells of LUAD patients
3 讨论
LUAD 因其早期发现困难、预后不良而成为临床死亡率较高的肿瘤之一[3]。随着高通量测序技术发展,关于可从基因水平上诊断早期癌症、判断预后的生物标志物的报道越来越多,为LUAD 临床治疗提供了参考。GRAP2 作为衔接蛋白,通过连接TCR 信号通路上下游的LAT 和SLP-76 形成异源三聚体复合物,对 T 细胞活化起桥梁作用[10-12]。GRAP2 在95%急性T 淋巴细胞白血病中表达,可作为其诊断的生物标志物[13]。但GRAP2 在肿瘤发生发展中的报道较少。本研究采用TCGA 数据库确定GRAP2可作为LUAD 早期诊断及预测LUAD 患者预后的潜在临床指标,同时为筛选免疫治疗潜在获益人群提供新思路,对LUAD 的早期诊断、预后判断和免疫治疗具有重要意义。
本研究通过TCGA 数据库分析发现,GRAP2 在LUAD 组织中的表达明显低于正常组织,ROC 曲线显示GRAP2 可作为诊断LUAD 的潜在临床指标,并通过GEO 数据集GSE75037 和临床肺腺癌标本对TCGA数据库的分析结果进行验证,分别将TCGA数据库来源的LUAD 患者标本和收集的我院临床LUAD 患者标本分为基因高表达及低表达组,Ka‑plan-Meier生存分析表明,GRAP2表达影响LUAD患者OS,GRAP2表达越低,患者OS越短。进一步采用TCGA 数据库中LUAD 患者临床病理资料,通过GRAP2 基因在不同临床阶段的表达及ROC 曲线分析发现,GRAP2 表达水平对肿瘤大小、淋巴结远端转移和病理分期均有影响,同时可作为诊断LUAD恶性程度的潜在指标。多因素Cox 回归分析发现,LUAD 患者中高表达GRAP2 mRNA 组死亡风险约为低表达组的0.6 倍,提示GRAP2 可作为LUAD 临床预后的独立预测因子。GRAP2 基因表达水平与多种免疫细胞浸润水平相关[14-15]。本研究采用TIM‑ER 数据库分析得到 GRAP2 mRNA 与包括 CD8+T 细胞在内的各类免疫细胞呈正相关,也与CD8+T 细胞的功能性分子相关基因GZMB、PRF1 呈显著正相关。进一步采用ssGSEA 分析得到GRAP2 mRNA 与包括CD8+T细胞在内的各类免疫细胞呈正相关。基因水平上往往以 CD8A 与 CD8B 表示 CD8+T 细胞[15]。本研究同时采用qRT-PCR法在临床LUAD标本中检测CD8A、CD8B、GZMB、PRF1 及GRAP2 5 种基因表达水平,并探讨其相关性,结果显示,GRAP2 与CD8+T 细胞(CD8A、CD8B)及其功能性分子GZMB、PRF1 呈显著正相关,表明高表达GRAP2 基因的LUAD 组织中,其肿瘤免疫微环境中富集各种包括CD8+T 细胞在内的免疫细胞,且CD8+T 细胞处于功能激活状态可能提示此为“热肿瘤”,为选择肿瘤免疫治疗人群提供参考[16-17]。
综上所述,GRAP2 与LUAD 发生发展密切相关,本研究通过TCGA 数据库、GEO 数据库、临床标本3个维度确定GRAP2可作为LUAD早期诊断并预测LUAD 患者预后的潜在临床指标,同时也为筛选免疫治疗潜在获益人群提供新思路。