根治性近端胃切除加双通道吻合手术治疗贲门胃底恶性肿瘤的临床效果观察
2021-08-23石鑫鑫余昌俊通讯作者
石鑫鑫,余昌俊(通讯作者)
(安徽医科大学第一附属医院高新院区胃肠外科 安徽 合肥 340104)
胃癌是临床高发性恶性肿瘤,在全球范围内,处于恶性肿瘤发病率第5 位,病死率第3 位[1]。我国胃癌普遍高发,发病率以及病死率均占世界范围50%左右,且患者预后较差,5 年生存率仅有约36%,远远低于欧美日等发达国家[2]。因此早发现与合理的治疗,显得格外重要[3]。其中,手术切除作为胃癌治疗的主要手段,除了切除范围的选择,消化道重建的方式也会直接影响患者生存质量。合理的消化道重建应该在不增加术后并发症的基础上,尽可能保留消化系统对于食物储存、消化吸收的功能,避免患者出现术后营养代谢障碍,保障患者生活质量。因此,我们通过对接受不同手术消化道重建方式的临床病例进行分析,探究根治性近端胃切除加双通道吻合在胃癌手术中的应用价值,为临床胃癌手术术式的选择提供有价值的参考意义。由于消化道重建手术会破坏患者消化道的连续性和完整性,损失部分胃的生理功能,因此消化道重建会在一定程度上缓解胃癌术后的严重消化功能紊乱[4]。消化道重建应在满足储存、运输、消化吸收食物等生理功能的基础上,减少手术对患者的损伤以减少术后并发症。从而保障患者的生活质量。因此,消化道重建方式的选择至关重要[5-8]。我们对根治性近端胃切除加双通道吻合术在胃癌手术中的应用价值进行分析,有望为临床胃癌手术术式的选择提供有价值的参考意义,报道如下。
1.资料与方法
1.1 一般资料
选取2018 年1 月—2019 年1 月安徽医科大学第一附属医院收治的90 例行手术的贲门胃底恶性肿瘤患者为研究对象,根据消化道重建方式分为:根治性近端胃切除加残胃空肠双通道吻合(双通道组)30 例、根治性全胃切除+Roux-en-Y 吻合(全胃组)30 例、根治性近端胃切除后食管残胃吻合(近端胃组)30 例。双通道组男18 例,女12 例,年龄45 ~61 岁;TNM 分期:Ⅰ期12 例、Ⅱ期18 例。全胃组男19 例,女11 例,年龄44 ~60 岁;TNM 分期:Ⅰ期13 例、Ⅱ期17 例。近端胃组男18 例,女12 例,年龄45 ~62 岁;TNM 分期:Ⅰ期12 例、Ⅱ期18 例。三组一般资料比较差异无统计学意义(P>0.05),具有可比性。患者及家属知情并签署知情同意书。
纳入标准:符合《胃癌治疗指南》中胃癌的诊断标准;无其他恶性肿瘤疾病史,且首次进行胃肠道手术;肿瘤直径在4 cm 以下,经检查诊断确定无浆膜受侵犯及淋巴结转移。
排除标准:伴有代谢性消耗性疾病;临床资料不全;已参与其他临床研究。
1.2 方式
双通道组:在胃角水平通过1 个线性吻合器将胃断开,彻底切除包含肿瘤在内的近端大部分胃,空肠上段离断,将远端空肠分别与食管、远端残胃、近端空肠吻合。全胃组:全胃切除+Roux-en-Y 吻合,具体为全胃切除术后先缝闭十二指肠残端,距屈氏韧带远端20 cm 处离断空肠,将远端空肠与食管断端行侧端吻合,距空肠食管吻合口远端约40 cm 处行近端空肠与远端空肠侧侧吻合,闭合器闭合空肠残端。近端胃组:距肿瘤5 cm 以上选取合适位置通过1 个线性闭合器将为断开,彻底切除包含肿瘤在内的近端大部分胃。将远端胃与食管吻合。
1.3 观察指标
(1)记录三组术前营养指标(血清TP、ALB、PA、胃泌素、HGB、内因子水平);(2)记录三组术后营养指标(十二个月血清TP、ALB、PA、胃泌素、HGB 水平);(3)记录三组术后反流性食管炎(有无反酸、烧心、恶心等症状及上消化道碘水造影)、术后吻合口出血、术后吻合口狭窄发生率。
1.4 统计学方法
采用SPSS 19.0 统计学软件,符合正态分布的计量资料以均数±标准差(x-± s)表示,两组间比较采用t检验;计数资料使用频数、百分数(%)表示,采用χ2检验;计量资料呈偏态分布,采用中位数和四分位数[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验。以P<0.05 为差异有统计学意义。
2.结果
2.1 手术时间
双通道组、全胃组和近端胃组手术时间分别为(127.2±35.6)m i n、(121.4±45.7)m i n、(112.6±52.3)min。
2.2 术前术后营养状况
术后12 个月后双通道组患者血清总蛋白(TP)、白蛋白(ALB)、前白蛋白(PA)、胃泌素(GS)、血红蛋白(HGB)优于全胃Roux-en-Y 组,差异有统计学意义(P<0.05),见表1、2。术后12 个月双通道组患者血清总蛋白(TP)、前白蛋白(PA)、血红蛋白(HGB)较近端胃组差异有统计学意义(P<0.05),见表1、2。
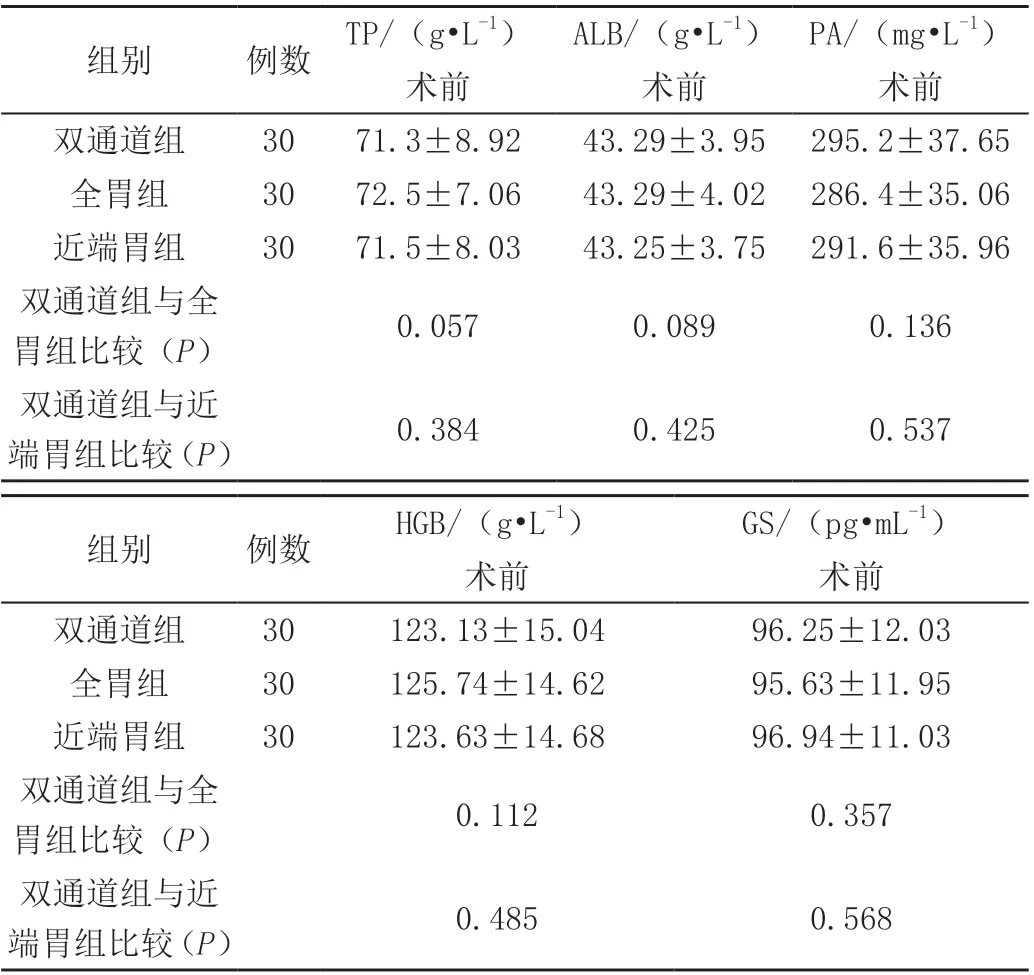
表1 三组患者术前、术后血清总蛋白(TP)、白蛋白(ALB)、前白蛋白(PA)、胃泌素(GS)、血红蛋白(HGB)的情况(x- ± s)

表2 三组患者术后血清总蛋白(TP)、白蛋白(ALB)、前白蛋白(PA)、胃泌素(GS)、血红蛋白(HGB)的比较(x- ± s)
2.3 术后并发症的发生情况
观察术后反流性食管炎(有无反酸、烧心、恶心等症状及上消化道碘水造影)、术后仅双通道组反流性食管炎发生概率,低于近端胃组,差异有统计学意义(P<0.05)。而双通道组与全胃组反流性食管炎发生概率差异无统计学意义(P>0.05)。三组术后吻合口狭窄与术后吻合口出血发生率相互间差异无统计学意义(P>0.05),见表3。

表3 术后并发症的比较[n(%)]
3.讨论
近年来,有很多关于胃上部恶性肿瘤的研究,但对于手术治疗中不同消化道重建方式的治疗效果并无过多展开[9-10]。对于胃上部恶性肿瘤,目前临床上关于手术方式有两种争论:一种是强调根治,要求行全胃切除,目前主要的消化道重建方式就是根治性全胃切除+Rouxen-Y 吻合,另外一种强调在根治的同时保留部分胃功能,行部分胃切除。但是由于胃上部癌早期无明显症状,患者就诊时肿瘤浸润胃壁范围较大,行近端胃大部切除难以达到根治的目的[11]。基于以上原因,临床上更加倾向于全胃切除+Roux-en-Y 吻合治疗胃上部癌,虽然达到根治肿瘤且减少反流的目的,但是也产生了新的问题:(1)手术范围扩大化。(2)失去了十二指肠径路,导致营养吸收不良。患者丧失全部胃功能,且手术范围扩大很多,损伤大。全胃切除术虽根治的范围已足够大,创伤也大,但其生存率并没有明显提高,进展期胃癌的预后仍然很差,即使根治性切除5 年生存率在西方国家不足30%,总体生存率仅为5%~15%[12-13],国内仍徘徊在30%左右[14]。随着近年来早期胃癌发现率的提高,对于早期的贲门癌行全胃切除术也显得手术范围过大。本研究对比根治性近端胃切除加双通道吻合和根治性全胃切除发现,两组在手术时间、吻合口狭窄、吻合口出血发生率及术前营养状况差异无统计学意义(P>0.05),两组在术后(术后十二个月)双通道组和全胃组在血清总蛋白、白蛋白、前白蛋白、胃泌素、血红蛋白方面比较,差异均有统计学意义(P<0.05)。说明根治性近端胃切除加双通道吻合在术后营养状态较好且并未增加术后并发症的发生率。
根治性近端胃切除加食管残胃吻合,操作简单,保留了十二指肠径路,提高患者营养吸收,但失去贲门功能后患者术后反流、呕吐等并发症较严重。严重影响患者的生活质量。在此背景下,近端胃切除术后双通道消化道重建方法应运而生。该方法在基于传统的食管空肠吻合术的前提下,还需要胃空肠吻合以构建十二指肠路线。根治性近端胃切除加双通道吻合术式的优点:本手术方式兼有另外两种术式的优点。(1)清扫、切除范围合理,术中损伤较小,术后并发症发生率降低[15]。(2)保留了十二指肠径路,患者术后进食后部分食物通过十二指肠,可有效地刺激胃窦和十二指肠的分泌,帮助消化吸收。(3)由于食管与残胃间有35 cm长的顺行蠕动空肠,胃液和胆汁不易反流到食管因此可显著降低反流性食管炎的发生,优于食管残胃吻合术式。在本研究中对比根治性近端胃切除加双通道吻合和根治性近端胃切除加食道残胃吻合发现,两组在术后(术后十二个月)血清总蛋白、白蛋白、前白蛋白、胃泌素、血红蛋白方面比较差异无统计学意义(P>0.05)。两组在术后反流性食管炎发生率分别为3.33%、30%,差异有统计学意义(P<0.05)。根治性近端胃切除加双通道吻合大大减少了术后反流性食管炎发生率的且没有降低患者的术后营养状态。
综上所述,根治性近端胃切除加残胃空肠双通道术可有效提高患者术后营养状况的同时减少术后反流性食管炎发生概率。改善了患者的生活质量也提高了患者的营养状况,且手术时间未见明显延长,值得在临床应用。
