禾本科植物落粒机理研究进展
2021-08-21谢文刚万依阳张宗瑜张俊超
谢文刚,万依阳,张宗瑜,张俊超
(1.兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州730020;2.西南民族大学青藏高原研究院,四川 成都610041)
植物落粒现象在自然界中普遍存在,这是植物在物种进化和适应环境过程中形成的一种重要生存策略,成熟的植物种子落粒有利于物种的繁衍和扩散[1]。但在以种子生产为目的的农业活动中,落粒性是其关键限制因素,易落粒和难落粒的植物都不适宜种子生产。
禾本科植物种子落粒的过程主要包括4个步骤:种子与种柄结合部位的细胞分化形成离区;离区细胞收到脱落信号并做出反应;离区内部脱落过程被激活;离层降解诱发落粒[1]。研究表明,落粒性状是由全基因组分布的多基因位点控制的复杂数量性状,受多种环境因素和遗传因素的影响[2-5],外界因素主要包括干旱、光周期变化、紫外光照、臭氧浓度、极端温度、创伤和病原体入侵等,植物自身的因素主要包括衰老、花序的结构特征、植物激素、水解酶、离区结构[6-7]。其中,离区的形成、发育和降解是植物发生落粒的直接原因,乙烯、脱落酸、生长素等植物激素的浓度变化可产生促进或抑制脱落的信号,纤维素酶、果胶酶和多聚半乳糖醛酸酶等细胞壁水解酶的活性变化可引起脱落区细胞的分离,这些过程的发生都受基因表达的调控[8-10]。
不同禾本科植物落粒性存在较大差异,同一物种的不同种质间也存在落粒差异性。这种差异受到种质的驯化时间、栽培技术及气候环境等多方面因素影响[11-12]。目前,有关水稻(Oryza sativa)、小麦(Triticum aestivum)和大麦(Hordeum vulgare)等作物落粒机理的研究报道较多,相关研究多集中在离层解剖结构、遗传图谱构建及落粒相关的数量性状位点或关键基因定位等方面[13-15]。而禾本科牧草落粒的相关研究较少,大多为某些性状的田间观察与评价。本研究针对禾本科植物落粒机制及分子机理研究最新进展进行综述,以期为禾本科牧草落粒基因挖掘和功能解析等分子生物学研究提供参考,提高草类植物育种水平,推进其育种进程。
1 落粒的形态和解剖学基础
禾本科植物落粒与其农艺性状具有一定相关性。研究表明,老芒麦(Elymussibiricus)的旗叶宽、倒二叶宽及茎节数与种子落粒存在显著负相关关系[12]。垂穗披碱草(E.nutans)的穗长和茎粗与种子落粒呈显著负相关[16]。青海扁茎早熟禾(Poa pratensis var.anceps)的种子干重和种苗芽长与其落粒性呈极显著正相关[17]。羊草(Leymuschinensis)的颖果宽度和种子落粒率也呈正相关关系[11]。
此外,禾本科植物落粒还与花部形态特征有关,且不同植物具有不同减缓种子落粒的机制。如缘毛雀麦(Bromus ciliatus)具有弹性的花序轴和柔软的小穗轴,冰草(Agropyron cristatum)具有排列紧凑的小穗和坚硬的内外颖片,蒙古冰草(A.mongolicum)具有坚韧和较强硬度的颖片[18],低落粒的虉草(Phalaris arundinacea)具有完整的护颖结构[19],抗落粒小麦具有呈闭锁状态的颖片结构[20],这些形态学特征都有助于减少其落粒性。野生型的小麦穗子为开裂型,这种结构有助于小穗在成熟期脱落,而驯化的小麦穗子为非开裂型,因而不会发生小穗的自然脱落[21]。小麦和大麦具有花序轴脆性特征,与野生近缘种相比,小麦栽培种的花序轴较柔软,而大麦栽培种在驯化过程中丢失了花序轴的脆性性状,所以造成其落粒性的差异[22-23]。
离区由叶柄或种柄基部横向分裂形成的形态小、细胞质稠密、淀粉粒较多的一到数层细胞群构成,其形成、发育和降解是植物发生落粒的直接原因[24]。禾本科植物花序的离区通常有两个,分别被称为第一离区和第二离区,前者位于颖片底端的小穗轴,后者位于小花末端与小花梗顶部之间[25]。多个禾本科植物中都存在两个离区结构。然而,不同植物种子在两个离区发生落粒的情况有所不同,如扁穗雀麦(B.cartharticus)和花黍(Panicum coloratum)的落粒现象多发生在第一离区,而垂穗披碱草、羊草和老芒麦种子落粒现象主要发生在第二离区[26-29]。与野生植物种相比,栽培作物的离区结构在进化和驯化过程中基本消失。例如,野生二粒小麦(T.dicoccoides)与粗山羊草(Aegilopstauschii)都是小麦的野生近缘种,表现为易落粒特性,其存在明显的离区结构且离区断裂面光滑[29],栽培二粒小麦(T.dicoccum)则表现为不易落粒,未发现其存在明显离区且离区断裂面粗糙,破裂细胞不规则[29]。由于不同物种以及同种植物不同基因型间离层形成和降解的时间不同,致使其落粒性存在差异。多年生黑麦草(Lolium perenne)的离层结构出现在抽穗期前,开花后4至5周离层发生断裂[30]。老芒麦的离层也形成于抽穗期之前,但在抽穗后4周离层就出现断裂[31]。具有自然落粒性的野生水稻在开花期可观察到清晰的离层,处于同一时期的不落粒栽培水稻则未形成离层,杂草稻和野生稻都具有自然落粒性且均有离层结构,它们出现落粒差异的原因主要是杂草稻的离层在开花期已经降解,而野生稻的离层在开花期之后才开始降解[7]。研究人员通过染色等方法发现离层细胞的木质化程度不同也会引起落粒差异化。一些禾本科植物的离层木质化程度增加可降低种子的落粒性,水稻[3]、小麦[32]、老芒麦[33]和大麦[34]的相关研究均证实了这一点。
2 落粒的生理机制
禾本科植物落粒性与种子成熟发育过程中含水量的变化密切相关。研究表明,种子落粒性随着含水量的降低而增强,如扁穗雀麦的种子含水量与落粒率呈极显著负相关[27],青海垂穗披碱草的落粒程度也随着种子含水量的降低而增加[35],羊草在高湿、高温条件下几乎不落粒[11]。
植物激素参与植物许多生长发育过程,在植物落粒过程中起信号传递的作用。乙烯(ethene)、脱落酸(abscisic acid,ABA)和细胞分裂素(cytokinin,CK)促进植物的落粒,而生长素(auxin,IAA)和赤霉素(gibberellin,GA)则会抑制植物落粒的发生[1,8,36-38]。对无芒雀麦(B.inermis)和老芒麦种子发育过程进行研究后发现,生长素和赤霉素在种子发育过程中含量较高,而脱落酸的含量在种子成熟后较高[39-40]。多数情况下,植物发生落粒并非由单一的植物激素引发,而是多种激素共同作用的结果。一些研究认为脱落酸对植物落粒的影响似乎取决于与生长素或乙烯的相互作用,而不是脱落酸的直接作用[41]。脱落酸导致的脱落作用由乙烯介导,当生长素水平降低时,离区细胞对乙烯产生响应[42],脱落酸会减缓生长素的运输,从而促进离区发育,并加速种子落粒[43-44]。与其他植物激素相比,乙烯和生长素在调节植物器官脱落过程中产生的影响更大[45],有研究者提出生长素由远端组织向离区基部的极性运输可使其对乙烯产生延迟或防止脱落敏感反应。相反,如果生长素在离区基部的极性运输被阻断,则植物器官对乙烯的不敏感性消失,从而激活器官脱落[1]。
禾本科植物离区细胞壁的降解主要由细胞壁水解酶活性的增加导致,从而造成植物落粒[42,46-47]。目前研究发现纤维素酶和多聚半乳糖醛酸酶与离区细胞壁的降解密切相关,纤维素酶是第一个被提出可引起离区细胞壁降解的酶[48-49]。该酶主要存在于细胞壁中,在叶片脱落、果实脱落、果实成熟和植物衰老期间发挥重要作用,纤维素酶通过大量转移至脱落区和邻近的维管束组织,引发纤维素微纤丝降解重排,从而增加初生壁孔径,为多聚半乳糖醛酸酶提供通路[50]。在关于抗纤维素酶抗体的研究中发现,注射抗体会显著降低离区的断裂强度,纤维素酶的变化及分布表明其完全参与了种子落粒过程[51]。多聚半乳糖醛酸酶通过把富集在胞间层的多聚半乳糖醛酸果胶黏合层主链降解为半乳糖醛酸低聚物和单体的方式降低果胶间的连接作用,诱导细胞壁降解,并最终导致离层细胞间黏附力的丧失[45]。在许多植物叶片、花和果实脱落前的离区中都能发现多聚半乳糖醛酸酶活性有所提高[52]。此外,种子落粒过程中激素水平的变化与水解酶活性相关。研究表明,乙烯处理后的植物细胞壁水解酶如β-1,4-葡聚糖内切酶和多聚半乳糖醛酸酶的活性增强,而生长素处理后可抑制细胞壁水解酶的活性[8],这可能与离区生长素抑制β-1,4-葡聚糖酶mRNA的积累有关[49]。
3 落粒的分子机理研究
植物落粒性是由主效基因和多个微效基因共同控制的数量性状,许多学者通过对不同遗传群体及其连锁图谱进行研究后鉴定出了多个与种子落粒相关的基因和数量性状基因座(quantitative trait locus,QTL)[3-4,53]。这些基因和QTL位点主要调控禾本科植物形态学特征、解剖学结构以及生理学过程,与种子离区、离层和维管束的发育和降解密切相关。
3.1 调控植物形态学特征的落粒基因相关研究
水稻是世界上重要的粮食作物之一,落粒性是影响其产量的重要因素。野生稻为保持正常繁衍及避免被动物采食而具有自然落粒的特性,而在作物驯化过程中,栽培稻表现出不落粒或低落粒的特性[3]。OsGRF4[54]、Bh4[55]、OsLG1[56]等基因多与水稻穗型、粒型等表型相关,调控水稻形态学特征并影响水稻落粒性。Spr3基因位于水稻4号染色体上,与水稻花序分枝分布有关,Spr3近等基因系的水稻为落粒表型[57],GL4基因与亚洲野生稻的SH 4/SHA 1具有高度同源性,其突变降低了水稻种子落粒率[58]。
小麦Q基因与小麦颖片形状和韧性等性状有关,是小麦重要的落粒驯化基因[59]。Q基因编码一种AP2转录蛋白,与水稻SNB基因编码蛋白具有高度的氨基酸相似性,其等位基因q在野生小麦中表现出小穗细长、难脱粒等特征[60]。细胞遗传学将Q基因定位在小麦5A染色体上,并观测到5A不同倍性染色体表现出小穗表型的剂量效应[61-62]。Muramatsu[63]在等位基因q上也观测到了这种效应,当增加q的剂量效应时,小麦种子落粒性会增加。研究发现等位基因Q和q在序列结构和氨基酸水平等方面都有差异,二者转录模式相似,都发挥一定功能,但Q基因的转录水平比q基因要高。近年来,相关研究表明小麦Q基因是miRNA 172的靶基因之一,Q基因第10个外显子上miR172结合位点的变异在小麦驯化过程中落粒性的改变方面起重要作用[64-66]。Xu等[65]报道了miR172结合位点核苷酸突变体改变了miR172在Q基因上的剪切位点,降低了miR172剪切效率,从而导致Q基因表达积累。Liu等[66]在miR172过表达转基因小麦中发现miR172通过剪切Q基因转录产物来抑制Q基因mRNA的转录过程,从而降低Q基因表达,且过表达植株在表型上比野生型更难脱粒。此外,小麦D基因组中的Tg基因对小麦颖壳硬度具有调控作用,使小麦表现为非自由脱粒特性[67]。
穗轴脆性是影响植物落粒的另一个重要原因,近年来,研究表明小麦和大麦存在着相似的落粒机制。野生大麦的穗轴在成熟后降解造成种子落粒,而栽培种具有坚实的穗轴,种子不易脱落[23]。Katkout等[14]在小麦F2代作图群体中鉴定出基因TaqSH 1-D,该基因被定位到小穗轴脆性QTL的置信区间中,与水稻落粒基因qSH 1是同源基因。Btr1-A基因和TtBtr1基因对小麦小穗轴脆性也具有调控作用,Avni等[68]研究发现所有驯化小麦都携带TtBtr1的功能缺失等位基因,而Btr1-A基因的过表达导致转基因植株的轴脆化,最终导致小穗脱落[69]。大麦种子落粒关键基因Btr1和Btr2是3H染色体上的两个互补基因,它们与小麦的Btr1-A和TtBtr1基因为同源基因,Btr1编码一种膜结合蛋白,它包含两个亲脂性区域,而Btr2编码一种可溶性蛋白[34]。Btr1和Btr2基因的突变改变了大麦小穗轴细胞壁的厚度,野生大麦的初生壁和次生壁变薄,较薄的细胞壁在成熟时塌陷,从而导致整个细胞壁平面分离,而非脆性小穗轴的细胞壁较厚,种子在成熟过程中仍留在花序上,从而实现有效收获[70]。这表明趋同驯化可能在大麦和小麦的非脆轴表型方面发挥了很大作用,不同作物间存在相同的可调节单核苷酸多态性,这与远缘物种驯化和自然选择相关的种子传播结构发育变异有关[71-72]。这些研究为育种学家通过对相同潜在遗传靶点进行平行选择从而培育抗落粒作物提供了参考(表1)。

表1 调控禾本科植物形态学特征的落粒基因信息Table 1 Information of seed shattering genes that regulate morphological characteristics of Gramineae plants
3.2 调控离区发育的落粒基因相关研究
离区的形成、发育和降解是植物发生落粒的直接原因,水稻中已发现多个与种子离区、离层和维管束发育密切相关的基因。Jiang等[59]报道了水稻第7号染色体上一个新的落粒基因SSH 1,该基因是SUPERNUMERARYBRACT(SNB)的等位基因,编码AP2转录因子蛋白,SSH 1通过抑制离区木质素沉淀和维管束的伸长发育来促进种子落粒,ssh1突变体中SNB一个单碱基位点的突变(C/A),即可改变其mRNA的正常转录,影响离区和维管束的发育,从而降低了种子落粒率。Lv等[73]在短舌野生稻中(O.barthii)鉴定出一个ObSH 3基因,该基因编码一种YABBY转录因子蛋白,含有该基因的基因组片段缺失造成了非洲栽培稻(O.glaberrima)离区的不规则发育,从而降低了水稻落粒性。Zheng等[74]在水稻染色体片段代换系Z481的第6号染色体上鉴定出易落粒主效单基因SH 6(t),在SH 6(t)的隐性调控下,离层在成熟期完全降解。OsCPL 1(sh-h)位于水稻7号染色体上,编码一种参与细胞分化的核磷酸酶,OsCPL 1通过抑制与离层发育相关基因的表达来降低水稻落粒率[6,75]。位于4号染色体上的SHAT 1属于AP2家族基因,编码AP2转录因子,是调节离区发育的重要落粒基因[76],shat1在离区的表达使基因产物无功能化,离层发育受阻,从而使水稻产生不落粒表型[77]。Li等[78]鉴定出了一个与落粒相关的不完全显性基因座Sh13,Sh13位于2号染色体上,其中被鉴定的osa-mir172d片段与水稻落粒减少相关。在粳稻与野生稻的遗传背景下,Tsujimura等[79]在粳稻3号染色体上鉴定了一个与落粒相关的qCSS3位点,在qCSS3位点的野生等位基因促进离层的形成,而qCSS3位点的粳稻等位基因可能是减少水稻落粒的原因。qSH 1被定位在水稻基因组的1号染色体上,该主效QTL位点解释了低落粒粳稻和易落粒籼稻68.6%的落粒变异,qSH 1基因位点5'调控区的一个单核苷酸多态性(single nucleotide polymorphism,SNP)变异引起相关mRNA表达中断,影响离区的形成和发育,从而导致粳稻表现出低落粒特性[3]。位于5号染色体上的SH 5与qSH 1高度同源,该基因编码BEL-1型同源框转录因子蛋白,SH 5转录本在多个组织中被检测到,在花梗断裂层的表达水平最为显著[9]。SH 5的表达影响小穗木质素含量,而木质素是构成植物细胞壁的成分之一,并赋予细胞壁机械强度[80]。Yoon等[9]发现抑制SH 5基因的表达使籼稻离层发育受到抑制,其落粒性降低。Li等[81]在籼稻与野生稻杂交的F2群体中定位到3个QTL位点,其中SH 4可以解释69%的落粒表型变异。在种子成熟后期,SH 4被激活并大量表达,由于外显子的单核苷酸突变导致天冬氨酸被取代为赖氨酸,从而阻碍水稻离区发育并降低水稻落粒性。然而并不是所有含有sh4的水稻群体都具有不落粒表型,部分野生稻即使具有sh4基因也表现出高落粒性[82-83]。短舌野生稻的近等基因系与粳稻的杂交种的花梗与小穗之间具有完整的离层,在该杂交种中鉴定出与SH 4基因序列相同的HS1基因,该基因导致杂种表现出落粒表型[84]。qSH 3是被定位在3号染色体上的QTL位点,与离层形成发育相关[85],位于水稻3号染色体上的OsSh1基因与qSH 3位点有部分重叠,突变体OsSH 1中第3个内含子中有超过4 k B的插入突变,使其转录水平降低从而导致不落粒表型[4,15]。
水稻种子落粒机制较为复杂,基因在调控种子落粒的功能方面也不是单一的,如SH 5基因既可调控种子离区发育,又可调控木质素的合成[9]。此外,许多落粒基因并非独立存在,基因之间会形成局部的调控网络(图1)。通过原位杂交,Zhou等[77]研究发现SH 4主要在SHAT1和qSH 1的上游发挥作用,SH4在上游积累并表达,促使相邻细胞分开,为SHAT1和qSH 1在离区细胞间的积累提供了条件。而SHAT1具有双重功能,一方面维持离区中SH 4的表达,促进离层分化,另一方面在SH 4的下游作用以激活qSH 1的表达。在SH 4的正向调控下,qSH 1在SHAT 1和SH 4的下游维持SHAT 1和SH 4在离区的表达水平,三者以此遗传关系共同促进离区分化[76]。SH 5能诱发SHAT 1和SH 4的表达,在SH 5过表达的植株中,SHAT 1和SH 4的表达量也显著增加,SH 5单独表达时不会诱导离区分化,在qSH 1的作用下,SH 5发挥作用并促进离区的发育[9]。此外,SH 5和qSH 1可与OSH 15相互作用,OSH 15与SH 5形成二聚体,通过直接抑制木质素生物合成基因的表达来促进水稻落粒,但SH 5单独表达时并不能增加种子落粒性,表明SH5需要与OSH 15共同作用[3,9,86]。
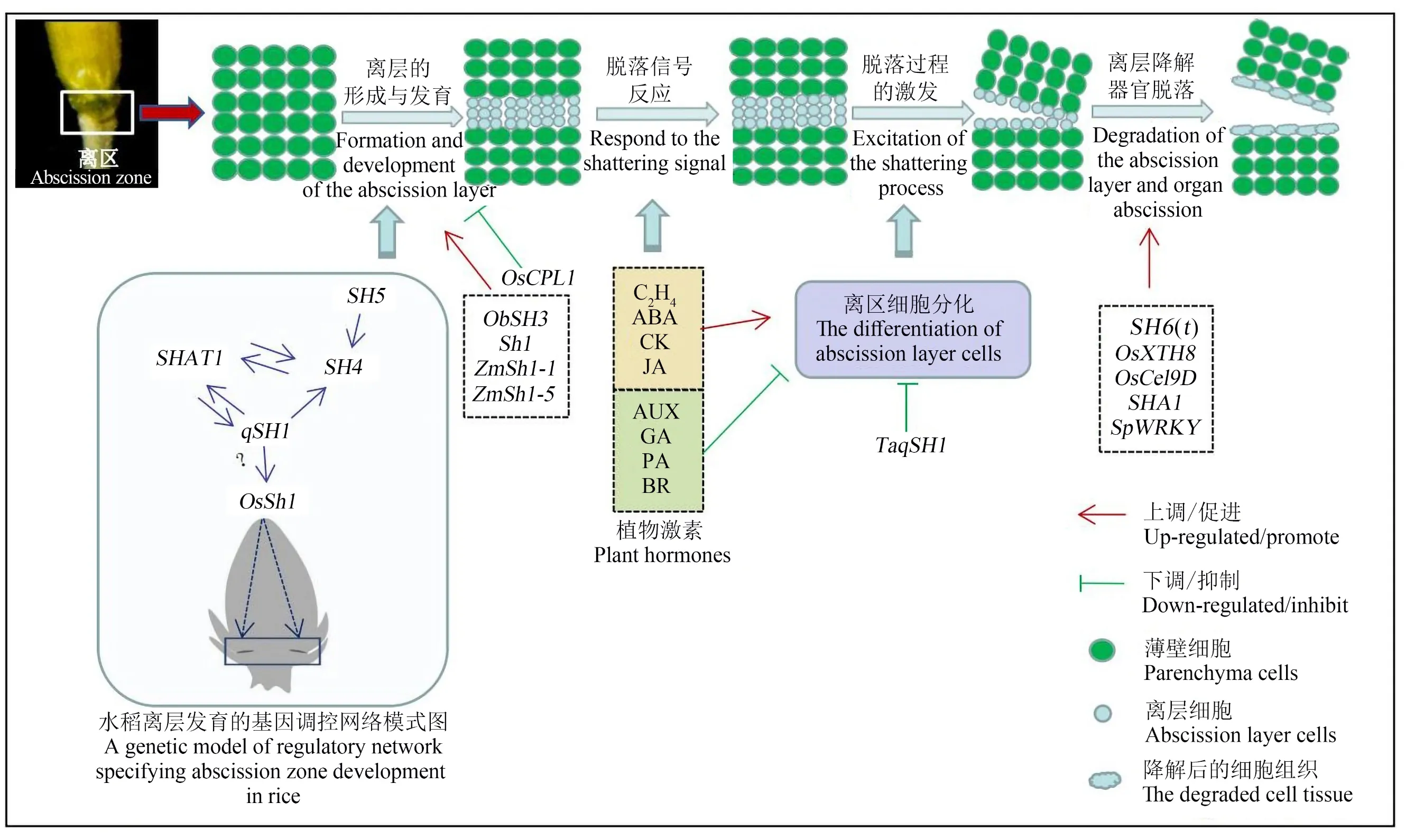
图1 禾本科植物落粒过程模型图Fig.1 Model diagram of gramineous plant shattering process
此外,Zhang等[87]在小麦中克隆了qSH1基因的同源基因TaqSH 1,TaqSH1基因编码BEL 1类蛋白,将该基因在拟南芥(Arabidopsisthaliana)中进行过表达后会产生花序更紧凑以及花瓣脱落被显著延迟等表型变化,研究还发现TaqSH 1的过表达下调了转基因植物中已知的拟南芥脱落相关基因的表达[54]。Lin等[15]从野生高粱(Sorghum bicolor)与不落粒品种的F2群体中克隆出第一个落粒相关基因Shattering1(Sh1),该基因编码YABBY转录因子,与水稻OsSh1和玉米ZmSh1-1基因均属于YABBY家族,且为直系同源基因。Sh1位点的突变抑制了Sh1基因的表达并改变了Sh1编码的蛋白质,从而降低了高粱落粒性。
与谷类作物相比,禾本科牧草中与离区发育相关的基因挖掘及克隆等研究较少(表2)。Larson等[88]基于构建的赖草属(Leymus)遗传图谱在6a染色体上定位了一个落粒主效QTL位点,该QTL位点可以解释43.1%的表型变异,对赖草属植物落粒具有重要影响。田青松等[89]用同源克隆技术从近缘种水稻落粒序列中获得了两个蒙古冰草落粒基因Amsh1-1和Amsh1-2,均属于YABBY转录因子家族。Fu等[32]通过比较基因组学等方法将已经在小麦、水稻和高粱上发现的落粒基因与多年生黑麦草转录组数据进行序列比对分析,共获得8个潜在的黑麦草落粒基因,利用这些基因对不同发育阶段的小花和种子进行RT-qPCR验证,发现基因LpSH 1在种子发育阶段表达量显著高于其他候选基因,这表明LpSH 1可能在调节多年生黑麦草离区发育过程中发挥着重要作用。Mamidi等[90]对狗尾草(Setaria viridis)进行全基因组关联分析发现位于5号染色体上的SvLES1基因是具有完整保守MYB结构域的转录因子,该位点一个SNP(C/T)的突变使狗尾草表现出低落粒性状。
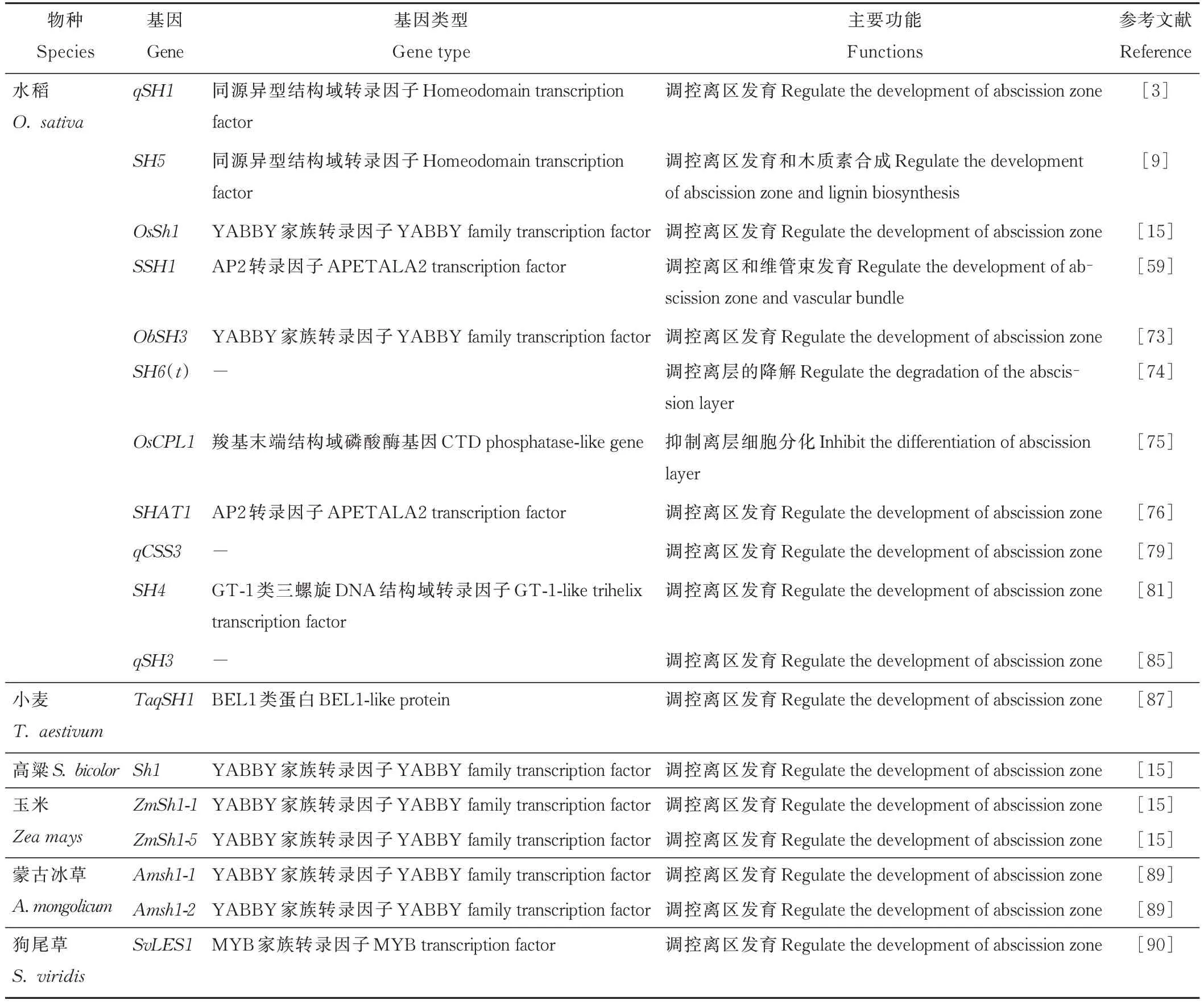
表2 调控离区发育的落粒基因信息Table 2 Information of seed shattering genes that regulate the development of abscission zone
3.3 调控离区生理学过程的落粒基因相关研究
脱落酸、乙烯和生长素等植物激素的浓度变化可产生促进或抑制种子落粒的信号,该过程受多个基因的调控[91]。脱落酸信号转导受几组ABA反应基因调控,如ABA受体PYR/PYL、2C型蛋白磷酸酶(PP2C)、丝氨酸/苏氨酸蛋白激酶(SnRK 2)和ABRE结合因子(ABF)[92-94]。研究认为PP2Cs通常作为ABA信号通路的反向调控因子[92],而SnRK 2正向调节ABA反应,但其活性可被PP2C抑制[93]。当ABA产生时,PP2Cs和SnRK 2s之间的互作由于受到受体PYR/PYL的干扰进而终止SnRK 2脱磷酸化,致使SnRK 2激酶活化[94]。通过对不同发育时期的老芒麦种子离区进行测序后发现,与发育早期相比,落粒严重时期的种子离区中11个PP2C基因全部上调,有8个SRK 2基因上调以及6个ABF基因上调,研究结果表明,这些ABA响应基因的相互作用可能导致老芒麦种子落粒[95]。Xie等[31]对高落粒和低落粒老芒麦材料进行转录组测序发现有54个差异表达基因参与植物激素信号转导,调节脱落酸信号转导的应答基因在落粒率不同的材料中差异表达,6个乙烯反应基因和3个IAA应答基因(SAUR,ARF和AUX/IAA)在低落粒基因型老芒麦的离区中表达呈上调趋势。乙烯是生长素的有效抑制剂,而离区的生长素水平影响其对乙烯的敏感性[45],乙烯和生长素之间的相互作用可能是调节和确定种子落粒过程时间的关键因素,这些应答基因的相互作用可能与种子落粒密切相关。
木质素作为一种复杂的苯丙烷类聚合物,可填充细胞壁多糖之间的空间,赋予细胞壁机械强度[80]。关于水稻的研究表明,通过减少木质素的合成可诱导种子落粒,在非落粒的“IIpum”品种中过表达BEL 1型同源盒基因SH 5,造成离区与种柄部位的木质素含量减少,最终导致种子落粒率升高[9]。OSH 15则通过直接抑制木质素生物合成基因表达的方式促进水稻落粒[86]。苯丙氨酸氨解酶(PAL)和肉桂基醇脱氢酶(CAD)是木质素合成的两种关键酶[96]。研究发现,在高落粒老芒麦中PAL基因和两个CAD基因表达被下调,并发现两个类似MYB转录因子的表达与木质素生物合成有关,这些基因的不同表达导致不同种质老芒麦落粒性产生差异[31]。
此外,在禾本科植物中已发现与离区细胞壁降解酶活性相关的基因(表3)。在水稻中,OsXTH 8基因编码催化木葡聚糖聚合物裂解的木葡聚糖内转糖基酶/水解酶,细胞壁在该酶的作用下发生膨大,OsXTH 8基因的表达使离区细胞壁发生降解,从而促进水稻种子落粒[97]。OsCel9D(OsGLU 1)基因编码内切β-1,4-葡聚糖酶,在调控节间伸长的同时也可调节细胞壁成分,其突变增加了果胶含量,减少了细胞伸长并且降低了纤维素含量,从而降低水稻种子落粒性[98]。Shattering1(SHA 1)与sh4是等位基因(序列相似性98%),Lin等[99]发现SHA 1基因通过调节离区细胞的分离降解过程来影响水稻落粒,Lin等[99]认为在水稻驯化过程中,SHA 1基因的单核苷酸突变降低了栽培稻种子落粒率,并且在所有驯化的栽培稻中都存在sha1突变基因。Tang等[100]在高粱的野生亲缘物种中观察到WRKY转录因子(SpWRKY)与落粒性相关,该基因可反向调控离层细胞壁水解酶的生物合成,促进离区的形成。在禾本科牧草中,Xie等[31]通过转录组研究发现有28个差异表达基因参与调控老芒麦离区纤维素酶的活性,这些基因的高表达可能导致种子落粒率的增加,与高落粒种质相比,低落粒材料中涉及多聚半乳糖醛酸酶活性的两个基因表达被下调[31]。Zhao等[33]对垂穗披碱草离区、非离区组织及老芒麦离区不同发育阶段组织材料进行转录组差异表达分析后发现在这两个物种离区中共鉴定到11个相似的上调表达基因,主要涉及多聚半乳糖醛酸酶、纤维素酶及果胶裂解酶基因,表明这些基因可能与垂穗披碱草和老芒麦的离区发育和落粒相关。半纤维素的主要成分木聚糖可以被木聚糖酶水解,从而加速离区的降解,而木聚糖酶的活性能够被木聚糖酶抑制剂抑制[101],水稻中已经报道了至少3个XIP木聚糖酶抑制剂基因:RIXI、XIP和OsXIP[102-104],研究发现XIP基因在低落粒老芒麦中的表达量高于高落粒材料,这表明该基因可能调控老芒麦种子落粒性[31]。

表3 调控离区生理学过程的落粒基因信息Table 3 Information of seed shattering genes that regulate the physiological process of abscission zone
4 结论与展望
禾本科植物普遍存在落粒现象,植物落粒不仅提高了种子生产成本,还影响了种子产量和质量。与作物相比,禾本科牧草的人工驯化史较短,许多栽培种仍保留一定的野生性,种子落粒普遍存在。因此,针对目前种子生产现状,根据种质的落粒特性选择合适的收获期以降低自然落粒带来的损失并筛选出符合实际生产需求的抗落粒品种十分关键。近年来,育种学家从形态学和解剖学基础、生理机制以及分子机理等方面对禾本科植物落粒机制进行了大量研究,揭示了禾本科植物落粒与离区结构、细胞壁水解酶活性、植物激素水平、离区木质素含量以及复杂的基因调控等因素有关。虽然禾本科作物与牧草具有相似的落粒机制,但关于禾本科牧草落粒分子机理的研究较少,所以,有关禾本科牧草落粒机理的研究仍需进一步深入。
乙烯、脱落酸和细胞分裂素等植物激素产生促进牧草落粒的信号,生长素和赤霉素则产生抑制脱落的信号。目前关于植物激素对禾本科牧草落粒的影响机制以及不同植物激素间的相互作用关系尚未完全了解,仍存在许多问题需进一步探讨,如不同落粒程度的牧草在离层形成、发育和降解过程中植物内源激素间的作用关系在分子层面上有何差别?因此,要继续扩大关于内源激素对禾本科牧草落粒的影响机制的研究范围。
此外,研究表明不同的物种在落粒性状上表现出趋同进化,如大麦和小麦中存在调控穗轴脆性的同源基因,高粱Sh1、水稻OsSh1和玉米ZmSh1-1基因均与落粒相关,且为直系同源基因。在禾本科模式作物水稻中已鉴定出多个与落粒相关的基因,并已初步建立了水稻落粒的部分基因调控网络。这些研究为禾本科牧草落粒分子机理的研究提供了一定理论参考,但基因调控落粒的过程复杂,落粒基因之间的相互作用及相关基因的功能研究还不够深入,且落粒基因功能并非完全保守,有些基因在禾本科植物种内及种间具有不同的基因功能,所以禾本科牧草种子落粒基因的挖掘定位以及基因间相互作用的机制等问题都需要进一步探索。
总之,我国牧草育种研究起步晚、投入少,且牧草种类繁多、多数牧草具有多年生、多倍体、异花授粉等特性,大多数牧草缺乏组学信息、无突变体库、无遗传转化体系,从而限制了牧草育种的进程。我国牧草育种多采用野生栽培驯化、轮回选择、杂交等常规育种技术,育种目标多集中在草产量方面,尚无抗落粒育种研究。而水稻等主要农作物育种已进入分子设计育种时代,通过集成和整合多种技术,基于基因型和表型数据设计亲本组配和后代选择,以提高育种的预见性和效率,实现定向、高效的精准育种,并且利用基因编辑技术进行从头驯化以满足未来个性化需求。从传统育种到分子设计育种的跨越主要依赖于基因组测序、全基因组选择以及目标性状连锁的分子标记的开发等技术手段,这为培育突破性的低落粒牧草品种提供了重要参考。
