干旱和UV-B辐射胁迫及其互作对白沙蒿抗性生理的影响
2021-08-21韩晓栩赵媛媛张丽静郭丁傅华李永善杨成新
韩晓栩,赵媛媛,张丽静,郭丁,傅华,李永善,杨成新
(1.兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州730020;2.内蒙古自治区孪井滩气象站,内蒙古 嘉尔嘎勒赛汉镇750312;3.内蒙古自治区阿拉善盟草原工作站,内蒙古 巴彦浩特750306)
据统计,全球干旱半干旱地区占陆地面积的45%以上[1]。干旱程度正随着全球气候的变暖而加剧,面积也正在以较快速度扩大[2]。干旱是影响植物生长和发育的重要因子。与此同时,由臭氧层损耗引起的UV-B辐射增加已经成为全球性的环境问题[3],植物对UV-B辐射增强的反应将是未来几十年的重要问题[4]。在干旱地区,UV-B辐射和干旱是常见的胁迫因子且常同时发生,因此植物对二者复合胁迫的适应机制受到广泛关注[5-6]。
干旱和UV-B复合胁迫会在植物中引起协同或拮抗作用。干旱和UV-B辐射复合胁迫可加剧单一胁迫造成的损伤:与干旱胁迫相比,复合胁迫使滇杨(Populusyunnanensis)植株变矮、叶面积和总生物量下降[7];添加UV-B辐射使干旱胁迫对长须银柴胡(Stellaria longipes)叶面积和干物质积累的抑制作用增强[8]。与之相反,大量研究表明干旱和UV-B复合胁迫可缓解单一胁迫造成的损伤:复合胁迫可增加叶角质层厚度,减少UV-B辐射在叶内的渗透,同时减少蒸腾失水[9];增加光合色素合成,提高光合速率,促进光合作用[10];诱导大量酚类和类黄酮等紫外吸收物质和脯氨酸等渗透调节物质产生[3],抗氧化酶系统活性增加[11],清除细胞内活性氧自由基、减轻膜脂过氧化[12]。目前,干旱与UV-B辐射复合胁迫的相关研究主要集中在表型、光合作用及抗氧化能力等方面。脂氧合酶(lipoxygenase,LOX)会造成膜脂过氧化,从而降低植物抗逆性[13]。有研究表明类黄酮可抑制脂氧合酶活性[14],但目前在干旱和UV-B复合胁迫中类黄酮是否可通过抑制LOX活性减轻膜脂过氧化,从而缓解膜损伤尚不清楚。通过改变不饱和脂肪酸水平来调节膜流动性,是植物抵抗非生物胁迫的特征之一[15]。在单独干旱[16]和UV-B辐射[17]胁迫中,脂肪酸含量、组成以及不饱和度均发生变化,但目前关于植物脂肪酸含量、组成以及不饱和度在干旱和UV-B复合胁迫中的变化尚无报道,关于不饱和脂肪酸在植物抵抗干旱和UV-B辐射复合胁迫中的作用尚不清楚。
近年来,荒漠植物对干旱和UV-B辐射独特的适应性及其应对策略受到广泛关注[18-19]。白沙蒿(Artemisia sphaerocephala),菊科蒿属,多年生半灌木,广泛分布于中国西北的甘肃、宁夏、陕西、新疆以及内蒙古地区[20],是流动沙丘和半流动沙丘上最重要的先锋固沙植物之一,对维持荒漠生态系统稳定性具有特殊意义[21]。本试验模拟荒漠生境,探究干旱和UV-B辐射胁迫及其互作对白沙蒿幼苗生长、次生物质类黄酮代谢、脂肪酸代谢的影响,以探究白沙蒿在荒漠条件下的适应机理,为荒漠生态系统的恢复与治理提供科学依据。
1 材料与方法
1.1 试验材料
供试植物材料为2014年9月采自阿拉善的白沙蒿种子。白沙蒿种子种于混合土(灰钙土∶细砂=2∶1)中,试验于温室(昼夜温度:25℃/12℃;光周期:16 h/8 h;光合有效辐射:150 mol·m-2·s-1;相对湿度:30%)内进行,出苗30 d后,进行间苗,每盆留长势一致的白沙蒿幼苗1株,开始进行胁迫处理。
1.2 干旱和UV-B辐射处理
处理分为对照(control,CK)、干旱(drought,D)处理、UV-B辐射(UV-B radiation,U)处理以及干旱和UV-B辐射复合(D+U)处理,每处理设10个重复。土壤含水量以田间最大持水量(测得为25.5%)为根据。CK处理,土壤含水量为田间持水量的78%,辐射量为0µW·cm-2;D处理,土壤含水量为田间持水量的45%,辐射量为0µW·cm-2;U处理,土壤含水量为田间持水量的78%,辐射量为15.95µW·cm-2;D+U处理,土壤含水量为田间持水量的45%,辐射量为15.95µW·cm-2。处理过程中使用称重法控制盆中土壤含水量。使用40 W UV-B灯管(北京电光源研究所,中国)模拟UV-B辐射。UV-B辐射强度用UV-B辐照计(北京师范大学光电仪器厂,中国)测定。UV-B照射时间为每日固定2 h。处理21 d后取样进行测定。
1.3 测定指标及方法
随机选取完整新鲜叶,使用便携式叶面积扫描仪(AM 2000E,英国)测定叶面积,用精确度为0.01 m的直尺测量株高,即白沙蒿幼苗基部至最顶端的距离。将植株的根、茎、叶分别在105℃条件下快速杀青30 min,然后在85℃条件下连续烘干48 h直至恒重并称重获得其干物质量。
使用称重法测定叶的相对含水量(relative water content,RWC)[22]。使用浸泡法测定叶的相对电导率(relative electric conductivity,REC)[23]。
使用植物脂氧合酶(lipoxygenase,LOX)活性试剂盒(苏州科铭生物有限公司,中国)进行LOX活性测定;使用硫代巴比妥酸法进行丙二醛(malondialdehyde,MDA)含量测定[24]。根据Liu等[25]的方法测定白沙蒿叶的类黄酮含量;使用植物苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)酶联免疫分析试剂盒、植物查尔酮合酶(chalcone synthase,CHS)酶联免疫分析试剂盒以及植物查尔酮异构酶(chalcone isomerase,CHI)酶联免疫分析试剂盒(南京森贝伽生物有限公司,中国)对3种酶含量进行测定。
参照楚秉泉等[26]的方法提取脂肪酸,使用GC-MS气质联用法对脂肪酸组成及含量进行测定。
按照UNIQ-10柱式Trizol RNA抽提试剂盒(上海生工生物工程技术服务有限公司,中国)说明书方法提取白沙蒿叶RNA。使用Prime-Script RT-PCR Kit试剂盒(Takara,中国)将RNA反转录为cDNA,使用SYBR Premix Ex Taq Kit试剂盒(Takara,中国)在实时定量PCR仪(BIO-RAD,美国)上进行qRT-PCR。重复3次,以UBC9作为内参基因[27],用2-ΔΔCt法计算基因相对表达量。
1.4 数据分析
使用Microsoft Excel 2019对原始数据进行整理,使用SPSS 20.0软件进行方差分析(Duncan,P<0.05),使用Microsoft Excel 2019和Microsoft Office PowerPoint 2019制图。
2 结果与分析
2.1 干旱和UV-B辐射及其互作对白沙蒿幼苗生长的影响
D和U处理下,白沙蒿幼苗生长均受到抑制,生物量均显著降低(P<0.05);D+U处理后,此种抑制有所缓解,叶、茎、根重及总生物量较D处理显著升高(P<0.05),为U处理的1.19、1.08、1.12和1.12倍(表1)。3个处理根冠比与CK均无显著差异(表1)。D和U处理白沙蒿幼苗株高和叶面积均显著降低,D+U处理株高分别为D和U处理的1.14和1.09倍,叶面积分别为D和U处理的1.69和1.16倍(表1)。
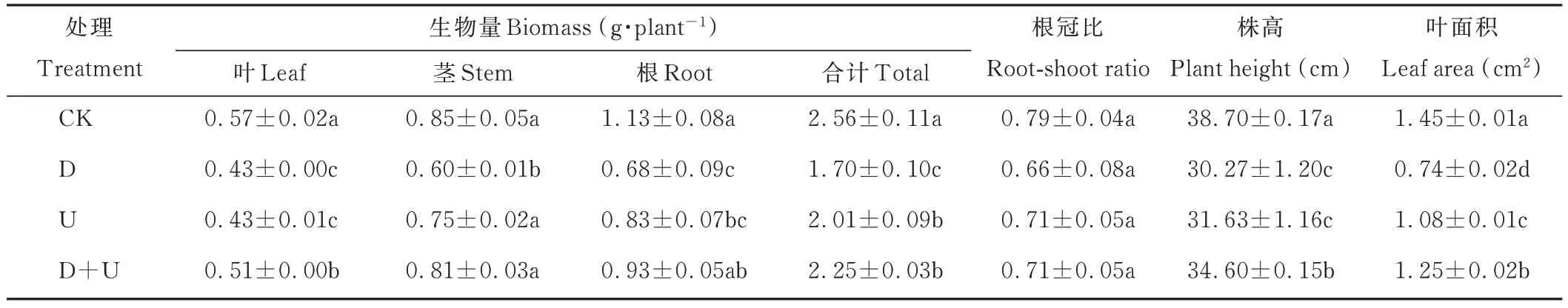
表1 干旱和UV-B辐射及其互作对白沙蒿幼苗生长的影响Table 1 Effect of growth indices on A.sphaerocephala seedlings treated with drought and UV-B radiation acting individually and in combination
D和U处理白沙蒿叶RWC显著低于CK,D+U处理RWC分别为D和U处理的1.09(P<0.05)和1.03倍(图1)。
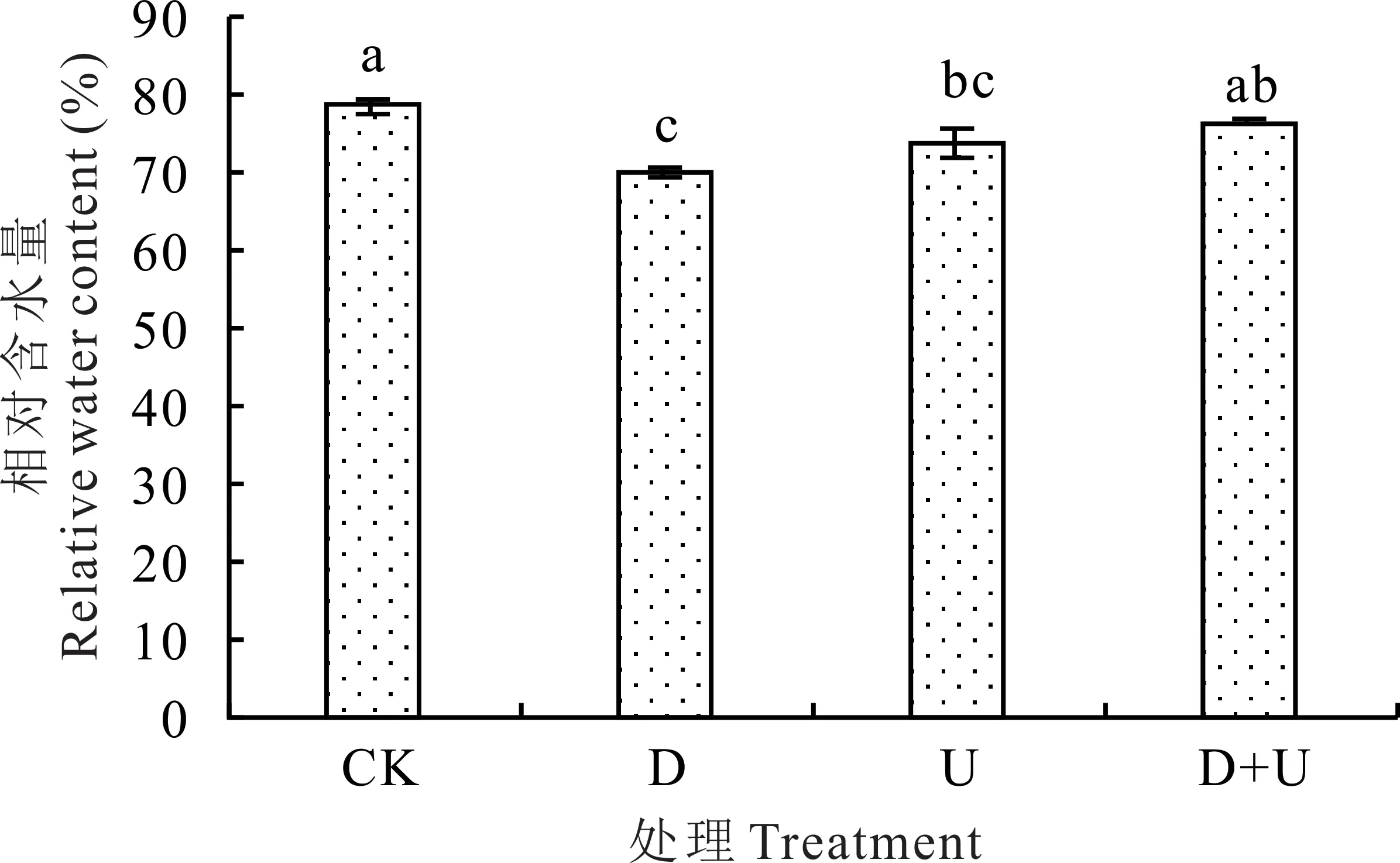
图1 干旱和UV-B辐射及其互作对白沙蒿叶相对含水量的影响Fig.1 Effect of RWC on A.sphaerocephala leaves treated with drought and UV-B radiation acting individually and in combination
2.2 干旱和UV-B辐射及其互作对白沙蒿膜脂氧化损伤的影响
各处理REC含量均显著高于CK,D+U处理分别为D和U处理的89.58%和84.61%(P<0.05)(图2)。D处理MDA含量为CK的1.65倍(P<0.05),U处理与CK无显著差异,D+U处理为D处理的66.79%(P<0.05),与U处理无显著差异。D处理LOX活性为CK的3.69倍(P<0.05),U处理与CK无显著差异。D+U处理可缓解D处理引起的LOX活性升高,D+U处理为D处理的44.00%(P<0.05),与U处理无显著差异。
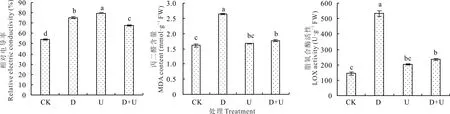
图2 干旱和UV-B辐射及其互作对白沙蒿叶相对电导率、丙二醛含量和脂氧合酶活性的影响Fig.2 Effect of REC,MDA content and LOX activity on A.sphaerocephala leaves treated with drought and UV-B radiation acting individually and in combination
2.3 干旱和UV-B辐射及其互作对白沙蒿叶次生物质类黄酮代谢的影响
D和U处理白沙蒿叶类黄酮含量分别为CK的1.25和1.37倍(图3),D+U处理较D和U处理进一步提高,分别为其1.57和1.40倍(P<0.05)。
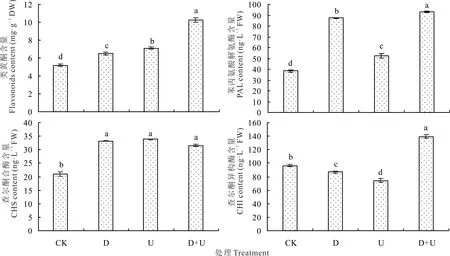
图3 干旱和UV-B辐射及其互作对白沙蒿叶类黄酮含量及其合成途径中关键酶的影响Fig.3 Effect of flavonoids content and key enzymes in its synthesis pathway on A.sphaerocephala leaves treated with drought and UV-B radiation acting individually and in combination
各处理白沙蒿叶PAL、CHS含量均显著高于CK(P<0.05),D+U处理PAL含量分别为D和U处理的1.06和1.77倍(P<0.05);D+U处理CHS含量分
别为D和U处理的94.83%和93.26%。与CK相比,D和U处理均引起CHI含量显著下降(P<0.05),D+U处理分别为D和U处理的1.60和1.87倍(P<0.05)。
2.4 干旱和UV-B辐射及其互作对白沙蒿叶脂肪酸代谢的影响
2.4.1 干旱和UV-B辐射及其互作对白沙蒿叶脂肪酸组成及含量的影响 白沙蒿叶6种主要脂肪酸分析结果表明,3种饱和脂肪酸(saturated fatty acid,SFA):棕榈酸(C16:0)、硬脂酸(C18:0)、花生酸(C20:0),占总脂肪酸25.24%;3种不饱和脂肪酸(unsaturated fatty acid,UFA):油酸(C18:1)、亚油酸(C18:2)和亚麻酸(C18:3),占总脂肪酸74.76%(表2)。
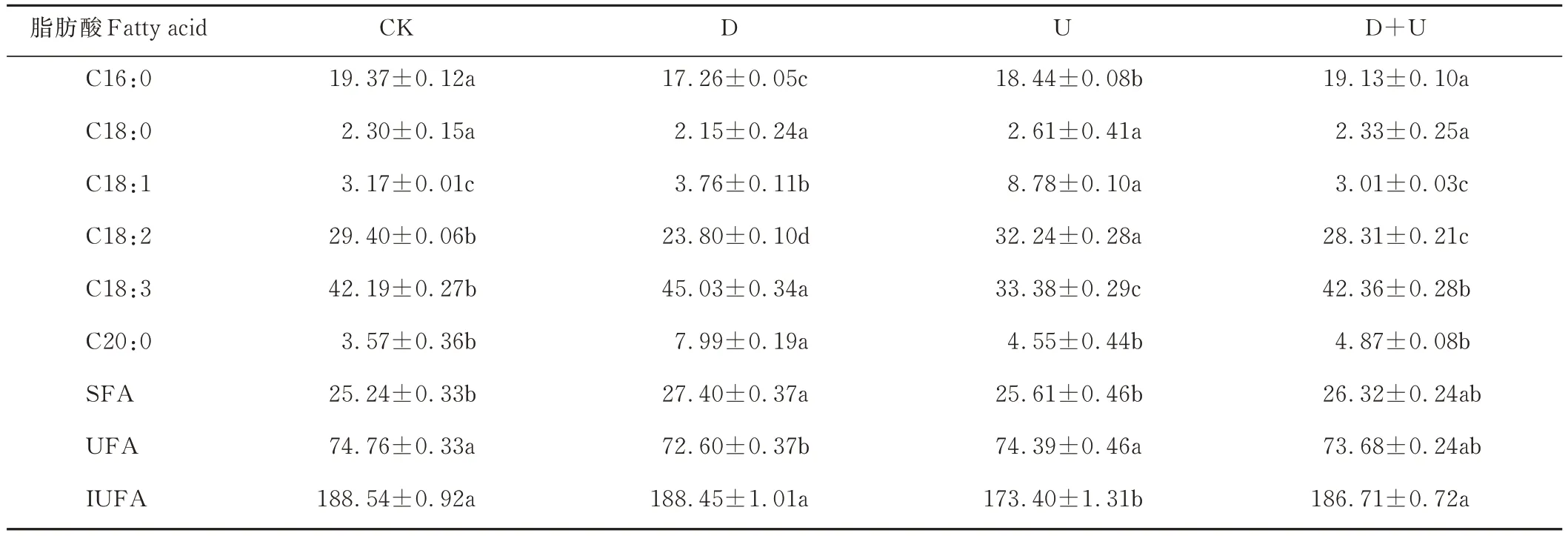
表2 干旱和UV-B辐射及其互作对白沙蒿叶脂肪酸组成及含量的影响Table 2 Effect of fatty acid composition and content on A.sphaerocephala leaves tr eated with dr ought and UV-B r adiation acting individually and in combination(%)
D和U处理均造成SFA上升,分别为CK的1.09(P<0.05)和1.01倍;UFA下降,为CK的97.11%(P<0.05)和99.51%。UFA中,D处理C18:1、C18:2和C18:3含量分别为CK的1.19倍、80.95%和1.07倍(P<0.05);U处理C18:1、C18:2和C18:3含量分别为CK的2.77倍、1.10倍和79.12%(P<0.05)。D+U处理C18:1、C18:2和C18:3含量分别为D处理的80.05%、1.19倍和94.07%,为U处理的34.28%、87.81%和1.27倍(表2)。D处理不饱和脂肪酸指数(index of unsaturated fatty acid,IUFA)与CK相比无显著差异,U处理为CK的91.96%(P<0.05),D+U处理与CK和D处理无显著差异,为U处理的1.08倍(P<0.05,表2)。
2.4.2 干旱和UV-B辐射及其互作对白沙蒿叶不饱和脂肪酸合成途径中关键基因的影响 脂肪酸去饱和酶2(fatty acid desaturase 2,FAD2)和FAD6通过去饱和作用促使C18:1合成C18:2,FAD3和FAD7/8则促使C18:2合成C18:3[28]。D处理FAD2基因表达量与CK无显著差异,FAD3基因不表达(图4,5);FAD7/8和FAD6基因表达量分别是CK的2.22和2.69倍。U处理FAD2和FAD3基因表达量分别为CK的29.08和4.28倍;FAD6和FAD 7/8基因表达量与CK无显著差异。D+U处理FAD2与D处理无显著差异,为U处理的11.61%;FAD3基因表达量为U处理的44.16%(P<0.05);FAD6基因表达量分别为D和U处理的14.50%和37.86%(P<0.05);FAD7/8与D处理无显著差异,为U处理的2.38倍(P<0.05)(图4)。
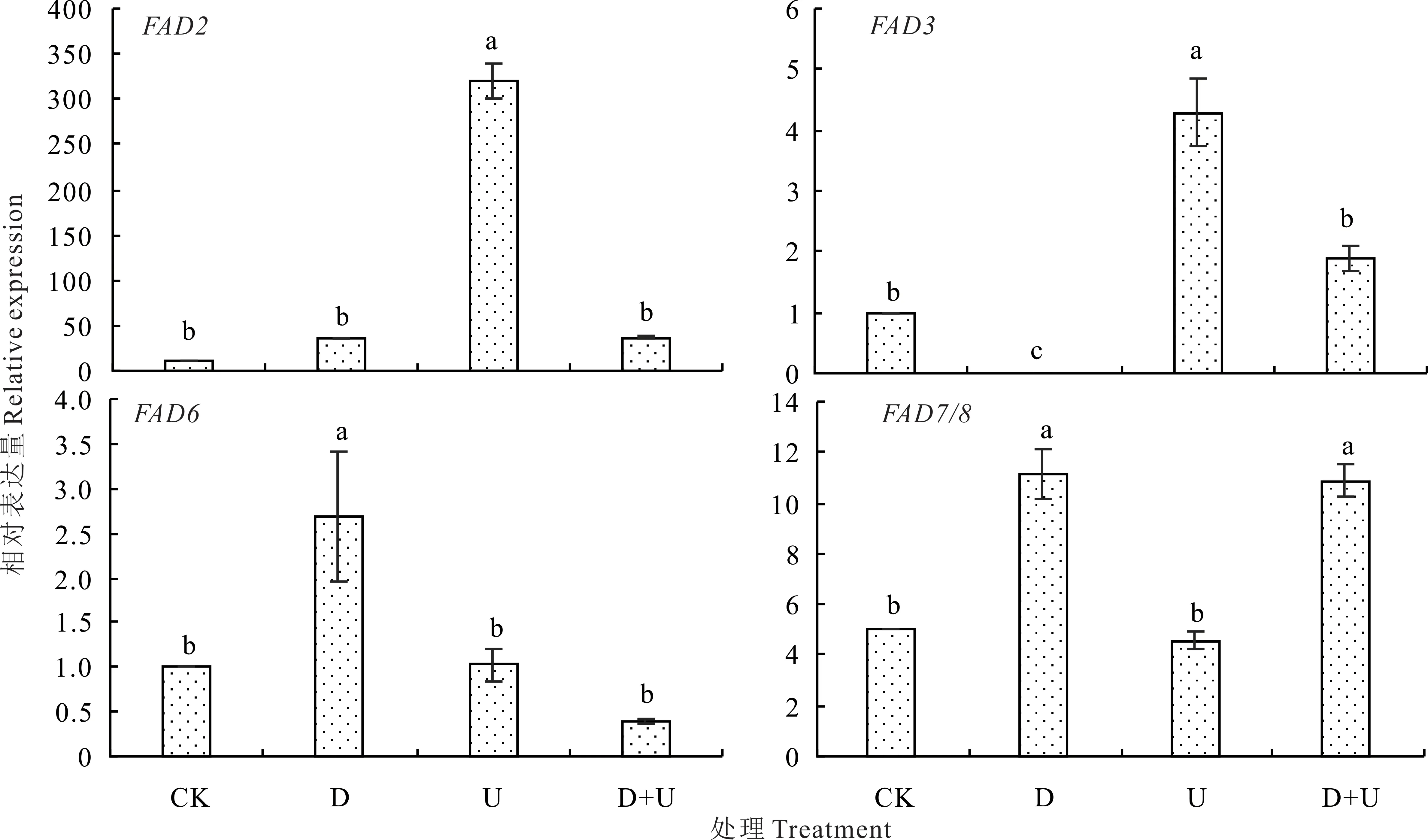
图4 干旱和UV-B辐射及其互作对白沙蒿叶中FAD基因表达的影响Fig.4 Effect of FAD gene expression on A.sphaerocephala leaves treated with drought and UV-B radiation acting individually and in combination
3 讨论
本研究发现,D和U处理均造成白沙蒿幼苗叶、茎、根生物量及总生物量积累减少、株高和叶面积降低;D+U处理下,单一胁迫引起的生长抑制得到有效缓解,上述指标较单一胁迫均有所增加(表1)。这一结果与大量研究一致,干旱和UV-B复合胁迫可增加光合色素合成、提高光合速率、促进光合作用,增加抗氧化酶系统活性、清除细胞内活性氧自由基,从而缓解单一胁迫引起的生物量下降[10-12]。本研究中,D和U处理白沙蒿叶的REC分别为CK的1.40和1.48倍(图2),表明干旱和UV-B辐射单独胁迫造成的膜损伤可能是造成白沙蒿生物量下降的重要原因之一;D+U处理下,REC分别为D和U处理的89.58%和84.61%(图2),表明干旱和UV-B辐射复合胁迫缓解了其在单一胁迫下受到的膜损伤。
干旱和UV-B辐射复合胁迫对自由基代谢、紫外吸收物质、抗氧化系统等方面均会造成影响。其中,类黄酮作为抗氧化物质和紫外吸收物质,在响应干旱和UV-B辐射时均在叶中大量积累,从而保持植物氧化还原平衡,并减少UV-B辐射的渗透[29]。本研究D和U处理类黄酮含量分别为CK的1.25和1.37倍,这与对大麦(Hordeum vulgare)、莴苣(Lactuca sativa)、蒙古莸(Caryopteris mongolica)的研究结果一致[30-32]。PAL、CHS、CHI是类黄酮合成途径中的3种关键酶,其会随胁迫程度加重以及多种胁迫复合而增加[33-34]。本研究中,D和U处理白沙蒿PAL和CHS含量分别为CK的2.09、1.35倍和1.58、1.61倍,二者与D和U处理下类黄酮含量增加一致,而CHI含量为CK的90.41%、77.14%(图3),表明UV-B辐射和干旱单独胁迫下,PAL和CHS可能起主要作用。本研究中,复合胁迫下PAL和CHI含量在D和U处理下显著升高(图3),与D+U处理白沙蒿类黄酮含量显著高于D和U处理的结果一致,表明复合胁迫下PAL和CHI含量增加是复合胁迫下类黄酮增加的主要原因。
LOX会产生氢过氧化合物,造成膜脂过氧化。研究表明类黄酮含量达到一定数值时,其能够抑制LOX活性,从而降低膜脂过氧化[14]。本研究中,与CK相比,D和U处理均造成白沙蒿类黄酮含量升高,但U处理LOX活性和MDA含量无显著变化,D处理LOX活性和MDA含量分别为CK的3.25和1.65倍(P<0.05)(图2和图3)。上述结果表明,U处理白沙蒿类黄酮含量升高,使LOX活性保持与CK相当的水平,未造成膜脂过氧化产物MDA含量升高;D处理虽然类黄酮含量显著高于CK,但这一抑制现象并未体现,推测类黄酮含量需要达到一定阈值才能对LOX活性具有抑制作用,而干旱胁迫下LOX活性上升是其造成白沙蒿膜损伤的重要原因。D+U处理下类黄酮含量进一步提高,分别为D和U处理的1.57和1.40倍(P<0.05),LOX活性和MDA含量分别为D处理的44.00%和66.79%(P<0.05),但均与U处理无显著差异(图2和图3)。上述结果表明,D+U处理类黄酮进一步增加导致LOX活性降低,缓解了干旱引致的膜脂过氧化,MDA含量减少,这种抑制也存在于大豆(Glycine max)中[35]。类黄酮含量的提高,且其对LOX活性的抑制作用是干旱和UV-B复合胁迫下缓解白沙蒿膜损伤的重要原因之一。
脂肪酸是生物膜的主要组分,其不饱和度升高可以增加细胞膜的流动性,从而维持生物膜基本功能和细胞生命活动,提高植物的抗逆性。植物抗旱性以及耐UV-B辐射能力与其脂肪酸不饱和度密切相关:干旱胁迫下,葡萄(Vitis vinifera)、马尼拉草(Zoysia matrella)可维持高水平的脂肪酸不饱和度,提高膜流动性,维持膜正常功能[36-37];UV-B辐射下,黄瓜(Cucumis sativus)UV-B不敏感品种的不饱和脂肪酸水平高于敏感品种[38]。脂肪酸不饱和度可用IUFA来衡量,值越大则不饱和程度越高[16,39]。本研究中,与CK相比,D处理IUFA无显著差异,U处理C18:1、C18:2、C18:3含量和IUFA分别为CK的2.77倍、1.10倍、79.12%和91.96%(P<0.05)(表2)。上述结果表明,干旱胁迫下白沙蒿脂肪酸不饱和度保持了与CK相当的水平,膜流动性未受到影响,而U处理由于C18:3含量显著下降,导致IUFA显著下降,UV-B辐射下白沙蒿脂肪酸不饱和度下降导致膜流动性下降是其造成白沙蒿膜损伤的重要原因。D+U处理IUFA与D处理无显著差异;D+U处理C18:1、C18:2、C18:3含量和IUFA为U处理的34.28%、87.81%、1.27倍和1.08倍(P<0.05)(表2),表明D+U处理提高C18:3含量导致IUFA升高,缓解了UV-B辐射引致的脂肪酸不饱和度下降。脂肪酸不饱和度上升恢复膜流动性是干旱和UV-B复合胁迫下缓解白沙蒿膜损伤的重要原因之一。
FAD是不饱和脂肪酸合成途径的关键酶,调控脂肪酸的不饱和程度[28]。干旱、盐、病原菌等众多胁迫中,植物通过调节FAD基因表达水平从而维持脂肪酸不饱和程度的适应机制受到广泛关注[40]。本研究对干旱、UV-B辐射及其复合胁迫下FAD基因表达水平进行研究发现,D处理FAD2基因表达量与CK无显著差异,FAD3基因不表达;FAD 7/8和FAD6基因表达量分别是CK的2.22倍和2.69倍(图4),C18:3含量为CK的1.07倍(表2),表明FAD7/8和FAD6的上调表达,是D处理C18:3含量上升导致IUFA无显著变化的主要原因,这与对转LeFAD7基因番茄(Lycopersicon esculentum)的研究结果一致[41]。U处理FAD2和FAD3基因表达量分别为CK的29.08和4.28倍,FAD6和FAD7/8基因表达量与CK无显著差异(图4),C18:2和C18:3含量为CK的1.10倍和79.12%,表明U处理C18:2含量上升和C18:3含量下降可能是由于FAD3基因表达量上调倍数远小于FAD2基因,造成C18:1向C18:2的转化程度比C18:2向C18:3的转化程度更活跃。D+U处理FAD2、FAD3和FAD6基因表达量下降,为U处理的11.61%,44.16%和37.86%(P<0.05),而FAD7/8基因表达量为U处理的2.38倍(P<0.05)(图4),表明干旱和UV-B复合胁迫下白沙蒿通过诱导FAD7/8上调表达,促使C18:3显著上升,造成IUFA上升(图5)。
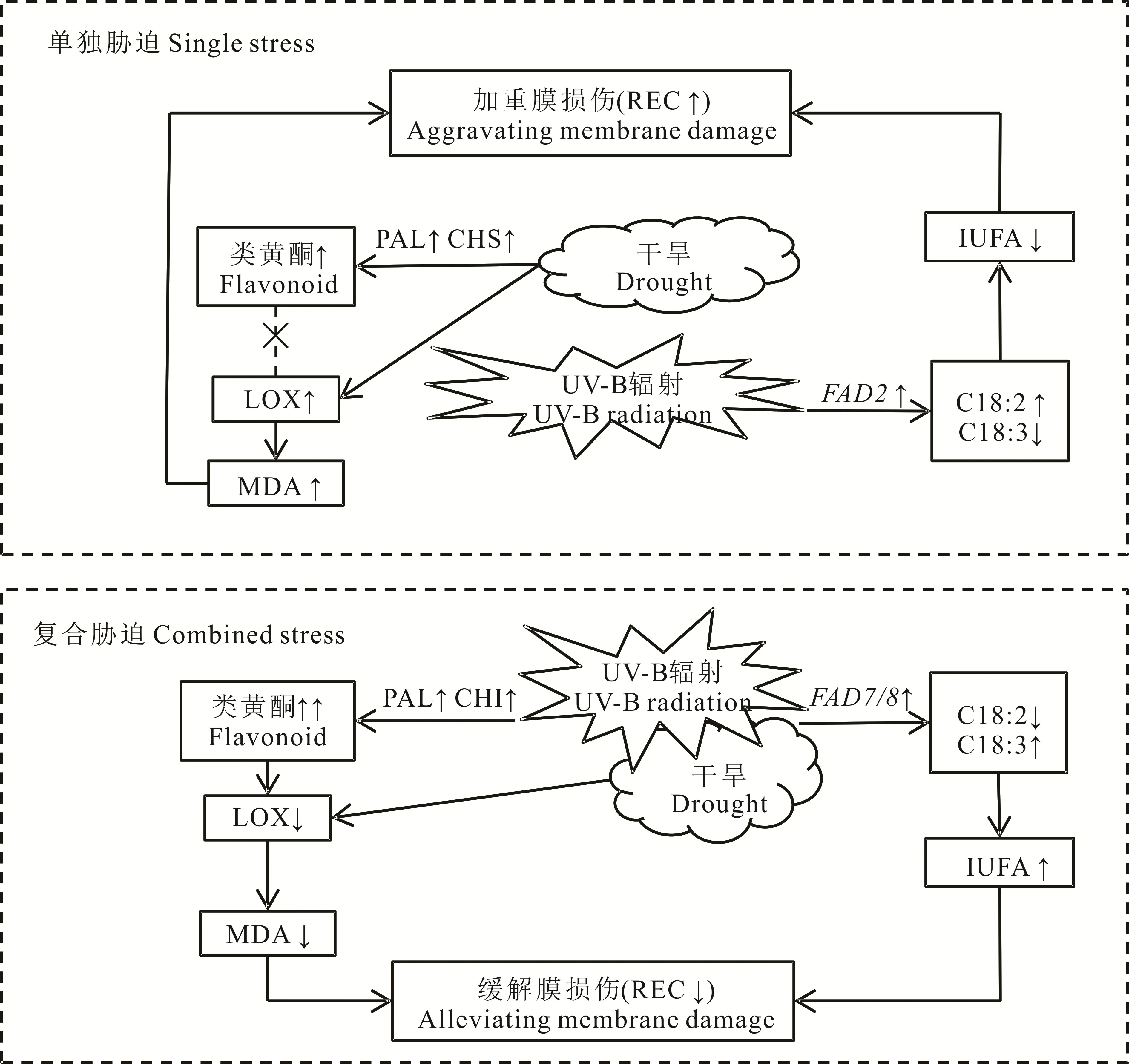
图5 干旱和UV-B辐射及其互作对白沙蒿类黄酮和脂肪酸代谢的影响Fig.5 Effects of drought and UV-B radiation on flavonoid metabolism and fatty acid metabolism in A.sphaerocephala
4 结论
干旱造成LOX活性增加从而引发膜脂过氧化,UV-B辐射诱导FAD2表达水平增加从而降低IUFA,单一胁迫下造成的膜损伤是导致白沙蒿生物量减少的重要原因。干旱和UV-B辐射复合胁迫通过增加类黄酮含量抑制LOX活性和提高FAD 7/8表达水平增加IUFA,二者间的互作缓解了白沙蒿在单一胁迫下受到的膜损伤(图5)。
