四川某猪场猪蓝耳病感染情况检测分析
2021-08-21胡晓,杨蕊
胡 晓,杨 蕊
(1.内江市种猪场,四川 内江 641007;2.西南大学动物科学学院,重庆 荣昌 402460)
猪繁殖与呼吸综合征(PRRS)又名猪蓝耳病,是20世纪80年代出现的一种新型高致病性传染病。该病在1987年最早发现于美国。2007年1月我国将其列为一类动物疫病[1]。猪蓝耳病在各个猪场之间广泛传播,有的猪场使用疫苗,而有的未使用,但均有一些猪场发病,主要引起繁殖母猪生产性能严重下降和仔猪的呼吸道症状,生长发育不良,甚至继发细菌性传染病,如副猪、传胸等,给猪场造成了严重的经济损失。本试验以四川某猪场未进行蓝耳病疫苗免疫的3~4月龄架子猪为研究对象,采集血液样本235 份分离血清,用间接ELISA 法检测猪蓝耳病抗体,同时根据猪蓝耳病病毒ORF6 基因设计引物,采集19 份血液样本进行RT-PCR检测。现将检测结果报告如下:
1 试验材料
1.1 被检血清及血液样本的采集 血清样本采集:随机选择四川某猪场未进行蓝耳病疫苗免疫的3~4月龄架子猪,前腔静脉采血2~5 mL,共采集235 份,放入离心管中,室温下静置2~4 h,待血液凝固血清析出后,以3 000 r/min 离心分离血清,于-20 ℃保存待检。
血液样本采集:使用医用真空抗凝采血管,随机采集未免疫的架子猪前腔静脉血液2~5 mL,共采集19份,置4~8 ℃保存待检。
1.2 试剂 猪繁殖与呼吸综合征抗体检测试剂盒,山东绿都生物科技有限公司生产(批号:2018010136);RNA基因组提取试剂盒,宝生物工程(大连)有限公司生产(批号:20170503202)。
2 方法
2.1 猪血清蓝耳病ELISA抗体检测
2.1.1 样品准备 将保存的待测血清取出,室温静置30 min,用试剂盒样品稀释液对血清样品进行40倍稀释,阴、阳性对照进行4倍稀释。
2.1.2 试剂准备 将10×浓缩洗涤液在使用前恢复至室温,有沉淀的等到其沉淀溶解,然后用蒸馏水进行10 倍稀释(即10 μL 浓缩洗涤液加入90 μL的蒸馏水)。
2.1.3 操作步骤 将试剂盒取出,待其恢复至室温。取出抗原包被板,根据样品数拆分出需要的孔数,并对样品位置进行标记和记录,在相应孔的位置上加入稀释好的样品100 μL。各取100 μL 阴、阳性对照加入到抗原包被板中,每次检测各设两孔对照。加样完成后,37℃孵育30min。将各孔的废液弃去,每孔加入稀释好的洗涤液200 μL洗板,重复此操作5次,每次2~3 min。倒掉洗涤液后将孔中残留的液体拍干,每孔加入酶标二抗100 μL,37 ℃孵育30 min。再将孔中液体弃去,加入洗涤液洗板,重复5 次,拍干,每孔加入100 μL TMB 底物液。37 ℃孵育15 min 后,用移液枪在板条上每孔加50 μL 的终止液,立刻于450 nm波长处用酶标仪测定各孔的吸光值。
2.1.4 结果判断(按试剂盒说明书进行)猪繁殖与呼吸综合征病毒抗体的阴阳性需通过计算每个样品的S/P值来判断。
计算方法:样本S/P 值=(样本OD 值-阴性值的平均值)/(阳性值的平均值-阴性值的平均值)。
若样品S/P 值≥0.25,则判定为抗体阳性;若样品S/P值≤0.20,则判定为抗体阴性;若0.20≤样品S/P值≤0.25,则判定为可疑。
2.2 蓝耳病RT-PCR检测
2.2.1 蓝耳病病毒ORF6 基因引物合成 根据已知的ORF6 基因引物序列,送上海生工生物公司合成(见表1)。
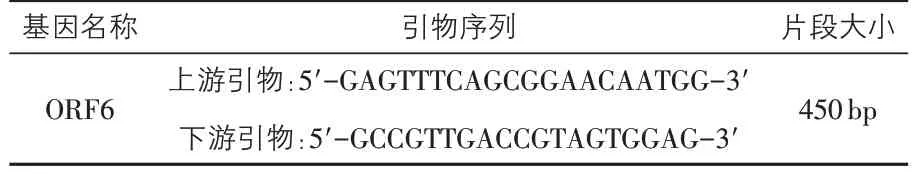
表1 ORF6基因引物
2.2.2 猪蓝耳病病毒RNA 的提取 将保存的待测液取出加入100~200 μL 氯仿,用力摇匀。将加好氯仿的血液样品以12 000 r/min 冷冻离心15 min,吸取上清液移入到新的去RNA 酶离心管中,加入0.25 mL异丙醇,轻柔地翻转几次将其摇匀,在冰盒上静置35 min后以12 000 r/min冷冻离心15 min,弃去上清液取400 μL 用75%的酒精进行三次洗涤,尽量去除离心管内的异丙醇等其他物质。用移液枪把离心管内剩余的液体尽量吸干净,打开离心管盖放冰盒上10 min 待酒精挥发晾干,根据沉淀的多少加入20~40 μL 的去RNA 酶水,悬浮静置片刻待其溶解后保存备用。
2.2.3 猪蓝耳病病毒RNA 的反转录 将上一步获得的RNA作为模板,根据实验室制定的反转录条件配制反转录体系。在PCR仪上进行反转录,经过30 ℃退火反应,42 ℃延伸反应,99 ℃变性反应后获得猪蓝耳病病毒cDNA。反转录体系见表2,反转录条件见表3。

表2 反转录体系

表3 反转录条件
2.2.4 ORF6基因PCR扩增反应体系及条件 将以上反转录产物作为模板,用上、下游引物扩增目的基因片段,再添加Taq DNA酶、dNTP于PCR反应管中,用ddH2O 配平反应体系。然后将PCR反应管置于PCR扩增仪中,发生预变性、变性、退火、延伸、总延伸反应,同时经过30 个循环后,得到PCR产物。反应体系及条件见表4。
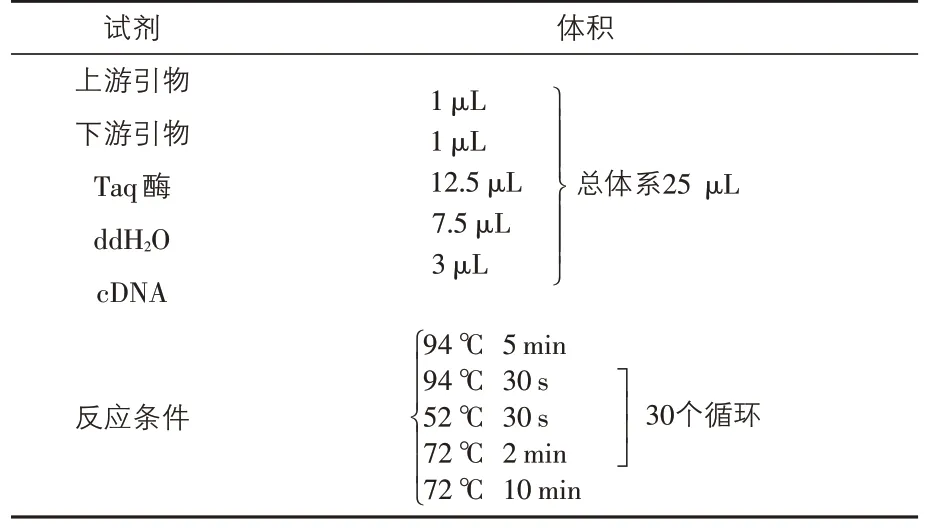
表4 PCR反应体系及条件
2.2.5 PCR 产物琼脂糖凝胶电泳 取0.4 g 琼脂糖加入40 mL 水配制成浓度为1%的凝胶,在微波炉上熔至清澈透明的溶液状。冷却到60 ℃左右,加入EB 染料,摇匀,倒入事先安装好的水平电泳槽内,凝胶厚度一般为3~5 mm,等到凝胶完全凝固后,室温下放置30 min。根据样品量选用梳子,在梳子齿附近加入少量电泳缓冲液,后缓慢轻轻地向上拔掉梳子,将凝胶放入电泳槽中,用移液器吸取样品注入孔内。给电泳仪通上电,30 min 后在凝胶成像系统中观察结果。
3 试验结果
3.1 猪血清蓝耳病ELISA 抗体检测结果 对未免疫的235 份血清样品进行ELISA 抗体检测,结果得出阳性149份,阴性52份,可疑34份,阳性率为63.4%。
3.2 猪蓝耳病RT-PCR 扩增结果 利用RTPCR方法对19份血液样本进行蓝耳病病毒检测,结果显示:19 份样本中只有367-8 号样本为阳性,其余18份样本均为阴性,阳性率为5.26%(见表5)。
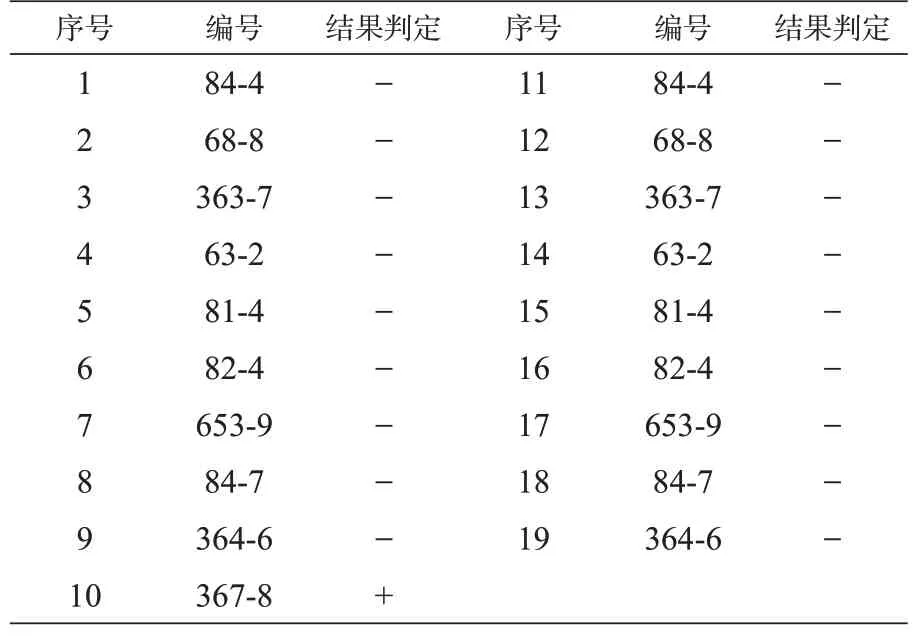
表5 猪蓝耳病RT-PCR扩增结果
4 讨论
4.1 Albina 等[2]用PRRSV 接种猪肺泡巨噬细胞(PAMs)培养病毒抗原,首次建立了检测PRRSV抗体的酶联免疫吸附试验,其特异性和敏感性高于过氧化物酶单层试验(IPMA)和间接免疫荧光法(IFA)。本试验也采用ELISA 方法对未免疫架子猪的血清进行(PRRSV)抗体检测。结果阳性有149份,阳性率为63.4%。刘琳[3]对中西部部分地区的未免疫规模化猪场进行PRRSV ELISA 抗体检测,得出阳性率为84.46%;郝中香等[4]对四川省某个未免疫规模化猪场的70 份血清进行PRRSV ELISA抗体检测,结果阳性率为90%。本试验对PRRSV的阳性检出率均低于上述报道,说明该场猪蓝耳病感染没有上述报道的严重,但阳性率仍然较高,达到63.40%,应引起猪场的高度重视。
4.2 RT-PCR 法被广泛应用于猪蓝耳病病毒的检测,目前已成为实验室诊断蓝耳病毒的主要手段。其主要优点是特异性强、灵敏度高,不用进行病毒分离鉴定,省时、省力。但是在临床实践中,越来越多的蓝耳病病毒开放阅读框(ORF)出现变异情况,针对不同开放阅读框设计的引物的特异性不强,RT-PCR 诊断结果的差异较大。在整个蓝耳病病毒基因组中,以ORF6 最为保守,可作为分子生物学鉴定的重要依据。因此,本试验选用ORF6 基因设计引物,对采集的血液样本进行RT-PCR 扩增,结果得出阳性率为5.26%。漆信桥[5]对四川省各地送检的100 份血清样本进行蓝耳病毒RT-PCR 检测,得出阳性率为34%;蒋刘柱[6]对四川绵阳地区部分疑似发病猪场的78 份样本进行蓝耳病毒RT-PCR 检测,得出阳性率为35.90%。本试验结果与上述报道相比,阳性检出率较低,其原因可能与检测样本较少,缺乏代表性,或感染时间较长,病毒血症状消失有关。
