山羊颈椎次全切除减压非融合后生物力学特性
2021-08-21梁宝宝黄思华臧全金贺西京
董 军,梁宝宝,黄思华,孙 园,杨 晓,张 瑛,刁 攀,臧全金,贺西京*
1.西安交通大学第二附属医院骨科,西安 710004
2.西安交通大学第二附属医院肿瘤科,西安 710004
颈椎次全切除融合术(ACCF)是治疗脊髓型颈椎病、后纵韧带骨化等疾病的常见术式,该手术通过颈前路将至少1个颈椎椎体于双侧钩椎关节以内进行部分切除,直达后纵韧带、硬膜,以实现对脊髓或神经根的彻底减压[1]。为重建颈椎的生物力学稳定性,在完成前路充分的减压后需置入钛笼或自体骨块至上述减压槽内,重建术后椎体的支撑功能,并将上下邻近椎体通过钛板固定,以期在后期实现颈椎的骨性融合[2]。因此,患者接受ACCF后也必然丧失至少2个节段的运动功能[3]。既往研究[4-6]发现,颈椎的C1/C2节段主要完成大部分的颈椎旋转功能,颈椎的C3/C4/C5/C6/C7节段除了完成部分旋转功能外更重要的是要实现前屈、后伸、左右侧曲及多维度的耦合运动。ACCF需要将2个相邻运动节段进行融合,这将对颈椎的正常活动产生显著影响[7-8]。有研究[9]发现,ACCF术后不仅导致融合节段的活动度(ROM)消失,更在一定程度上增加了加速邻近节段退行性变的风险,使患者后期面临二次手术的可能。
有学者在人工颈椎椎间盘(ACD)置换术中通过保留椎间隙的运动功能使患者术后颈椎ROM得到最大程度的恢复[10-11],但局限于其未重建椎体的有效高度,ACD无法应用于ACCF。为此,本课题组设想通过设计一种能够兼顾重建颈椎椎体高度和保留椎间运动功能的假体,以突破颈椎次全切除术后必须通过将上下邻近椎体融合而导致椎间ROM丧失这一困境。本课题组设计了一种用于颈椎次全切除后的可动人工颈椎(ACV)假体[12],前期的体外生物力学实验研究[13]表明,ACV在植入颈椎标本后能保留相应节段ROM。为深入了解ACV植入活体的可行性,本研究对山羊实施C4次全切除术,并将ACV植入C4,观察ACV是否具备重建活体动物椎体高度、恢复颈椎ROM的功能。
1 材料和方法
1.1 动物、仪器和软件
雄性山羊(西安交通大学第二附属医院外科动物中心;许可证号:XJTULAC2014-405);山羊用ACV假体若干套;电动吸痰器、电动负压吸引器(江西北环实业有限公司),常规手术器械及耗材;X线机(QDR-2000型;Hologic,美国),双轴伺服液压控制生物材料测试机(MTS 858型;MTS,美国),光电子三维运动捕捉系统(Optotrak Certus型;NDI,加拿大);MTS操作工作站,Optotrack Certus工作站,Matlab 软件。
1.2 ACV假体
ACV包括椎体部、2个椎间盘部件、4枚椎体固定钉,椎体部和椎间盘部之间有球窝关节(图1)。椎体部上下面顶端有一个球窝结构与椎间盘部的核心形成关节。椎体部侧面中部有5个大小不一的贯通孔,为植骨处。椎间盘部件下面的中部设有一中心高度为1 cm的圆顶关节头结构,被椎体部的浅球窝关节包绕,两者形成关节,假体的可动性即体现在此。椎间盘部的前侧有一个竖直的椎体固定板,固定板上有2个螺钉固定孔,孔道的方向与圆板呈斜向上角20°,2枚螺钉将椎间盘部固定于相应椎体。椎体部侧面和圆板上表面的终板结构为磨砂粗糙样。椎间盘部件的固定螺钉为前端尖头的自攻螺钉,螺钉直径为3.0 ~ 3.5 mm,固定螺钉的近螺帽端比其尖端略粗。椎体部长40 ~ 45 mm,横径为14 mm;上椎间盘部的圆板与竖直的椎体钉固定板之间角度为84°,下椎间盘部的圆板与竖直的椎体钉固定板之间角度为100°,以便与相应椎体终板密切贴合;上下椎间盘表面有倒齿结构,利于骨的成形。假体的椎间盘部和椎体之间在前屈、后伸、左右侧曲方向上各有6°的ROM,在轴向上有360°的ROM。

图1 山羊用ACV假体系统Fig. 1 ACV prosthesis system for goat
1.3 模型建立
6只山羊用于建立颈椎次全切除术后减压非融合模型(模型组)。山羊术前禁食48 h、禁饮8 h。取仰卧位,颈部适当垫高后用碘伏棉球消毒颈部皮肤,经耳缘静脉推注硫喷妥钠溶液(0.01 g/mL)。麻醉生效后,行X线检查排除颈椎骨性结构异常。消毒、铺巾后取右侧纵行切口分离颈部肌肉及软组织,暴露C3~5;以C3和C5正中嵴作为标志,在嵴上分别置入椎体撑开钉各1枚,咬除C4部分骨质,行椎体次全切除术。用髓核钳摘除C3/C4和C4/C5椎间盘,使减压槽的大小约为40 mm×15 mm×12 mm并保留咬除的骨质。在体外组装好ACV假体后,将上述骨质用咬骨钳咬碎后植入假体侧面的贯通孔中,将假体植入减压槽内,分别于C3、C5置入椎体固定螺钉各2枚(图2)。术中进行肌电图监护。
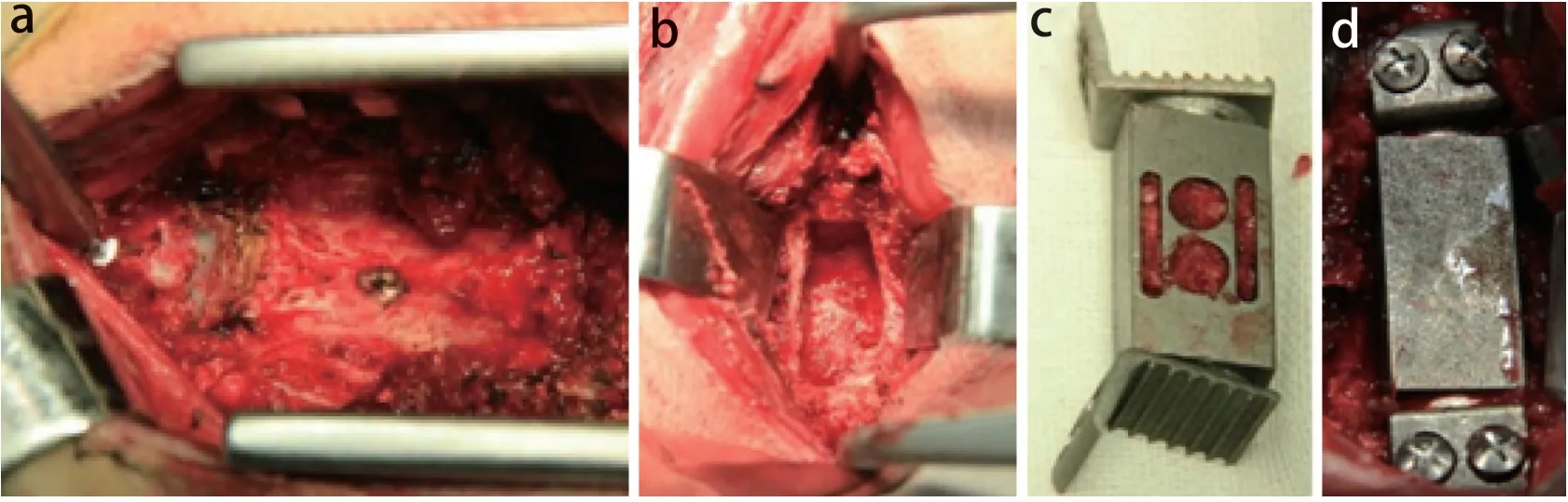
图2 ACV植入山羊C4 Fig. 2 Process of implanting ACV into goat C4
1.4 影像学检查
分别于术前及术后3 h行X线检查,测量节段性Cobb角(SCA)和颈椎Cobb角(CCA),测量方法见图3。
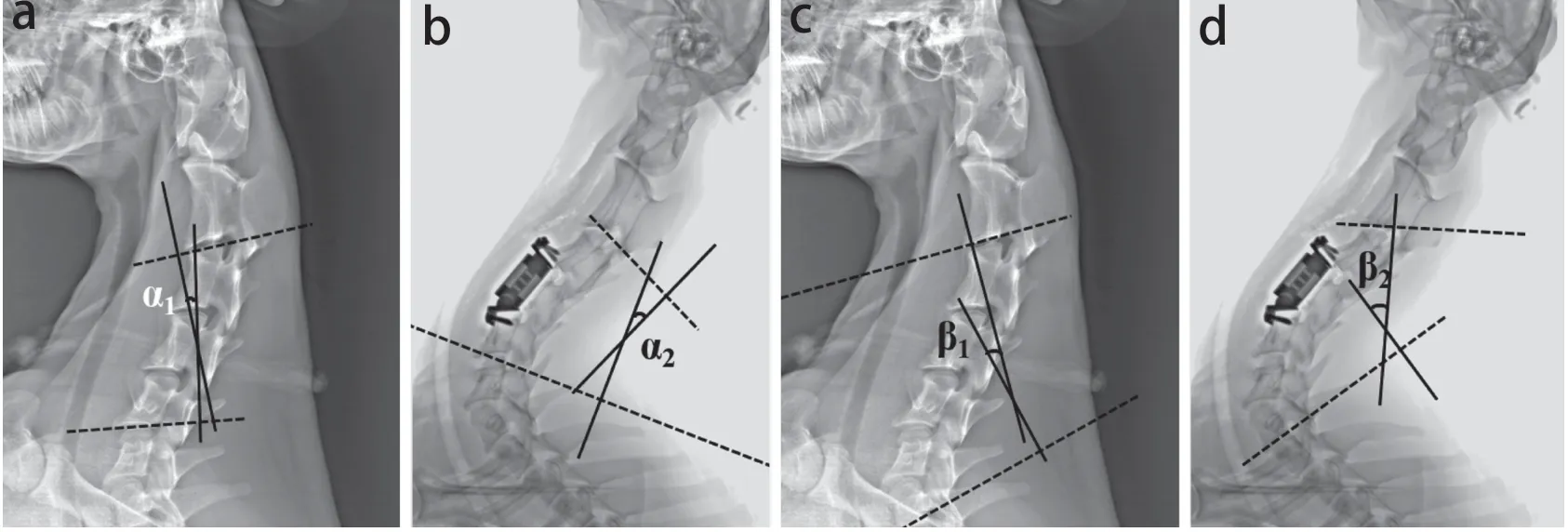
图3 山羊颈椎手术前后SCA和CCA测量Fig. 3 Measurements of SCA and CCA before and after operation
1.5 颈椎ROM测量
选取同一饲养条件下年龄和体质量相匹配的正常山羊6只作为对照组。模型组和对照组山羊均按照西安交通大学医学伦理委员会指导章程规定进行安乐死,经颈部前方咽下做横行切口,切开皮肤,离断肌肉、食管、气管至枕颈结合处,切开枕颈关节囊及周围韧带。分离C7~ T1处肌肉软组织,仔细剔除标本附着的脂肪、肌肉等软组织,保留关节突关节和周围韧带的完整性。将所得标本置于密封塑料袋中,保存于-20℃恒温实验冰箱内。
生物力学实验开始前24 h将标本放在装有相变蓄冷剂的泡沫保温盒内缓慢解冻,并用干燥纱布吸除表面多余水分。用若干长度约为30 mm的螺钉将标本的C1与C2、C6与C7分别固定。将标本一端置于包埋缸内,保持标本竖直且位于包埋缸的中心位置。将N-(3-二甲基氨基丙基)-1,3-丙二胺和双酚A-(环聚氯丙烷)环氧树脂按照1∶1充分混合后倾倒于包埋缸内,注意保持标本静止且竖直;待上述包埋剂凝固后,将标本固定于MTS生物材料测试机上,然后再固定另一端,使标本最终位于2个包埋缸的中心位置。待包埋剂凝固后,连同包埋缸取下标本,分别将含有4个发光二极管的标记点紧密固定于C4、C5、C6和C7(共16个,图4);该发光二极管能主动发出红外光,测试过程中其空间位置能被Optotrack Certus捕捉并记录。

图4 新鲜山羊颈椎标本颈椎ROM测试Fig. 4 ROM testing of fresh goat cervical specimen
分别调试MTS操作工作站和Optotrack Certus工作站;调试完毕后将标本固定于MTS测试机上,标本尾端固定(C6/C7),MTS机于头端(C1/C2)施加1.5 N·m的力矩,使标本产生前屈后伸、左右侧曲、左右旋转运动;在标本被动运动过程中,MTS测试机记录力矩和标本整体瞬时角度的变化,Optotrack Certus记录发光二极管的瞬时空间位置;瞬时空间位置经Matlab程序转换为椎体ROM。MTS测试机施加5个循环,选取每具标本后3个循环平均值作为测量结果。在测试过程中用湿生理盐水纱布包裹标本,保持标本湿润。
1.6 统计学处理
采用SPSS 19.0软件对数据进行统计分析。计量资料以±s表示,组内手术前后数据比较采用配对样本t检验,组间数据比较采用独立样本t检验或非参数检验;以P< 0.05为差异有统计学意义。
2 结 果
2.1 模型建立情况
模型组山羊年龄为(18.0±1.6)个月,体质量为(33.2±3.8)kg;对照组山羊年龄为(17.8±1.2)个月,体质量为(33.5±3.1)kg。2组山羊年龄和体质量差异均无统计学意义(P> 0.05),具有可比性。模型组手术过程顺利,硫喷妥钠使用量为(46.8±16.2)mL,出血量为(286.7±101.7)mL,液体输入量为(2 005.8±616.2)mL,手术时间为(140.5±26.5)min。麻醉恢复后山羊均二便正常,四肢无功能障碍,完全站立后腹胀短期内消失且饮食正常;术后14 d伤口完全愈合,无伤口及肺部感染征象。
2.2 影像学检查结果
模型组山羊术后颈椎X线检查证实ACV植入在C4水平,假体尺寸合适、位置良好,未见假体脱位或断裂(图5)。术前SCA和CCA分别为10.8°±0.9°和21.8°±0.5°,术后SCA和CCA分别为10.7°±0.9°和21.5°±1.5°,手术前后SCA和CCA差异均无统计学意义(P> 0.05)。

图5 ACV植入术后X线片Fig. 5 Roentogenographs after ACV implantation
2.3 颈椎ROM
术后6个月,2组颈椎标本ROM测量结果见表1。C2/C3左侧曲、C3/C4右侧曲和右旋、C4/C5前屈和左旋、C2/C5右旋,组间比较差异有统计学意义(P< 0.05),其他方向ROM差异均无统计学意义(P> 0.05)。
表1 模型组和对照组颈椎ROMTab.1 Cervical ROM of model and control groups n=6,±s
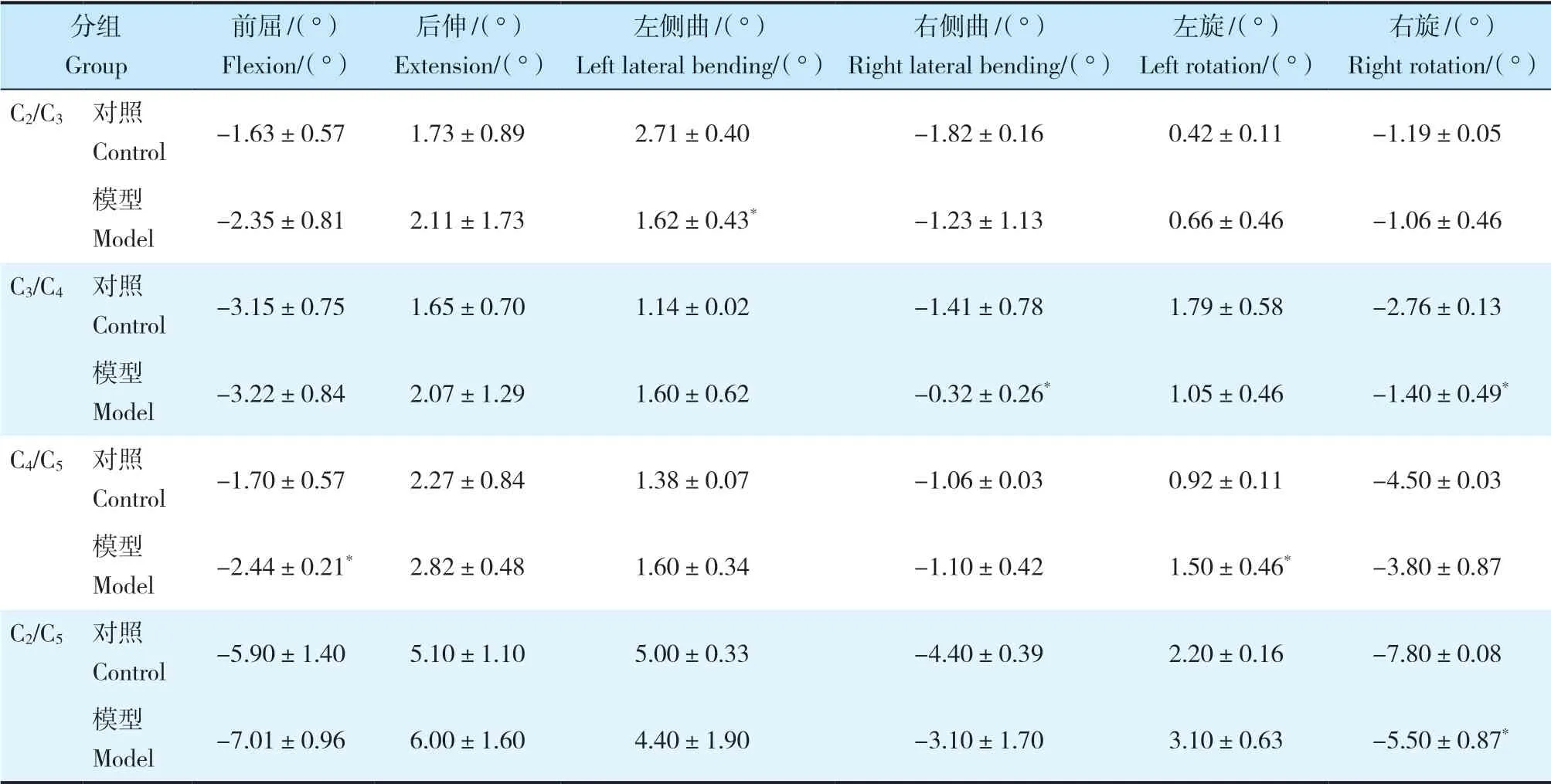
表1 模型组和对照组颈椎ROMTab.1 Cervical ROM of model and control groups n=6,±s
注:*与对照组比较,P < 0.05。Note:* P < 0.05,compared with control group.
右旋/(°)Right rotation/(°)C2/C3 对照Control -1.63±0.57 1.73±0.89 2.71±0.40 -1.82±0.16 0.42±0.11 -1.19±0.05模型Model -2.35±0.81 2.11±1.73 1.62±0.43* -1.23±1.13 0.66±0.46 -1.06±0.46 C3/C4 对照Control -3.15±0.75 1.65±0.70 1.14±0.02 -1.41±0.78 1.79±0.58 -2.76±0.13模型Model -3.22±0.84 2.07±1.29 1.60±0.62 -0.32±0.26* 1.05±0.46 -1.40±0.49*C4/C5 对照Control -1.70±0.57 2.27±0.84 1.38±0.07 -1.06±0.03 0.92±0.11 -4.50±0.03模型Model -2.44±0.21* 2.82±0.48 1.60±0.34 -1.10±0.42 1.50±0.46* -3.80±0.87 C2/C5 对照Control -5.90±1.40 5.10±1.10 5.00±0.33 -4.40±0.39 2.20±0.16 -7.80±0.08模型Model -7.01±0.96 6.00±1.60 4.40±1.90 -3.10±1.70 3.10±0.63 -5.50±0.87*分组Group前屈/(°)Flexion/(°)后伸/(°)Extension/(°)左侧曲/(°)Left lateral bending/(°)右侧曲/(°)Right lateral bending/(°)左旋/(°)Left rotation/(°)
3 讨 论
对于颈椎非融合假体而言,假体植入后不仅需要完成重建椎体及椎间盘高度,同时还需重建颈椎生物力学稳定性,为后期脊髓及神经功能的恢复提供良好的环境。考虑到山羊与人颈椎解剖学上的差异,本课题组设计了专用于重建山羊颈椎次全切除术后非融合的ACV假体。其基本构造与人用假体类似,同样具有浅球窝关节,能完成前伸后屈、左右侧曲方向上6°的运动及轴向上360°的旋转。与人用假体所不同的是,为充分估计山羊颈椎椎间隙的特殊性,该假体系统的上下椎间盘部的螺钉固定板与终板分别呈一定角度,以使假体与上下椎体紧密贴合。另外,4枚椎体自攻钉的长度相对人用螺钉较长,具有更强的把持力。本研究中椎间盘部前方设计有类似钢板的结构,通过上下4枚螺钉将ACV的椎间盘部固定于C3和C5,使ACV的运动部分位于C3/C4、C4/C5椎间隙。
X线检查显示山羊术前和术后SCA和CCA差异无统计学意义,提示ACV植入后对山羊颈椎曲度无明显影响。术后山羊生命体征平稳并能正常进食、饮水,说明山羊食管和气管通畅,提示手术过程安全。根据脊柱的三柱理论,前中柱为脊柱的主要稳定性结构[14],因此,完成前中柱的重建是维持脊柱生物力学稳定性的主要手段。术后X线检查可见ACV的尺寸合适、位置正确,提示前中柱得到重建。
术后颈椎ROM测试提示模型组各节段各方向ROM与对照组基本类似,提示该假体能在很大程度上保留颈椎活动功能。但同时在某些方向上,模型组存在ROM不足或偏大的情况。造成模型组中C2/C3左侧曲、C3/C4右侧曲和右旋的ROM低于对照组的原因可能为假体可动部分被软组织包绕,使假体球窝内存在软组织嵌入,这在后期的标本解剖过程中得到证实;而C4/C5前屈和左旋ROM高于对照组的原因是假体在植入过程中可能没有完全放置到椎体正中,使假体的可动部分在1.5 N·m测试条件下呈现轻度半脱位状态,提示假体需进一步改进,且在手术过程中力争精准安放。同时,结果还显示模型组C2/C5右旋ROM低于对照组,其可能原因:①颈椎实际活动过程是多方向上的耦合运动,假体长期体内植入后可能存在轻度松动,造成假体位置偏斜;②假体植入后局部椎间隙可能存在骨赘,后者影响了个别节段的ROM,这在后期标本解剖过程中得到证实。
综上所述,本研究通过植入一种既能重建颈椎稳定性又能保留椎间运动功能的ACV,成功建立了颈椎次全切除减压非融合山羊模型。对该模型的术后影像学评估发现,术后颈椎解剖径线无显著变化,提示该假体能在椎体次全切除术后重建颈椎的高度且对相应节段的脊髓无损伤。术后颈椎ROM测试发现,假体植入后可很大程度上保留颈椎椎间的活动功能,但同时在某些方向上存在ROM不足或偏大的情况,提示后期假体需进一步改进。本研究存在以下不足,为灵活掌握术中前路固定螺钉的方向,该系统的前路固定螺钉采用了非自锁式固定螺钉,该固定方式有螺钉拔出的风险,后期需进一步改善假体的固定方式;本研究仅采用X线检查评价假体植入的功能,今后还需长期观察并动态了解内固定和脊髓之间的关系。
