右美托咪定对肠源性脓毒症大鼠肠屏障功能保护及抗凋亡作用的机制研究*
2021-08-20马四清
徐 颖,马四清
(青海省人民医院重症医学科,西宁 810007)
脓毒症是一种因患者全身出现的恶性炎症反应状态,主要由于各种感染、创伤、外科手术等反复刺激导致机体产生大量炎性因子。脓毒症患者的病情多变且不稳定,脓毒症后肠腔内的细菌和大量释放的内毒素可以激活肠道免疫细胞,释放出多种炎症介质导致肠粘膜损伤,随着病情的进一步发展可能会出现多器官功能衰竭[1-2]。右美托咪定(dexmedetomidine,DEX)是目前比较常用的一种新兴的镇静镇痛药,主要应用于术后镇痛、麻醉等[3-4]。既往研究显示,DEX还具有抗炎症、抗凋亡的作用,可以减轻脓毒症患者的炎症性损伤[5],但目前关于DEX 在保护脓毒症患者肠道功能中的作用机制尚不明确。本研究拟复制大鼠脓毒症模型,探讨DEX保护脓毒症大鼠肠屏障功能,抗肠道细胞凋亡的作用机制,为进一步使用DEX治疗脓毒症提供实验和理论依据,现将结果报道如下。
1 材料与方法
1.1 动物来源 SPF 级SD 大鼠60 只,购自广东医学院实验动物中心,粤监证字2004A029 号,所有大鼠均在本院动物中心实验室饲养,饲养温度20~25 ℃,相对湿度50%~65%,该实验经过动物伦理委员会批准同意。
1.2 药物与试剂 盐酸DEX 注射液(国药准字:H20 090248;生产厂家:江苏恒瑞医药股份有限公司)购自武汉大学人民医院;中性福尔马林、酒精、二甲苯购自天津科密欧有限公司;Caspase-3 抗体(批号:31A1067201806)购自碧云天公司;Bcl-2 抗体(货号:sc-7382;批号:20190201)、Bax抗体(货号:sc-7480;批号:20190301)购自美国Santa Cruz Biotechnology 公司;HRP 羊抗兔IgG、HRP 羊抗鼠IgG等二抗购自美国Thermo 公司;肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)ELISA 试剂盒购自武汉贝茵莱生物科技有限公司;二胺氧化酶(diamine oxidase,DAO)及D-乳酸测定试剂购自美国Sigma公司。
1.3 仪器 722分光光度计购自上海第三分析仪器制造厂;全自动脱水机购自湖北孝感医用电子技术有限公司;病理切片机购自德国Leica公司;BS-124s型电子天平购自北京赛多斯仪器系统有限公司;3-5w低温离心机购自湖南恒诺离心机有限公司;SG-51正置型金相显微镜购自上海光学仪器厂;蛋白电泳及转膜仪购自美国Bio-Rad 公司;凝胶成像系统购于以色列DNR公司;LD-66实验室切片机购自长沙益广制药机械公司。
1.4 分组及建立模型 将60 只大鼠适应性喂养1周,按随机数字表法将大鼠分为空白对照组(Control)、模型组(Model)、低剂量DEX组(5 μg/kg)和高剂量DEX 组(10 μg/kg),每组15 只;除空白对照组外,其余45 只大鼠制备脓毒症模型,制作方法及判断模型是否成功参考付晓菲等[6]研究。具体操作:使用10%的水合氯醛麻醉,采用盲肠结扎穿孔术,导致大鼠形成脓毒症,脐上沿中线开腹1~2 cm 使得大肠暴露,结扎距盲端约2 cm,使用针在结扎肠断贯穿3 次,并挤出肠溶物后将盲肠收回。空白对照组仅仅开肠暴露盲肠后收回,消毒、缝合。
1.5 药物干预 制作完大鼠脓毒症模型1 h后通过尾静脉注射DEX,低剂量DEX 组注射速率为5 μg/kg·h-1,分别在术后1 h和术后6 h注射两次,1 h/次,注射总量为1 mL;高剂量DEX组注射速率为10 μg/kg·h-1,分别在术后1 h和术后6 h注射两次,1 h/次;模型组和空白对照组注射等量的生理盐水。
1.6 苏木精—伊红(HE)染色观察大鼠肠组织病理学改变 药物处理24 h 后,放血处死大鼠,取大鼠血液,保存于-80 ℃冰箱中国以供后期使用;取大鼠距回盲瓣5 cm处取大鼠小肠组织约0.5~1 cm,生理盐水洗净,10%的多聚甲醛固定45 h,然后使用乙醇梯度脱水,二甲苯透明,石蜡包埋。HE染色,在10×20的光镜下观察大鼠肠组织病理学改变。
1.7 分光光度法检测DAO、D-乳酸 使用分光光度法检测DAO、D-乳酸含量水平,取大鼠血液标本,在4 ℃条件下,以3 000 r/min 的转速离心5 min,使用分光光度法测定血清中DAO活性,测定紫外波长为436 nm处的吸光值(OD),以DAO标准液不同浓度测出的值为X轴,相对OD值为Y坐标,做曲线得出回归方程,算出大鼠血液标本中DAO 含量水平;计算D-乳酸含量水平时分光光度计测定340 nm 处的OD值,以D-乳酸标准液不同浓度值为X轴,相对应的OD值为Y作标准曲线,得出回归方程,计算出大鼠血液标本中D-乳酸含量水平。
1.8 ELISA 法检测 取大鼠血液标本在4 ℃条件下,以3 000 r/min的转速离心5 min,严格按照TNFα及IL-6试剂盒子上的操作方法,检测其含量水平。
1.9 Western blotting 检测蛋白表达水平 使用Western blotting检测Caspase-3、Bax、Bcl-2蛋白表达水平,取大鼠肠组织,使用剪刀剪碎后使用胰蛋白酶消化后,提取总蛋白,使用半干法将蛋白转移到PVDF 膜,置于5%脱脂奶粉室温封闭2 h 后加入各需要检测蛋白的一抗(1∶1 000),二抗(1∶5 000),孵育2 h,以β-actin 为内参蛋白,采用显色液显色后行吸光度分析,计算各蛋白相对表达量。
1.10 统计学方法 采用SPSS 22.0 统计软件进行数据分析,计量资料以均数±标准差()表示,多组均数比较采用单因素方差分析,多组间两两比较采用LSD-t检验,偏态分布计量资料以中位数(四分位数)[M(P25~P75)]表示。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肠组织病理学观察结果 空白对照组大鼠小肠组织结构完成,无水肿,绒毛形态正常;模型组小肠组织混乱,出现间质水肿,绒毛排列紊乱,上皮细胞脱落,有大量的中性粒细胞浸润;使用DEX处理后的两组水肿明显的到改善,有少量上皮细胞脱落,小肠绒毛排列也较为整齐,见图1。
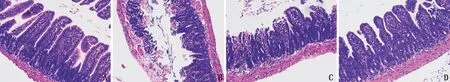
图1 大鼠肠组织病理学观察结果(×200)
2.2 大鼠DAO及D-乳酸检测结果 与空白对照组比较,模型组大鼠DAO 活性及D-乳酸水平显著升高(P<0.01);与模型组相比,低剂量DEX 组大鼠DAO 活性及D-乳酸水平显著降低(P<0.01);与低剂量DEX组相比,高剂量DEX组大鼠DAO 活性及D-乳酸水平著降低(P<0.01),见图2。
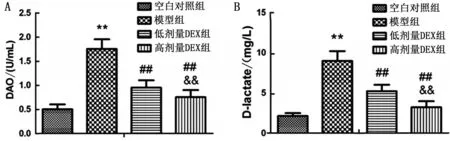
图2 大鼠DAO及D-乳酸检测结果
2.3 大鼠血清炎症因子检测结果 与空白对照组比较,模型组大鼠血清TNF-α和IL-6水平显著升高(P<0.01);与模型组比较,低剂量DEX 组大鼠TNF-α 和IL-6 水平显著降低(P<0.01);与低剂量DEX 组比较,高剂量DEX 组大鼠TNF-α 和IL-6 水平为显著降低(P<0.01),见图3。
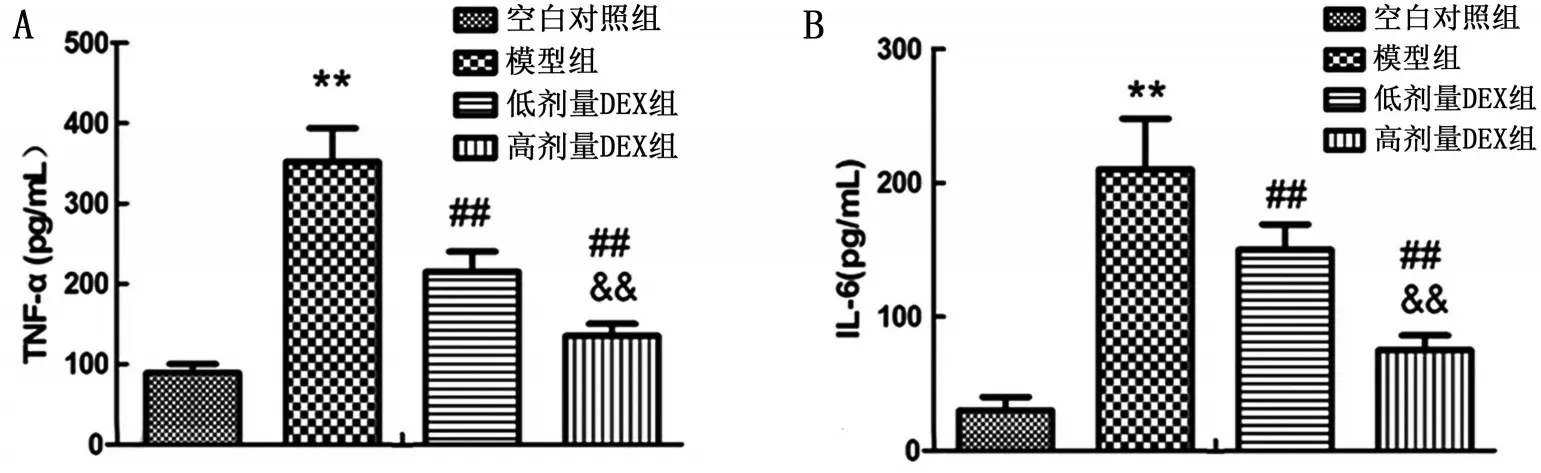
图3 大鼠血清炎症因子检测结果
2.4 大鼠凋亡蛋白检测结果 与空白对照组比较,模型组大鼠肠组织Bcl-2蛋白相对表达量显著降低(P<0.01),Bax 及Caspase-3 蛋白相对表达量显著升高(P<0.01);与模型组相比,低剂量DEX组大鼠肠组织Bcl-2 蛋白相对表达量显著升高(P<0.01),Bax 及Caspase-3 蛋白相对表达量和显著降低(P<0.01);与低剂量DEX 组相比,高剂量DEX 组大鼠Bcl-2蛋白相对表达量显著升高(P<0.01),Caspase-3蛋白相对表达量水平显著降低(P<0.01),见图4。
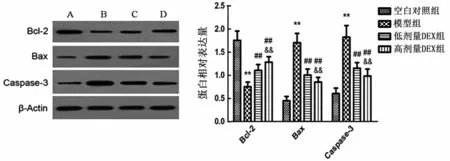
图4 大鼠凋亡蛋白检测结果
与空白对照组相比,**P<0.01;与模型组相比,##P<0.01;与低剂量DEX组比较,&&P<0.01;A:大鼠血清TNF-α含量水平;B:大鼠血清IL-6含量水平。
3 讨论
脓毒症发病初期会伴随着肠黏膜病理形态学变化,发生脓毒症肠道上皮细胞会发生凋亡并脱落,间质会出现水肿同时肠道绒毛也会出现排列紊乱,肠道黏膜通透性也会发生一定的改变[7]。本研究发现,与模型组相比,使用DEX 组大鼠水肿明显得到改善,有少量上皮细胞脱落,小肠绒毛排列也较为整齐。说明DEX可以有效患者小肠的损伤,同时抑制肠道上皮细胞的凋亡和脱落,改善脓毒症大鼠肠道功能。李旷怡等[8]研究表明,抑制脓毒症大鼠肠道黏膜凋亡可以有效缓解脓毒症症状,与本研究得出的结论相一致。
DAO 主要存在于类和哺乳动物小肠绒毛上皮细胞中,可以参与绒毛上皮细胞内核酸与蛋白质的生成,并维持细胞内Ca2+的浓度平衡减少氧化应激损伤[9]。当肠道功能受到损伤后原本存在于肠道上皮细胞中的DAO 会随着上皮细胞凋亡和脱落进入肠道,使得肠腔内的DAO活性上升,肠黏膜的DAO活性降低,使得肠黏膜的通透性改变。故DAO的含量可以反应肠道损伤的严重程度,其含量水平越高说明肠道损伤越重[10]。D-乳酸含量水平也是衡量肠道功能的重要指标之一[11]。人和动物机体本身不能产生D-乳酸,D-乳酸是肠道内细菌进行无氧酵解后的产物,当肠道功能受损后肠道内病原微生物大量生长繁殖,使得D-乳酸含量水平增加。故D-乳酸含量水平越高,说明肠道内病原微生物越多,血清内D-乳酸含量水平越高说明肠道黏膜通透性改变越大,肠黏膜功能受损越严重。本研究发现,与模型组相比,使用DEX 处理各组大鼠DAO 活性及D-乳酸含量水平显著降低,说明DEX可以有效改善肠道黏膜的通透性,并有效降低肠道内的病原微生物越多,缓解肠道的损伤。郑君刚等[12]研究显示,DEX可以发挥镇静作用,抑制脓毒症患者的应激反应失控,减轻炎症反应,保护脓毒症患者的肠屏障功能,提示DEX可能通过发挥镇静抗炎作用,缓解脓毒症大鼠肠道组织损伤,但其具体的机制有待于进一步深入探索。
脓毒症的发病机制较为复杂,目前多数观点认为脓毒症主要是由于感染导致身性炎症反应,过多的炎症介质会导致器官损伤,致使多器官衰竭死亡[13]。因此,控制炎症反应是治疗脓毒症的关键因素之一。目前常见的炎症因子包括TNF-α、IL-1、IL-6 和IL-8 等[14]。TNF-α 可以引起机体产生代谢性应激反应,并导致代谢产物含量增多使得局部炎性介质大量合成[15]。同时,IL-6 也有促进组织中基质金属蛋白酶家族蛋白、前列腺素等炎症物质产生和表达的作用,从而加速炎性反应进程。本研究发现与模型组相比,使用DEX 组大鼠DAO 活性及D-乳酸含量水平显著降低,说明DEX可以有效降低机体的炎症反应,同时抑制炎症介质的释放,有效保护炎症介质对致器官的损伤。本研究以上结果的变化可能是因为DEX可以通过降低炎性介质的释放,缓解肝窦扩张、中央静脉淤血,促进肝组织的排毒,降低肠道内的内毒素含量水平,从而减轻肠道损伤。Pott等[16]研究表明,TNF-α还可以诱导死亡受体途径介导的凋亡,诱导结肠炎大鼠肠上皮细胞凋亡,导致肠黏膜屏障功能下降,提示DEX可能通过抑制炎症介质释放,保护肠道功能。
肠道上皮细胞的凋亡及脱落是影响肠道功能的重要因素,而细胞的凋亡受到相关基因的调控。Caspase 家族蛋白在细胞凋亡信号传递和凋亡执行过程中的重要蛋白,当细胞凋亡途径激活后,上游信号经传递能够激活下游caspase-9的活化,放大凋亡信号,激活caspase-3,而凋亡信号一旦传递到caspase-3蛋白活化,细胞凋亡进入不可逆阶段[17-18]。除了Caspase 家族,Bcl-2 家族也是一种常见的凋亡控制基因。Bcl-2家族中主要是由Bcl-2和Bax这两种蛋白表达量决定细胞是否凋亡[19-20]。Bax和Bcl-2表达呈相反趋势,当Bcl-2 表达下降时Bax 表达上升,此时会促进细胞的凋亡;当Bcl-2 表达升高,而Bax表达降低时,则会抑制细胞的凋亡[21]。本实验中可以看出,与模型组相比,使用DEX 处理各组大鼠肠组织Bcl-2 蛋白表达显著升高,Bax 及Caspase-3 蛋白表达水平显著降低(P<0.05)。说明DEX可以通过抑制凋亡蛋白的表达,升高抑制凋亡蛋白的表达实现抑制肠道上皮细胞的凋亡。邓丽静等[22]研究表明,DEX 可以通过抑制肠细胞及免疫细胞的凋亡,本研究结果与其部分一致,提示DEX可可能通过抑制肠道细胞凋亡,发挥肠道保护。
综上所述,DEX可以降低肠源性脓毒症大鼠血清中过高的炎性因子,保护肠道黏膜,抑制肠道细胞的凋亡,减轻肠道肠道组织损伤。但本实验涉及到的样本量较少,本研究仅初步探讨了DEX缓解肠源性脓毒症大鼠肠道组织损伤的可能机制,其具体的机制在后续实验将进一步验证。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*
