携带角质细胞生长因子和低氧诱导因子-1α双基因减毒沙门菌的遗传稳定性
2021-08-19李欣魏静蒋如如哈小琴
李欣,魏静,蒋如如,哈小琴
1.甘肃中医药大学临床医学院临床检验诊断学,甘肃 兰州 730030;2.中国人民解放军联勤保障部队第九四○医院检验科,甘肃 兰州 730050;
20世纪70年代提出了基因治疗的方法,近年逐步显示出良好的临床效果。多数情况下,基因治疗是将遗传物质导入靶细胞以达到治疗目的[1]。基因治疗由于少数患者出现严重副作用,使其应用受限,随着对基因相关分子和细胞机制的深入了解,研发了复杂的基因转移工具,极大提高了基因治疗的安全性和治疗效果[2]。
减毒沙门菌作为基因治疗的活载体,具有巨大的研发潜力,在人类和兽医学中应用广泛,随着对细菌的遗传学、生物学和致病机理的深入了解,使针对特定应用沙门菌构造的设计更合理[3]。本实验采用的减毒沙门菌为减毒伤寒沙门菌Ty21a,是目前唯一用于制备人类疾病预防产品的减毒疫苗株,可提高机体免疫力,安全性较高[4]。Ty21a的致病性虽较低,但仍具有较高的侵袭性,口服后可在胃肠道黏膜定植[5]。针对该特性,本课题组前期实验将角质细胞生长因子(keratinocyte growth factor,KGF)及低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)基因连接至质粒p IRES-SEQ中,构建重组质粒p IRESHIF-IRES-KGF,电转入减毒沙门菌Ty21a中,成功构建了携带KGF及HIF-1α双基因的减毒沙门菌(Ty21a-pIRES-HIF-KGF,TPKH)。KGF可促进上皮细胞增殖,具有维持和恢复受损伤胃肠黏膜的完整性的作用[6];HIF-1α可使缺氧组织细胞保持一定的氧浓度,使细胞能耐受低氧状态而存活[7]。由于质粒p IRES-SEQ含有氨苄青霉素(Amp)基因位点,TPKH既可在Amp(+)LB平板上生长,以此筛选阳性菌落,又可在Amp(-)LB平板上生长。本实验通过目的基因片段的大小和目的蛋白的表达水平来评价TPKH的遗传稳定性,为后续大量生产提供实验依据。
1 材料与方法
1.1 菌株及细胞 携带KGF和HIF-1α双基因的TPKH由甘肃省干细胞与基因药物重点实验室提供;大鼠小肠上皮隐窝细胞(intestinal crypt cells,IEC-6)购自中国科学院上海细胞库;Ty21a菌株购自中国食品药品检定研究院。
1.2 主要试剂 Premix TaqTM、DNA marker DL2000及500 bp DNA marker购自日本TaKaRa公司;琼脂糖、TAE电泳缓冲液及质粒小提试剂盒购自北京索莱宝科技有限公司;SuperRed/GelRed核酸染色液购自北京白鲨生物技术有限公司;氨苄西林钠购自石家庄华北制药集团;鼠KGF及鼠HIF-1αELISA试剂盒购自上海江莱生物有限公司;革兰染色液购自珠海贝索生物技术有限公司;杜氏磷酸盐缓冲液(D-PBS)购自美国Gibco公司。
1.3 菌株传代 取100μL初始代TPKH菌株,接种于10 mL的LB培养液中,于37℃恒温振荡器中培养至A600约0.6时,取100μL菌液,采用四区划线法分别涂布于Amp(+)和Amp(-)的LB固体培养板上,置37℃孵箱中培养24 h;分别取生长良好的单克隆菌落,置10 mL Amp(+)和Amp(-)的LB液体培养基中,于37℃恒温振荡器中培养至A600约0.6,即为第1代菌株。按该方法连续传40代。
1.4 菌体及菌落形态观察 肉眼观察10、20、30、40代菌落形态。同时取1滴0.9%氯化钠溶液置于盖玻片上,用接种环挑取10、20、30、40代菌落,加入0.9%氯化钠溶液中,制作涂片,置酒精灯上方快速过3次,固定,进行革兰染色,立即镜下观察。
1.5 菌落P C R检测 挑取5、10、15、20、25、30、35、40代菌落至0.2 mL PCR管中,加入10μL灭菌蒸馏水,混匀,盖紧。100℃煮沸5 min,-20℃冷冻5 min,重复2次。2 795×g离心5 min,取上清,作为DNA模板,进行目的基因和真核表达启动子CMV的扩增。启动子CMV上游引物:5′-CCCAGTACATGACCTTATGGG-3′,下游引物:5′-GGAGACTTGGAAATCCCC-GT-3′,扩增产物大小为140 bp;KGF基因上游引物:5′-TGATCTAGAATGAGCTATGATTACATGGAAG-3′,下游引 物:5′-GACGCGGCCGCTTAAGTGATTGCCATAGGCAG-3′扩增产物大小为443 bp;HIF-1α基因上游引物:5′-CATGCTAGCCACCGATTCACCATGGAGGGC-3′,下游引物:5′-GTCACGCGTTCAGTTAACTTGATCC-AAAGCTCTG-3′,扩增产物大小为2 492 bp。PCR反应体系为:Premix Taq 25μL,cDNA模板1μg,上、下游引物各1μL,灭菌蒸馏水补充至50μL。PCR扩增条件为:95℃30 s,55℃30 s,72℃1 min,共30个循环。PCR产物经1%琼脂糖凝胶电泳检测。
1.6 质粒浓度及纯度的测定 取10、20、30、40代菌落各1 mL,用质粒提取试剂盒提取质粒,通过紫外分光光度计测定A260及A280值,计算浓度和纯度。
1.7 转染时间对I E C-6细胞中K G F和H I F-1α蛋白表达水平影响的检测 将初始代TPKH和Ty21a菌落分别接种于10 mL LB Amp(+)和Amp(-)液体培养基中,37℃恒温摇床中培养至A600为0.6时,2 795×g离心10 min,D-PBS洗涤3次,调整菌液浓度为1×108cfu/mL。将1×106个IEC-6细胞接种于25 cm2细胞瓶中,待细胞贴壁后,分别接种TPKH和Ty21a菌株,同时设PBS组,于37℃孵育2 h;弃菌悬液,D-PBS洗涤3次,加入含10 ng/mL庆大霉素的DMED培养基,继续培养1 h;D-PBS洗涤3次,加入含青-链霉素双抗的完全培养基,继续培养,于培养12、24、48、72 h时,采用鼠KGF及HIF-1αELISA试剂盒分别检测KGF和HIF-1α蛋白的表达水平。
1.8 T P KH代次对I E C-6细胞中K G F和H I F-1α蛋白表达水平影响的检测 取初始代、10、20、30、40代TPKH菌落,按1.7项方法接种至IEC-6细胞,同时设PBS组,培养48 h,采用鼠KGF及HIF-1αELISA试剂盒分别检测KGF和HIF-1α蛋白的表达水平。
1.9 统计学分析 应用SPSS 19.0统计软件进行统计学分析,试验结果均采用均值±标准差()表示,组间比较采用单因素方差(One-Way ANOVA)分析,以P<0.05为差异有统计学意义。
2 结果
2.1 菌体及菌落形态 10、20、30和40代TPKH在Amp(+)和Amp(-)LB平板上的菌落形态基本一致,均为边缘整齐,淡黄色、半透明,光滑湿润的圆形菌落,均为革兰阴性,见图1和图2。
图1 Amp(+)培养基中各代TPKH菌落及菌体形态Fig.1 Morphology of TPKH of various passages in Amp(+)medium

图2 Amp(-)培养基中各代TPKH菌落和菌体形态Fig.2 Morphology of TPKH of various passages in Amp(-)medium
2.2 菌落P C R在Amp(+)和Amp(-)的LB平板上培养的TPKH菌落,均可扩增出140、443及2 492 bp的CMV、KGF及HIF-1α基因片段,大小与预期一致,见图3和图4。表明TPKH在传代过程中无质粒丢失现象,可稳定遗传。
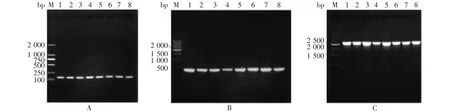
图3 Amp(+)培养基中各代TPKH菌落PCR产物电泳图Fig.3 Electrophoretic profile of colony PCR products of TPHK of various passages in Amp(+)medium

图4 Amp(-)培养基中各代TPKH菌落PCR产物电泳图Fig.4 Electrophoretic profile of colony PCR products of TPHK of various passages in Amp(-)medium
2.3 质粒浓度及纯度TPKH菌株在Amp(+)和Amp(-)培养基的传代过程中,质粒p IRES-HIF-IRES-KGF的浓度及纯度均较稳定,无明显降低,见表1。
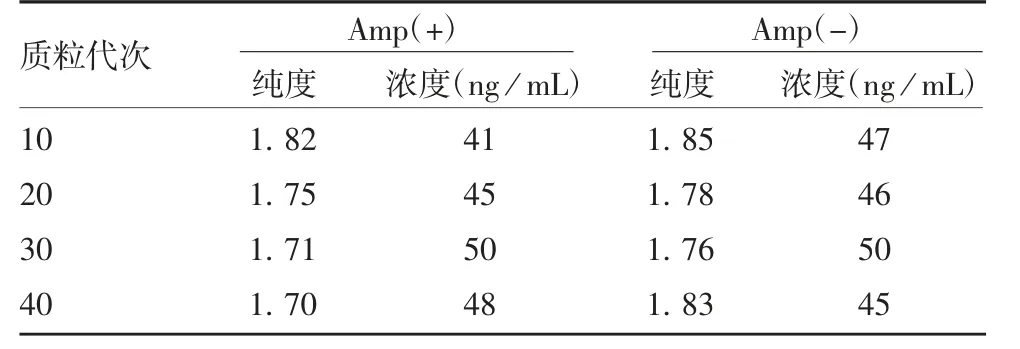
表1 各代TPKH菌落中质粒的浓度及纯度Tab.1 Concentration and purity of plasmid in TPKH colonies of various passages
2.4 转染时间对I E C-6细胞中K G F和H I F-1α蛋白表达水平的影响 与PBS组和Ty21a组比较,TPKH组IEC-6细胞中KGF蛋白表达水平在转染后12 h显著升高(F=9.702,P<0.01),随后逐渐降低(F=0.020~9.690,P>0.05);HIF-1α蛋白表达水平于转染后12、24、48 h均显著升高(F=21.186~24.559,P<0.01),72 h降低(F=4.639,P>0.05)。见图5。
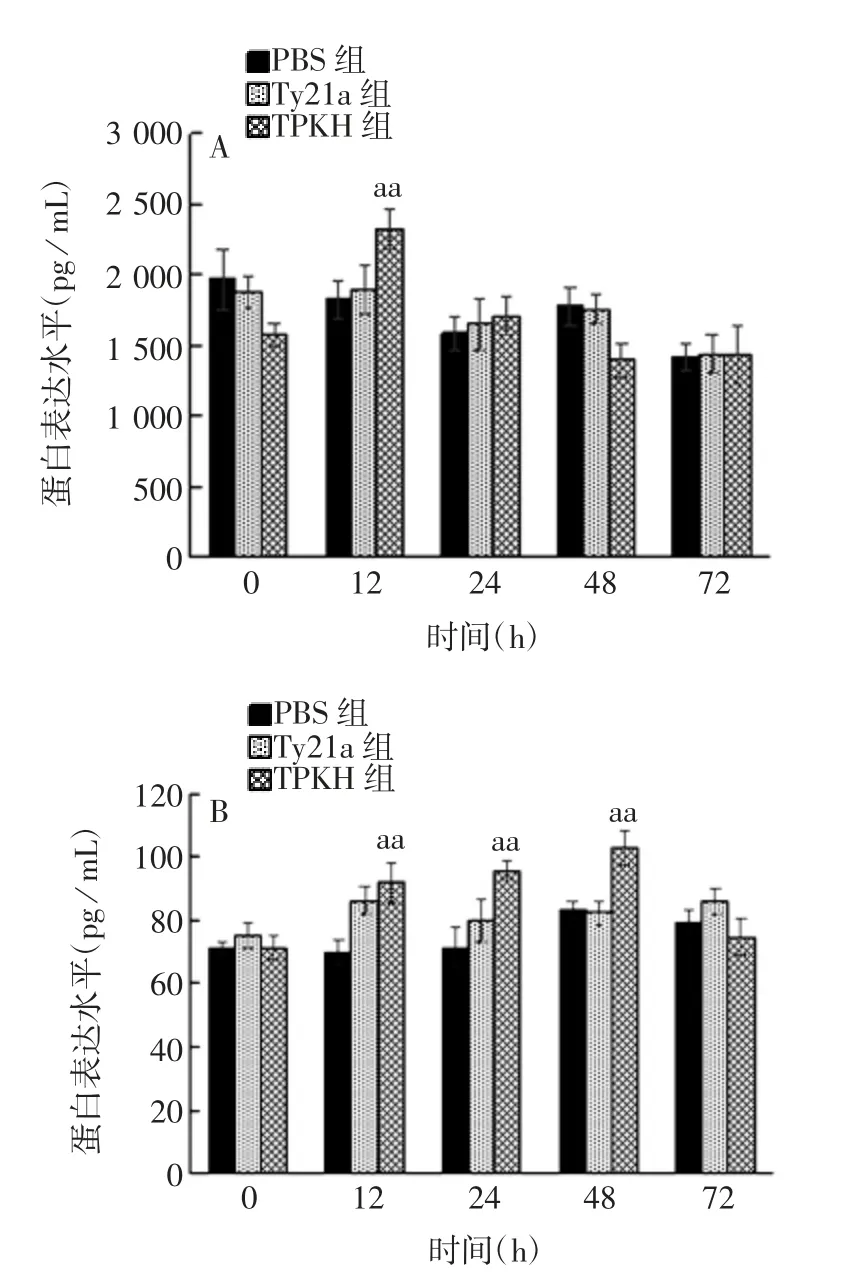
图5 不同转染时间时IEC-6细胞中KGF(A)和HIF-1α(B)蛋白的表达水平Fig.5 Expression levelsof KGF(A)and HIF-1α(B)in IEC-6 cells after infection for various hours
2.5 T P KH代次对I E C-6细胞中K G F和H I F-1α蛋白表达水平的影响 与PBS组比较,各代TPKH接种IEC-6细胞中的KGF及HIF-1α的蛋白表达水平均明显增加(F=285.616~92.114,P<0.01);各代间的KGF及HIF-1α的蛋白表达水平差异无统计学意义(F=0.851~1.846,P>0.05),见图6。表明代次对TPKH转染细胞后的蛋白表达水平无明显影响。
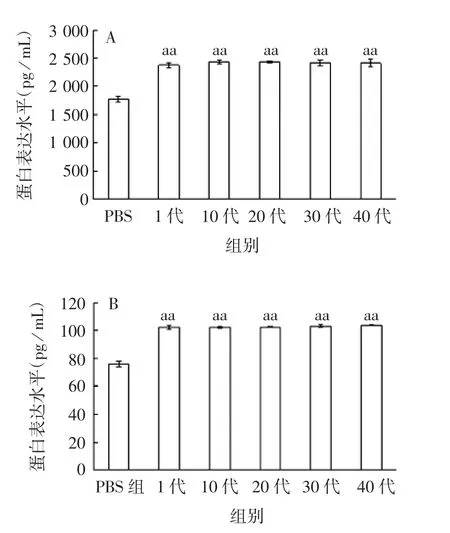
图6 不同代次TPKH感染IEC-6细胞中KGF(A)和HIF-1α(B)蛋白的表达水平Fig.6 Expression levelsof KGF(A)and HIF-1α(B)in IEC-6 cells infected with TPKH of various passages
3 讨论
机体遭受严重创伤、烧伤、感染时可引起机体缺血、缺氧,从而诱发急性胃肠黏膜糜烂、溃疡,甚至出血和穿孔,该现象称为胃肠应激损伤,是一种较常见的临床疾病[8]。虽然目前的防治方法较多,如抗生素及中药治疗等,但疗效均不佳。研究证实,KGF及HIF-1α能够在机体缺血、缺氧的状态下促进胃肠上皮细胞增殖、局部血管形成及胃肠道黏膜损伤愈合等,具有良好的防治缺血、缺氧引起胃肠应激损伤的功能[9-10]。
KGF是成纤维细胞生长因子家族的一员,又称为成纤维细胞生长因子7(fibroblast growth factor-7,KGF7),是一种间充质细胞衍生的旁分泌生长因子,参与表皮的稳态调节[11]。研究证实,在低氧状态下,KGF对胃肠上皮细胞生长和维持有许多有益的作用,既能够增强胃肠上皮的屏障功能,又能促进胃肠上皮细胞的增殖,减轻胃肠黏膜损伤[12]。HIF-1α是HIF-1的亚基,可被低氧诱导,常氧下含量较少,当机体处于低氧状态时,HIF-1能够高表达[13]。近年研究证实,在缺氧状态下,HIF-1参与血管生成、葡萄糖代谢、细胞增殖、细胞存活等生理反应,增加机体对缺氧的耐受性,保护机体免受低氧的损伤[14-16]。
本实验将TPKH在Amp(+)和Amp(-)的LB平板上连续传40代后,多项检测结果表明,每10代间菌体和菌落的形态基本一致,均符合沙门菌的形态特征;质粒浓度稳定,变化较小,表明传代次数对减毒沙门菌的生长不产生影响,质粒不会随着传代而丢失;传代后TPKH每5代均可扩增出KGF、HIF-1α、CMV基因片段(分别为443、2 492和140 bp),表明在传代过程中,KGF和HIF-1α不会随传代次数的增加而丢失。另外,初始代TPKH转染IEC-6细胞后,KGF和HIF-1α蛋白水平转染12 h时显著上升(P<0.01),每10代间的蛋白表达水平差异无统计学意义(P>0.05),表明传代次数不影响TPKH转染细胞后KGF和HIF-1α蛋白的表达。
综上所述,TPKH的遗传稳定性较好,在连续传代40代后,仍能稳定表达其所携带的目的基因,本实验为TPKH制剂的大规模生产奠定了基础。
